DIU de cobre - Copper IUDs
| DIU de cobre | |
|---|---|
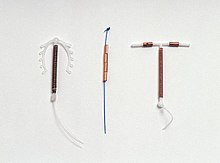
 Foto de um DIU comum (Paragard T 380A)
| |
| Fundo | |
| Modelo | Intra-uterino |
| Primeiro uso | Década de 1970 |
| Nomes comerciais | cobre-T, ParaGard, outros |
| AHFS / Drugs.com | Informações sobre medicamentos profissionais da FDA |
| Taxas de falha (primeiro ano) | |
| Uso perfeito | 0,6% |
| Uso típico | 0,8% |
| Uso | |
| Efeito de duração | 5–12 + anos |
| Reversibilidade | rápido |
| Lembretes de usuário | Verifique a posição da linha após cada período. Removido logo após a menopausa, se não antes. |
| Avaliação clínica | Anualmente |
| Vantagens e desvantagens | |
| Proteção STI | Não |
| Períodos | Pode ser mais pesado e mais doloroso |
| Benefícios | Desnecessário realizar qualquer ação diária. Contracepção de emergência se inserida dentro de 5 dias |
| Riscos | Risco pequeno de PID nos primeiros 20 dias após a inserção. Raramente, perfuração uterina. |
O dispositivo intra-uterino (DIU) com cobre , também conhecido como bobina intra-uterina , é um tipo de dispositivo intra-uterino que contém cobre . É usado para controle de natalidade e anticoncepção de emergência dentro de cinco dias de sexo desprotegido . É uma das formas mais eficazes de controle de natalidade, com uma taxa de insucesso de um ano em torno de 0,7%. O dispositivo é colocado no útero e dura até doze anos. Pode ser usado por mulheres de todas as idades, independentemente de terem ou não filhos. Após a remoção, a fertilidade retorna rapidamente.
Alguns efeitos colaterais podem ser períodos menstruais intensos , raramente o dispositivo pode sair. É menos recomendado para pessoas com alto risco de infecções sexualmente transmissíveis , pois pode aumentar o risco de doença inflamatória pélvica nas primeiras três semanas após a inserção. É recomendado para pessoas que não toleram ou dificilmente toleram anticoncepcionais hormonais. Se uma mulher engravidar com um DIU colocado, a remoção é recomendada. Muito raramente, a perfuração uterina pode ocorrer durante a inserção se não for feita corretamente. O DIU de cobre é um tipo de controle de natalidade reversível de ação prolongada . Ele age principalmente matando o esperma .
O DIU de cobre passou a ser usado na medicina na década de 1970. Está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde . Eles são usados por mais de 170 milhões de mulheres em todo o mundo.
Usos médicos
O DIU de cobre é uma forma de contracepção reversível de ação prolongada e uma das formas mais eficazes de controle de natalidade disponíveis. O tipo de estrutura e a quantidade de cobre podem afetar a eficácia de diferentes modelos de DIU de cobre. As taxas de falha para diferentes modelos variam entre 0,1 e 2,2% após 1 ano de uso. Os modelos em forma de T com uma área de superfície de 380 mm² de cobre apresentam as taxas de falha mais baixas. O TCu 380A (ParaGard) tem uma taxa de falha de um ano de 0,8% e uma taxa de falha cumulativa de 12 anos de 2,2%. Ao longo de 12 anos de uso, os modelos com menos área de superfície de cobre apresentam maiores taxas de falha. O TCu 220A tem uma taxa de falha de 12 anos de 5,8%. O GyneFix sem moldura tem uma taxa de falha de menos de 1% ao ano. Em todo o mundo, modelos mais antigos de DIU com taxas de eficácia mais baixas não são mais produzidos.
Ao contrário de outras formas de contracepção reversível, a taxa de falha de uso típica e a taxa de falha de uso perfeita para o DIU de cobre são as mesmas porque o DIU não depende da ação do usuário. Uma revisão de 2008 dos DIUs de cobre em forma de T disponíveis recomendou que o TCu 380A e o TCu 280S fossem usados como a primeira escolha para DIUs de cobre porque esses dois modelos têm as menores taxas de falha e a maior longevidade. A eficácia do DIU de cobre (taxa de falha de 0,8%) é comparável à esterilização tubária (taxa de falha de 0,5%) no primeiro ano. No entanto, os efeitos do DIU de cobre são reversíveis, o que pode ser visto como uma vantagem ou uma desvantagem, dependendo dos objetivos de contracepção de uma pessoa.
Contracepção de emergência
Foi descoberto pela primeira vez em 1976 que o DIU de cobre poderia ser usado como uma forma de anticoncepção de emergência (CE). O DIU de cobre é a forma mais eficaz de anticoncepção de emergência. É mais eficaz do que as pílulas hormonais de CE atualmente disponíveis. A taxa de gravidez entre aquelas que usam o DIU de cobre para CE é de 0,09%. Pode ser usado para CE em até cinco dias após o ato sexual desprotegido e não diminui sua eficácia durante os cinco dias. Uma vantagem adicional de usar o DIU de cobre para anticoncepção de emergência é que ele pode ser usado como forma de controle de natalidade por 10 a 12 anos após a inserção.
Remoção e retorno à fertilidade
A remoção do DIU de cobre também deve ser realizada por um médico qualificado. A fertilidade voltou aos níveis anteriores rapidamente após a remoção do dispositivo. Um estudo descobriu que o tempo médio desde a remoção até a gravidez planejada foi de três meses para as mulheres que usaram o TCu 380Ag.
Efeitos colaterais
Expulsão : às vezes, o DIU de cobre pode ser expelido espontaneamente do útero. As taxas de expulsão podem variar de 2,2% a 11,4% dos usuários do primeiro ao 10º ano. O TCu380A pode ter taxas de expulsão mais baixas do que outros modelos. Corrimento vaginal incomum, cólicas ou dor, manchas entre os períodos, manchas pós-coito (após o sexo), dispareunia ou a ausência ou alongamento dos fios podem ser sinais de uma possível expulsão. Se ocorrer expulsão, a mulher não estará protegida contra a gravidez. Se um DIU com cobre for inserido após a expulsão, o risco de reexpulsão foi estimado em um estudo em aproximadamente um terço dos casos após um ano. A ressonância magnética (MRI) pode causar o deslocamento de um DIU de cobre e, portanto, é recomendável verificar a localização do DIU antes e depois da ressonância magnética.

Perfuração : muito raramente, o DIU pode se mover através da parede do útero. O risco de perfuração é determinado principalmente pela habilidade do profissional que realiza a inserção. Para médicos experientes, o risco de perfuração é de 1 por 1.000 inserções ou menos. Recomenda-se consultar um obstetra / ginecologista, que possua equipamentos para inserir corretamente o DIU e verificar se ele não se move durante os meses seguintes à inserção.
Infecção : A inserção de um DIU de cobre representa um risco transitório de doença inflamatória pélvica (DIP) nos primeiros 21 dias após a inserção. No entanto, é um risco pequeno e pode ser atribuído à gonorréia ou infecção por clamídia preexistente no momento da inserção, e não ao próprio DIU. Os procedimentos adequados de prevenção de infecções têm pouco ou nenhum efeito no curso das infecções por gonorréia ou clamídia, mas são importantes para ajudar a proteger clientes e profissionais de saúde contra infecções em geral. Essas práticas de prevenção de infecção incluem lavar as mãos e, em seguida, colocar luvas, limpar o colo do útero e a vagina, fazer contato mínimo com superfícies não estéreis (usando uma "técnica de inserção sem toque") e, após o procedimento, lavar as mãos novamente e, em seguida, processar os instrumentos . O próprio dispositivo não apresenta risco aumentado de PID além do momento da inserção.
Cólicas : algumas mulheres podem sentir cólicas durante o processo de inserção do DIU e imediatamente depois como resultado da dilatação do colo do útero durante a inserção. Tomar AINEs antes do procedimento costuma reduzir o desconforto, como o uso de um anestésico local . O misoprostol 6 a 12 horas antes da inserção pode ajudar na dilatação cervical. Algumas mulheres podem ter cólicas por 1 a 2 semanas após a inserção.
Períodos mais intensos : o DIU de cobre pode aumentar a quantidade de fluxo sanguíneo durante os períodos menstruais de uma mulher . Em média, a perda de sangue menstrual pode aumentar em 20–50% após a inserção de um DIU de cobre-T; Este sintoma pode desaparecer para algumas mulheres após 3 a 6 meses.
Sangramento irregular e manchas : Para algumas mulheres, o DIU de cobre pode causar manchas entre os períodos durante os primeiros 3 a 6 meses após a inserção.
Gravidez : embora seja raro, se a gravidez ocorrer com o DIU de cobre colocado, pode haver efeitos colaterais. O risco de gravidez ectópica para uma mulher que usa DIU é menor do que o risco de gravidez ectópica para uma mulher que não usa nenhum método anticoncepcional. No entanto, das gestações que ocorrem durante o uso do DIU, uma porcentagem maior do que o esperado (3–4%) é ectópica. Se ocorrer uma gravidez com o DIU colocado, há um risco maior de aborto espontâneo ou parto prematuro. Se isso ocorrer e os fios do DIU estiverem visíveis, o DIU deve ser removido imediatamente por um médico. Embora o DIU Dalkon Shield tenha sido associado a abortos sépticos (infecções associadas a aborto espontâneo), outras marcas de DIU não estão. O DIU também não está associado a defeitos congênitos .
Alguns anticoncepcionais de barreira protegem contra DSTs . Os contraceptivos hormonais reduzem o risco de desenvolver doença inflamatória pélvica (DIP), uma complicação séria de certas ISTs. Os DIUs, por outro lado, não protegem contra DSTs ou DIP.
Contra-indicações
Uma condição de categoria 3 indica condições em que os riscos teóricos ou comprovados geralmente superam as vantagens de inserir um DIU de cobre. Uma condição de categoria 4 indica condições que representam um risco inaceitável para a saúde se um DIU de cobre for inserido.
As mulheres não devem usar um DIU de cobre se:
(Categoria 4)
- Estão grávidas ou pensam que podem estar grávidas
- Ter uma gravidez séptica ou aborto
- Tem sangramento vaginal anormal inexplicável
- Têm câncer cervical não tratado
- Tem doença trofoblástica gestacional maligna
- Tem câncer uterino
- Têm certas anormalidades uterinas
- Teve ou pode ter tido uma infecção pélvica nos últimos três meses
- Teve ou pode ter uma IST
- Tem tuberculose pélvica
(Categoria 3)
- São pós-parto entre 48 horas e 4 semanas (aumento da taxa de expulsão do DIU com inserção pós-parto atrasada). Os critérios do CDC e da OMS diferem em sua recomendação para mulheres no pós-parto entre 48 horas e 4 semanas. O CDC não lista isso como uma contra-indicação.
- Ter doença trofoblástica gestacional benigna
- Tem câncer de ovário
- Ter AIDS (a menos que esteja clinicamente bem com terapia anti-retroviral )
- Têm uma probabilidade individual muito elevada de exposição à gonorreia ou ITS por clamídia
Uma lista completa de contra-indicações pode ser encontrada nos Critérios de Elegibilidade Médica para Uso de Contraceptivos da Organização Mundial da Saúde (OMS) e nos Critérios Médicos de Elegibilidade para Uso de Contraceptivos dos Centros de Controle e Prevenção de Doenças (CDC) dos Estados Unidos .
Ser nulípara (mulheres que nunca deram à luz) não é uma contra-indicação para o uso de DIU. Os DIUs são seguros e aceitáveis mesmo em mulheres jovens nulíparas. O mesmo é provavelmente o caso para mulheres virgens , a menos que haja um hímen microperfurado que obstrua a inserção do DIU.
Descrição do dispositivo
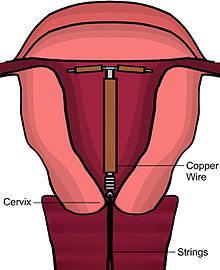
Existem vários modelos de DIU de cobre disponíveis em todo o mundo. A maioria dos dispositivos de cobre consiste em um núcleo de plástico envolto em um fio de cobre. Muitos dos dispositivos têm um formato de T semelhante ao DIU hormonal . No entanto, também existem DIUs de cobre "sem moldura" disponíveis. O Paragard é o único modelo disponível atualmente nos Estados Unidos. Pelo menos três modelos de DIU de cobre estão disponíveis no Canadá, dois dos quais são uma versão mais fina em forma de T usada por mulheres que não tiveram filhos. Os primeiros DIUs de cobre tinham cobre apenas em torno da haste vertical, mas os modelos mais recentes também têm mangas de cobre enroladas nos braços horizontais, aumentando a eficácia.
Alguns modelos mais recentes também contêm um núcleo de prata em vez de um núcleo de plástico para atrasar a fragmentação do cobre, bem como aumentar a vida útil do dispositivo. A vida útil dos dispositivos varia de 3 a 10 anos; no entanto, alguns estudos demonstraram que o TCu 380A pode ser eficaz por 12 anos.
Seu código ATC é G02BA ( WHO ).
Inserção
O DIU de cobre deve ser inserido por um médico qualificado. Recomenda-se consultar um obstetra / ginecologista, que possua equipamentos para inserir corretamente o DIU e verificar se ele não se move durante os meses seguintes à inserção. Um DIU de cobre pode ser inserido em qualquer fase do ciclo menstrual, mas o momento ideal é logo após o período menstrual, quando o colo do útero está mais macio e a mulher tem menos probabilidade de estar grávida. O processo de inserção geralmente leva cinco minutos ou menos. O procedimento pode causar cólicas ou ser doloroso para algumas mulheres. Antes da colocação de um DIU, um histórico médico e exame físico por um profissional médico são úteis para verificar quaisquer contra-indicações ou preocupações. Também é recomendado por alguns médicos que os pacientes sejam testados para gonorreia e clamídia , pois essas duas infecções aumentam o risco de contrair doença inflamatória pélvica logo após a inserção.
Imediatamente antes da inserção, o médico realizará um exame pélvico para determinar a posição do útero. Após o exame pélvico, a vagina é mantida aberta com um espéculo . Um tenáculo é usado para estabilizar o colo do útero e o útero. A sondagem uterina pode ser usada para medir o comprimento e a direção do canal cervical e do útero, a fim de diminuir o risco de perfuração uterina . O DIU é colocado usando um tubo estreito, que é inserido através do colo do útero. Fios curtos de monofilamento de plástico / náilon pendem do útero para a vagina. O médico cortará os fios de modo que fiquem apenas 3 a 4 cm fora do colo do útero e permaneçam na parte superior da vagina. Os fios permitem que o paciente ou médico verifique periodicamente se o DIU ainda está no lugar e para permitir a fácil remoção do dispositivo.
O DIU de cobre pode ser inserido a qualquer momento do ciclo menstrual da mulher, desde que a mulher não esteja grávida. Um DIU também pode ser inserido imediatamente após o parto e após o aborto, desde que nenhuma infecção tenha ocorrido. A amamentação não é uma contra-indicação para o uso do DIU de cobre. O DIU pode ser inserido em mulheres com HIV ou AIDS, pois não aumenta o risco de transmissão. Embora não fosse recomendado anteriormente para mulheres nulíparas (mulheres que não tiveram filhos), o DIU agora é recomendado para a maioria das mulheres que já passaram da menarca (primeiro período menstrual), incluindo adolescentes.
Após o término da inserção, atividades normais como sexo, exercícios e natação podem ser realizadas assim que for confortável. A atividade física extenuante não afeta a posição do DIU.
Tipos
Muitos tipos diferentes de DIU de cobre são fabricados atualmente em todo o mundo, mas a disponibilidade varia de acordo com o país. Nos Estados Unidos, apenas um tipo de DIU de cobre é aprovado para uso, enquanto no Reino Unido, mais de dez variedades estão disponíveis. Uma empresa, a Mona Lisa NV , oferece versões genéricas de muitos DIUs existentes.
| DIU | Modelo | Largura
(milímetros) |
Comprimento (mm) | Cobre (mm 2 ) | Vida (anos) | Fabricante | Características diferenciadoras |
|---|---|---|---|---|---|---|---|
| Gyneplus Cu 380 | Em forma de T | 380 | 5 | Dispo.Cont. | |||
| Multiload Cu375 | Em forma de U | 20,5 | 35 | 375 | 5 | Multilan | |
| Multiload Cu250 | Em forma de U | 250 | 3 | Multilan | |||
| Multi-Safe 375 | Em forma de U | 19,5 | 32,5 | 375 | 5 | Williams Medical Supplies | |
| Multi-Safe 375 Short Loop | Em forma de U | 375 | 5 | Williams Medical Supplies | |||
| Carregar 375 | Em forma de U | 19,5 | 32,5 | 375 | 5 | 7-MED Industrie | |
| Nova-T 380 | Em forma de T (simples) | 32 | 32 | 380 | 5 | Bayer | |
| Neo-Safe T 380 | Em forma de T (simples) | 32 | 32 | 380 | 5 | Durbin | |
| Neo-Safe T 380 Mini | Em forma de T (simples) | 24 | 30 | 380 | 5 | Durbin | |
| UT 380 | Em forma de T (simples) | 32 | 32 | 380 | 5 | Laboratoire CCD | |
| UT 380 Short | Em forma de T (simples) | 32 | 28,4 | 380 | 5 | Laboratoire CCD | |
| Flexi-T 300 | Em forma de T (simples) | 23 | 29 | 300 | 5 | Prosan | |
| Flexi-T + 300 | Em forma de T (simples) | 28 | 32 | 300 | 5 | Prosan | Braços mais largos do que Flexi-T 300 |
| T-safe CU 380A | Em forma de T (com faixas) | 31,8 | 35,8 | 380 | 8 | Durbin | |
| Flexi-T + 380 | Em forma de T (com faixas) | 28 | 32 | 380 | 5 | Prosan | |
| TT 380 Slimline | Em forma de T (com faixas) | 31,8 | 35,8 | 380 | 10 | 7-MED Industrie | |
| TT 380 Mini | Em forma de T (com faixas) | 23,2 | 29,5 | 380 | 5 | 7-MED Industrie | |
| Paragard | Em forma de T (com faixas) | 32 | 36 | 380 | 10 | Duramed | Somente DIU de cobre atualmente aprovado pelo FDA dos EUA |
| Gynefix 330 (padrão) | Frameless | 2,2 | 30 | 330 | 5 ou 10 | Contrel | Apenas a marca de DIU sem moldura disponível |
| Gynefix 200 (mini) | Frameless | 200 | 5 | Contrel | Apenas a marca de DIU sem moldura disponível | ||
| IUB SCu300A / B | Esférico (3D) | 300 | 5 | OCON | Quadro tubular em liga de nitinol. O nome da marca é Ballerine. | ||
| SMB TCu 380A | Em forma de T (com faixas) | 32 | 36 | 380 | 10 | SMB corp | Fabricante de DIU pré-qualificado pela OMS UNFPA |
| Proteger TCu 380A | Em forma de T (com faixas) | 380 | 12 | SMB corp | Fabricante de DIU pré-qualificado pela OMS UNFPA | ||
| Proteger Multi-braço Cu 375 padrão | Em forma de U | 375 | 5 | SMB corp | Fabricante de DIU pré-qualificado pela OMS UNFPA | ||
| Proteger multi-braço Cu 375 curto | Em forma de U | 375 | 5 | SMB corp | Fabricante de DIU pré-qualificado pela OMS UNFPA |
DIU sem moldura
O DIU sem moldura elimina o uso da moldura que dá aos DIUs convencionais seu formato em T característico. Essa mudança no desenho foi feita para reduzir o desconforto e a expulsão associados a DIUs anteriores; sem uma moldura sólida, o DIU sem moldura deve se moldar ao formato do útero. Pode reduzir as taxas de expulsão e descontinuação em comparação com os DIUs de cobre com moldura.
Gynefix é a única marca de DIU sem moldura disponível atualmente. Consiste em tubos ocos de cobre em fio de polipropileno . É inserido através do colo do útero com um aplicador especial que sutura o fio ao fundo (topo) do útero ; o fio é então cortado com uma cauda pendurada para fora do colo do útero, semelhante aos DIUs de armação. Quando essa cauda é puxada, a sutura é desfeita e o dispositivo pode ser removido. Isso requer mais força do que a remoção de um DIU em forma de T, mas resulta em um desconforto comparável durante a remoção. Gynefix não foi aprovado para uso nos Estados Unidos.
Mecanismo de ação
O principal mecanismo de ação do DIU de cobre é prevenir a fertilização. O cobre atua como um espermicida no útero. A presença de cobre aumenta os níveis de íons cobre, prostaglandinas e glóbulos brancos nos fluidos uterino e tubário.
Embora não seja um mecanismo de ação primário, alguns especialistas em reprodução humana acreditam que há evidências suficientes para sugerir que o DIU com cobre pode interromper a implantação, especialmente quando usado para contracepção de emergência . Apesar disso, não há evidência definitiva de que as usuárias de DIU tenham taxas mais altas de perda embrionária do que as mulheres que não usam anticoncepcionais. Portanto, o DIU de cobre é considerado um verdadeiro anticoncepcional e não um abortivo.
Uso
Globalmente, o DIU é o método anticoncepcional reversível mais amplamente utilizado. Os dados mais recentes indicam que há 169 milhões de usuários de DIU em todo o mundo. Isso inclui o DIU não hormonal e hormonal. Os DIUs são mais populares na Ásia, onde a prevalência é de quase 30%. Na África e na Europa, a prevalência é de cerca de 20%. Em 2009, os níveis de uso de DIU nos Estados Unidos eram estimados em 5,5%. Os dados nos Estados Unidos não fazem distinção entre DIUs hormonais e não hormonais. Na Europa, a prevalência de DIU de cobre varia de menos de 5% no Reino Unido a mais de 10% na Dinamarca em 2006.
História
De acordo com a lenda popular, os comerciantes árabes inseriam pequenas pedras no útero de seus camelos para evitar a gravidez durante longas caminhadas pelo deserto. A história era originalmente um conto exagerado para entreter os delegados em uma conferência científica sobre planejamento familiar ; embora mais tarde tenha sido repetido como verdade, não tem base histórica conhecida.
Os precursores dos DIUs foram comercializados pela primeira vez em 1902. Desenvolvidos a partir de pessários de haste (onde a haste mantinha o pessário no lugar sobre o colo do útero), a "haste" desses dispositivos na verdade se estendia até o próprio útero. Por ocupar a vagina e o útero, esse tipo de pessário-tronco também era conhecido como dispositivo interuterino . O uso de dispositivos interuterinos foi associado a altas taxas de infecção; por isso, foram condenados pela comunidade médica.
O primeiro dispositivo intrauterino (contido inteiramente no útero) foi descrito em uma publicação alemã em 1909, embora o autor pareça nunca ter comercializado seu produto.
Em 1929, Ernst Gräfenberg, da Alemanha, publicou um relatório sobre um DIU feito de sutura de seda. Ele havia encontrado uma taxa de gravidez de 3% entre 1.100 mulheres que usavam seu anel. Em 1930, Gräfenberg relatou uma taxa de gravidez mais baixa de 1,6% entre 600 mulheres que usavam um anel melhorado envolto em fio de prata. Sem o conhecimento de Gräfenberg, o fio de prata estava contaminado com 26% de cobre. O papel do cobre no aumento da eficácia do DIU não seria reconhecido até quase 40 anos depois.
Em 1934, o médico japonês Tenrei Ota desenvolveu uma variação do anel de Gräfenberg que continha uma estrutura de suporte no centro. A adição deste disco central reduziu a taxa de expulsão do DIU. Esses dispositivos ainda apresentavam altas taxas de infecção e seu uso e desenvolvimento foram ainda mais sufocados pela política da Segunda Guerra Mundial: a contracepção era proibida tanto na Alemanha nazista quanto no Japão, aliado do Eixo. Os Aliados não souberam do trabalho de Gräfenberg e Ota até bem depois do fim da guerra.
O primeiro DIU de plástico, o Margulies Coil ou Margulies Spiral , foi lançado em 1958. Esse dispositivo era um tanto grande, causando desconforto a uma grande proporção de mulheres usuárias, e tinha uma cauda de plástico duro, causando desconforto aos seus parceiros masculinos. O coloquialismo moderno "bobina" é baseado no design em forma de bobina dos primeiros DIUs.
O Lippes Loop , um dispositivo ligeiramente menor com cauda de monofilamento, foi lançado em 1962 e ganhou popularidade em relação ao dispositivo Margulies.
O DIU de anel único de aço inoxidável foi desenvolvido na década de 1970 e amplamente utilizado na China devido aos baixos custos de fabricação. O governo chinês proibiu a produção de DIUs de aço em 1993 devido às altas taxas de falhas (até 10% ao ano).
Howard Tatum, nos Estados Unidos, concebeu o DIU de plástico em forma de T em 1968. Pouco depois, Jaime Zipper, no Chile, apresentou a ideia de adicionar cobre aos dispositivos para melhorar sua eficácia contraceptiva. Verificou-se que os dispositivos contendo cobre podem ser feitos em tamanhos menores sem comprometer a eficácia, resultando em menos efeitos colaterais , como dor e sangramento. Dispositivos em forma de T tiveram taxas mais baixas de expulsão devido à sua maior semelhança com o formato do útero.
O DIU de plástico Dalkon Shield mal projetado (que tinha uma cauda multifilamento) foi fabricado pela AH Robins Company e vendido pela Robins nos Estados Unidos por três anos e meio de janeiro de 1971 a junho de 1974, antes de as vendas serem suspensas pela Robins em junho 28, 1974, a pedido do FDA devido a questões de segurança após relatos de 110 abortos sépticos espontâneos em mulheres com o Escudo Dalkon instalado, sete das quais morreram. Robins interrompeu as vendas internacionais do Dalkon Shield em abril de 1975.
Tatum desenvolveu muitos modelos diferentes de DIU de cobre. Ele criou o TCu220 C, que tinha coleiras de cobre em vez de filamento de cobre, o que evitava a perda de metal e aumentava a vida útil do dispositivo. Os DIUs de cobre-T de segunda geração também foram introduzidos na década de 1970. Esses dispositivos tinham áreas de superfície maiores de cobre e, pela primeira vez, alcançaram taxas de eficácia consistentemente superiores a 99%. O último modelo desenvolvido pela Tatum foi o TCu380A, o modelo mais recomendado atualmente. Além dos DIUs em forma de T, há também DIUs em forma de U (como o Multiload) e Gravigard Copper 7 em forma de 7 (com uma versão em miniatura para mulheres nulíparas introduzida na década de 1980). Mais recentemente, um DIU sem moldura chamado Gynefix foi introduzido.
Marcas
O ParaGard T-380A é um DIU com cobre, fabricado e comercializado nos Estados Unidos pela The Cooper Companies . É o único dispositivo intrauterino contendo cobre aprovado para uso nos Estados Unidos (três dispositivos uterinos hormonais, Mirena , Skyla e Liletta também estão aprovados). O ParaGard consiste em uma estrutura de polietileno em forma de T enrolada com fio de cobre, juntamente com dois fios de monofilamento para auxiliar na remoção do DIU.
O ParaGard T 380A foi desenvolvido na década de 1970 pelo Population Council and Finishing Enterprises Inc. (FEI). O novo pedido de medicamento ParaGard do Population Council (NDA) foi aprovado pela Food and Drug Administration (FDA) e a FEI começou a fabricá-lo para distribuição fora dos Estados Unidos em 1984. GynoPharma (originalmente GynoMed) começou a comercializá-lo nos EUA em maio de 1988 Em 2 de agosto de 1995, a Ortho-McNeil adquiriu a GynoPharma e começou a comercializar o ParaGard nos Estados Unidos. Em 1o de janeiro de 2004, a FEI Women's Health adquiriu a patente do Population Council e os direitos de marketing nos Estados Unidos da Ortho-McNeil. Em 10 de novembro de 2005, a Duramed Pharmaceuticals, uma subsidiária da Barr Pharmaceuticals , adquiriu a FEI Women's Health e a ParaGard. Em 18 de julho de 2008, foi anunciado que a Teva Pharmaceutical Industries Ltd. iria adquirir a Barr Pharmaceuticals.
Em 1 de novembro de 2017, a The Cooper Companies adquiriu a Paragard da Teva Pharmaceutical Industries por aproximadamente US $ 1,1 bilhão.
A aprovação original do ParaGard pela FDA em 1984 foi para 4 anos de uso contínuo, mais tarde estendido para 6 anos em 1989, depois 8 anos em 1991 e 10 anos em 1994. ( código ATC G02BA02 ( OMS ))