Tenofovir alafenamida - Tenofovir alafenamide
 | |
| Dados clínicos | |
|---|---|
| Pronúncia | / ˌ t ə n oʊ f ə v ɪər ˌ Æ l ə f ɛ n ə m aɪ d / |
| Nomes comerciais | Vemlidy Genvoya (com elvitegravir , cobicistat e emtricitabina ) Odefsey (com emtricitabina e rilpivirine ) Descovy (com emtricitabina) Symtuza (com darunavir , cobicistat , e emtricitabina) |
| Outros nomes | GS-7340 |
| AHFS / Drugs.com | Monografia |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Por via oral ( comprimidos ) |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Ligação proteica | ~ 80% |
| Meia-vida de eliminação | 0,51 hora |
| Excreção | Fezes (31,7%), urina (<1%) |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| Dados químicos e físicos | |
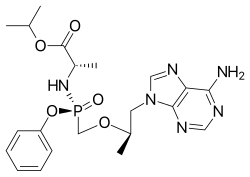
| Fórmula | C 21 H 29 N 6 O 5 P |
| Massa molar | 476,474 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |

Tenofovir alafenamida , vendido sob a marca Vemlidy , é um medicamento inibidor da transcriptase reversa do nucleotídeo do vírus da hepatite B (HBV) para o tratamento da infecção crônica pelo vírus da hepatite B (HBV) em adultos com doença hepática compensada . É tomado por via oral.
Tenofovir alafenamida é um pró - fármaco do tenofovir . Foi desenvolvido pela Gilead Sciences com base na tecnologia protida de Chris McGuigan para uso no tratamento de HIV / AIDS e hepatite B crônica e é aplicado na forma de tenofovir fumarato de alafenamida (TAF). Intimamente relacionado ao inibidor da transcriptase reversa tenofovir disoproxil fumarato (TDF) comumente usado , o TAF tem maior atividade antiviral e melhor distribuição nos tecidos linfoides do que esse agente. O Vemlidy foi aprovado pela Food and Drug Administration (FDA) dos EUA em novembro de 2016.
Gilead anunciou um ensaio clínico de Fase III avaliando um regime de comprimido único combinando tenofovir alafenamida com cobicistate , emtricitabina e elvitegravir e desenvolveu uma coformulação do medicamento com cobicistate, emtricitabina e o inibidor da protease darunavir . Em um estudo de 48 semanas comparando elvitegravir / cobicistate / emtricitabina / tenofovir disoproxil (nome comercial Stribild ) com elvitegravir / cobicistate / emtricitabina / tenofovir alafenamida (nome comercial Genvoya ), os resultados mostraram que o medicamento mais recente não era inferior ao agente estabelecido, em dosagens muito mais baixas e com menor incidência de efeitos colaterais adversos, como função renal prejudicada. O FDA aprovou o regime de tratamento baseado em TAF para o tratamento do HIV-1 em novembro de 2015. Genvoya é o primeiro regime baseado em TAF a receber aprovação.
Combinações de dose fixa contendo tenofovir alafenamida
- Elvitegravir / cobicistat / emtricitabina / tenofovir alafenamida (nome comercial Genvoya) - aprovado nos Estados Unidos e na União Europeia em novembro de 2015 (compare Elvitegravir / cobicistat / emtricitabina / tenofovir ; nome comercial Stribild)
- Emtricitabina / rilpivirina / tenofovir alafenamida (nome comercial Odefsey) - aprovado nos Estados Unidos em março de 2016 e na União Europeia em junho de 2016 (compare emtricitabina / rilpivirina / tenofovir ; nome comercial Complera)
- Emtricitabina / tenofovir alafenamida (nome comercial Descovy) - aprovado nos Estados Unidos em abril de 2016 (compare com Emtricitabina / tenofovir ; nome comercial Truvada). Em outubro de 2019, o Descovy foi aprovado nos Estados Unidos para a profilaxia pré-exposição ao HIV-1 (PrEP).
- Bictegravir / emtricitabina / tenofovir alafenamida (nome comercial Biktarvy) - aprovado nos Estados Unidos em fevereiro de 2018.
- Darunavir / cobicistat / emtricitabina / tenofovir alafenamida (marca Symtuza) - aprovado na União Europeia em setembro de 2017, nos Estados Unidos em julho de 2018 e na Austrália em novembro de 2019.
- Dolutegravir / emtricitabina / tenofovir alafenamida.
Referências
links externos
- "Tenofovir alafenamida" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- Fumarato de tenofovir alafenamida " . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
