Câncer orofaríngeo HPV-positivo - HPV-positive oropharyngeal cancer
| Câncer orofaríngeo positivo para vírus do papiloma humano | |
|---|---|
| Outros nomes | HPV16 + câncer orofaríngeo, HPV16 + OPC |
 | |
| Imagem microscópica de tumor mostrando positividade para HPV por hibridização in situ | |
| Especialidade |
Oncologia |
| Sintomas | Ferida ou bolhas na parte de trás da boca, dificuldade para falar, engolir ou respirar, inchaço no pescoço, perda de apetite, perda de peso e fraqueza |
| Causas | Vírus do papiloma humano |
| Fatores de risco | contato sexual oral |
| Método de diagnóstico | Endoscopia , biópsia , coloração para p16 , tomografia computadorizada , |
| Diagnóstico diferencial | Câncer orofaríngeo associado ao tabaco |
| Prevenção | Vacinação |
| Tratamento | Cirurgia , radiação , quimioterapia |
| Frequência | 22.000 casos globalmente (2008) |
O câncer orofaríngeo positivo para o papilomavírus humano ( OPC ou HPV + OPC ) é um câncer ( carcinoma de células escamosas ) da garganta causado pelo vírus do papilomavírus humano tipo 16 (HPV16). No passado, o câncer de orofaringe (garganta) estava associado ao uso de álcool ou tabaco ou ambos, mas a maioria dos casos agora está associada ao vírus HPV , adquirido por contato oral com os órgãos genitais ( sexo oral-genital ) de uma pessoa com infecção genital por HPV. Os fatores de risco incluem ter um grande número de parceiros sexuais, uma história de sexo oral-genital ou sexo anal-oral , ter uma parceira com história de um exame de Papanicolaou anormal ou displasia cervical , ter periodontite crônica e, entre os homens, idade mais jovem na primeira relação sexual e histórico de verrugas genitais . OPC HPV-positivo é considerado uma doença separada do câncer orofaríngeo HPV-negativo (também chamado de HPV-OPC negativo e HPV-OPC).
O OPC HPV-positivo apresenta-se de quatro maneiras: como uma anormalidade assintomática na boca encontrada pelo paciente ou por um profissional de saúde, como um dentista; com sintomas locais como dor ou infecção no local do tumor; com dificuldades de fala, deglutição e / ou respiração; ou como um inchaço no pescoço se o câncer se espalhou para os gânglios linfáticos locais. A detecção de uma proteína supressora de tumor , conhecida como p16 , é comumente usada para diagnosticar um OPC associado ao HPV. A extensão da doença é descrita no sistema de estadiamento do câncer padrão , usando o sistema AJCC TNM , com base no estágio T (tamanho e extensão do tumor), estágio N (extensão do envolvimento dos linfonodos regionais ) e estágio M (se há disseminação da doença fora da região ou não), e combinados em um estágio geral de I-IV. Em 2016, um sistema de estadiamento separado foi desenvolvido para HPV + OPC, distinto do HPV-OPC.
Enquanto a maioria dos cânceres de cabeça e pescoço tem diminuído com a diminuição das taxas de tabagismo, a OPC HPV-positiva tem aumentado. Em comparação com os pacientes HPV-OPC, os pacientes HPV-positivos tendem a ser mais jovens, têm um status socioeconômico mais alto e são menos propensos a fumar. Além disso, eles tendem a ter tumores menores, mas são mais propensos a ter envolvimento dos linfonodos cervicais. Nos Estados Unidos e em outros países, o número de casos de câncer orofaríngeo tem aumentado constantemente, com a incidência de OPC HPV-positivo aumentando mais rapidamente do que o declínio de OPC HPV-negativo. O aumento é visto particularmente em homens jovens em países desenvolvidos , e OPC HPV-positivo agora é responsável pela maioria de todos os casos de OPC. Esforços estão sendo feitos para reduzir a incidência de OPC HPV-positivo com a introdução da vacinação que inclui os tipos 16 e 18 do HPV, encontrados em 95% desses cânceres, antes da exposição ao vírus. Os primeiros dados sugerem uma redução nas taxas de infecção.
No passado, o tratamento da OPC era uma cirurgia radical, com abordagem pelo pescoço e divisão do osso da mandíbula , o que resultava em morbidade e baixa sobrevida. Posteriormente, a radioterapia com ou sem a adição de quimioterapia , forneceu uma alternativa menos desfigurante, mas com resultados ruins comparáveis. Agora, as novas técnicas cirúrgicas minimamente invasivas pela boca têm melhores resultados; em casos de alto risco, esta cirurgia é freqüentemente seguida de radiação e / ou quimioterapia. Na ausência de evidências de alta qualidade sobre qual tratamento oferece os melhores resultados, as decisões de manejo são frequentemente baseadas em um ou mais dos seguintes: fatores técnicos, provável perda funcional e preferência do paciente. A presença de HPV no tumor está associada a uma melhor resposta ao tratamento e a um melhor desfecho, independentemente dos métodos de tratamento utilizados, e a uma redução de quase 60% do risco de morrer de câncer. A maioria das recorrências ocorre localmente e no primeiro ano após o tratamento. O uso do tabaco diminui as chances de sobrevivência.
sinais e sintomas
O HPV + OPC apresenta-se de quatro maneiras: como uma anormalidade assintomática na boca encontrada pelo paciente ou por um profissional de saúde, como um dentista; com sintomas locais como dor ou infecção no local do tumor; com dificuldades de fala, deglutição e / ou respiração; ou como um inchaço no pescoço (se o câncer se espalhou para os gânglios linfáticos). Isso pode ser acompanhado por sintomas mais gerais, como perda de apetite, perda de peso e fraqueza.
Causa

A maioria dos cânceres de células escamosas da mucosa da cabeça e pescoço , incluindo o câncer de orofaringe (OPC), tem sido historicamente atribuída ao uso de tabaco e álcool. No entanto, esse padrão mudou consideravelmente desde a década de 1980. Percebeu-se que alguns cânceres ocorrem na ausência desses fatores de risco e uma associação entre o vírus do papiloma humano (HPV) e vários cânceres de células escamosas, incluindo OPC, foi descrita pela primeira vez em 1983. Desde então, evidências moleculares e epidemiológicas têm se acumulado. com a Agência Internacional de Pesquisa sobre o Câncer (IARC), afirmando que os tipos 16 e 18 de HPV de alto risco são cancerígenos em humanos, em 1995 e em 2007 que o HPV era uma causa de câncer oral. A incidência de câncer positivo para papilomavírus humano (HPV) (HPV + OPC) tem aumentado, enquanto a incidência de câncer HPV-negativo (HPV-OPC) está diminuindo, uma tendência que deve aumentar ainda mais nos próximos anos. Como há diferenças marcantes na apresentação clínica e no tratamento em relação ao status do HPV, HPV + OPC agora é visto como uma condição clínica e biológica distinta.
O HPV humano há muito está implicado na patogênese de vários cânceres anogenitais, incluindo os do ânus , vulva , vagina , colo do útero e pênis . Em 2007, também foi implicado por evidências moleculares e epidemiológicas em cânceres que surgem fora do trato anogenital, ou seja, câncer oral. A infecção por HPV é comum entre indivíduos saudáveis e é adquirida por meio do sexo oral . Embora menos dados estejam disponíveis, a prevalência da infecção por HPV é pelo menos tão comum entre os homens quanto entre as mulheres, com estimativas de cerca de 27% em 2004 entre as mulheres dos Estados Unidos com idades entre 14 e 59 anos.
A infecção oral por HPV precede o desenvolvimento de HPV + OPC. Lesões leves na membrana mucosa funcionam como uma porta de entrada para o HPV, que, portanto, atua na camada basal do epitélio . Pessoas com teste positivo para infecção oral pelo vírus HPV tipo 16 (HPV16) têm um risco 14 vezes maior de desenvolver HPV + OPC. A imunossupressão parece ser um fator de risco aumentado para HPV + OPC. Indivíduos com variações genéticas TGF-β1 , especialmente T869C, são mais propensos a ter HPV16 + OPC. O TGF-β1 desempenha um papel importante no controle do sistema imunológico. Em 1993, observou-se que os pacientes com câncer anogenital associado ao papilomavírus humano (HPV) tinham um risco 4 vezes maior de carcinoma de células escamosas tonsilar. Embora as evidências sugiram que o HPV16 é a principal causa de OPC em humanos não expostos ao fumo e ao álcool, o grau em que o uso de tabaco e / ou álcool pode contribuir para aumentar o risco de HPV + OPC nem sempre foi claro, mas parece que ambos tabagismo e infecção por HPV são fatores de risco independentes e aditivos para o desenvolvimento de OPC. A conexão entre a infecção por HPV e o câncer orofaríngeo é mais forte nas regiões do tecido linfoepitelial (base da língua e tonsilas palatinas) do que nas regiões do epitélio escamoso estratificado (palato mole e úvula). A infecção por herpesvírus humano-8 pode potencializar os efeitos do HPV-16.
Fatores de risco
Os fatores de risco incluem um grande número de parceiros sexuais (aumento de 25%> = 6 parceiros), uma história de sexo oral-genital (125%> = 4 parceiros) ou sexo anal-oral , uma parceira com história de esfregaço de Papanicolaou anormal ou displasia cervical , periodontite crônica e, entre os homens, idade decrescente na primeira relação sexual e história de verrugas genitais .
Patologia

Os cânceres da orofaringe surgem principalmente no tecido linfóide das tonsilas palatinas e lingual que é revestido pelo epitélio da mucosa escamosa respiratória , que pode ser invaginado dentro do tecido linfóide. Portanto, o tumor surge primeiro em criptas ocultas. O OPC é classificado com base no grau de diferenciação escamosa e de queratina em graus bem, moderados ou mal (altos) diferenciados. Outras características patológicas incluem a presença de invasão em forma de dedo, invasão perineural , profundidade de invasão e distância do tumor das margens de ressecção. As variantes fenotípicas incluem o carcinoma escamoso basaloide , uma forma de alto grau ( ver Chung Fig. 35-3 (C) e ilustração aqui). Eles são mais comumente não queratinizantes. HPV + OPC também difere de HPV-OPC por ser focal em vez de multifocal e não estar associado à displasia pré-maligna . Pacientes com HPV + OPC têm, portanto, menos risco de desenvolver outras doenças malignas na região de cabeça e pescoço, ao contrário de outros tumores primários de cabeça e pescoço que podem ter uma segunda neoplasia associada, que pode ocorrer ao mesmo tempo (síncrono) ou em um tempo distante (metacrônico ), tanto na região da cabeça e pescoço ou mais distantemente. Isso sugere que as alterações oncogênicas produzidas pelo vírus são espacialmente limitadas e não relacionadas a um defeito de campo.
Anatomia
A orofaringe , na parte posterior da boca , forma um círculo e inclui a base da língua (terço posterior) abaixo, as amígdalas de cada lado e o palato mole acima, juntamente com as paredes da faringe , incluindo a epiglote anterior , valéculas epiglóticas e fenda branquial em sua base. A orofaringe é uma das três divisões do interior da faringe com base em sua relação com estruturas adjacentes (faringe nasal ( nasofaringe ), faringe oral (orofaringe) e faringe laríngea ( laringofaringe - também conhecida como hipofaringe), de cima para baixo ) A faringe é um tubo fibromuscular semicircular que une as cavidades nasais acima da laringe (caixa vocal) e esôfago (garganta), abaixo, onde a laringe está situada na frente do esôfago.
A orofaringe encontra-se entre a boca (cavidade oral) para a frente, e a laringofaringe abaixo, que a separa da laringe. O limite superior da orofaringe é marcado pelo palato mole, e seu limite inferior pela epiglote e raiz da língua. A orofaringe se comunica com a boca, na frente, por meio do que se conhece como istmo orofaríngeo, ou istmo das fauces . O istmo (isto é, conexão) é formado acima pelo palato mole, abaixo pelo terço posterior da língua e nas laterais pelos arcos palatoglossais . O terço posterior da língua, ou base da língua, contém numerosos folículos de tecido linfático que formam as tonsilas linguais . Adjacente à base da língua, a superfície lingual da epiglote, que se curva para a frente, está ligada à língua pelas pregas glossoepiglóticas mediana e lateral . As dobras formam pequenas depressões conhecidas como valéculas epiglóticas. As paredes laterais são marcadas por dois pilares verticais de cada lado, os pilares das fauces, ou arcos palatoglossais. Mais apropriadamente, eles são chamados separadamente de arco palatoglosso anteriormente e arco palatofaríngeo posteriormente. O arco anterior é denominado a partir do músculo palatoglosso interno , que vai do palato mole à língua ( glossus ), enquanto o arco posterior contém o músculo palatofaríngeo que vai do palato mole à faringe lateral. Entre os arcos encontra-se um espaço triangular, a fossa tonsilar onde fica a tonsila palatina , outro órgão linfóide.
As paredes externas da faringe, compostas pelos quatro músculos constritores, fazem parte do mecanismo da deglutição . A anatomia microscópica é composta por quatro camadas, sendo do lúmen para fora, a mucosa , a submucosa , os músculos e a fibrosa, ou camada fibrosa. A mucosa é constituída por epitélio escamoso estratificado, geralmente não queratinizado, exceto quando exposto a irritantes crônicos como a fumaça do tabaco. A submucosa contém agregados de tecido linfóide.
Padrões de extensão
Os cânceres que surgem na fossa tonsilar se espalham para os gânglios linfáticos cervicais , principalmente os linfonodos subdigástricos (jugular superior) (nível II), com envolvimento secundário dos nódulos jugulares médios (nível III) e baixos (nível IV) e, às vezes, os nódulos cervicais posteriores nós (nível V). Os cânceres da base da língua se espalham para os nódulos subdigástricos e jugulares médios e, ocasionalmente, nódulos cervicais posteriores, mas estando mais próximos da linha média, têm maior probabilidade de apresentar doença nodal bilateral. Os cânceres tonsilares raramente se espalham para o lado contralateral, a menos que envolvam a linha média.
Mecanismo
Virologia
Os cânceres associados ao HPV são causados por cepas de HPV de alto risco, principalmente HPV-16 e HPV-18. O HPV é um pequeno vírus de DNA sem envelope da família do papilomavírus . Seu genoma codifica as primeiras (E) oncoproteínas E5, E6 e E7 e as tardias (L) proteínas do capsídeo L1 e L2. O vírus ganha acesso à mucosa por meio de microlesões, onde infecta a camada basal das células, que ainda podem se proliferar. Embora o vírus não se replique nessas células, a expressão de seus genes iniciais estimula a proliferação e a expansão lateral das células basais. À medida que isso move as partículas do vírus para as camadas suprabasais sobrepostas, ocorre a expressão tardia do gene viral, permitindo a replicação do genoma viral circular ( veja a figura) e das proteínas estruturais. À medida que são empurrados para as camadas mais superficiais da mucosa, partículas virais completas são montadas e liberadas.
Oncogênese
Um risco aumentado de HPV + OPC é observado mais de 15 anos após a exposição ao HPV, apontando para um desenvolvimento lento da doença, semelhante ao observado no câncer cervical. Em relação ao HPV-OPC, a progressão molecular oncogênica de HPV + OPC é mal compreendida. As duas principais oncoproteínas virais dos tipos de HPV de alto risco são E6 e E7. Estes são expressos de forma consistente em linhas de células malignas e, se sua expressão for inibida, o fenótipo maligno das células cancerosas será bloqueado. Qualquer uma dessas oncoproteínas pode imortalizar linhagens celulares, mas são mais eficientes quando ambas são expressas, uma vez que seus papéis moleculares separados são sinérgicos . Os oncogenes E6 e E7 tornam-se integrados ao DNA da célula hospedeira, e as oncoproteínas que eles expressam interferem com uma variedade de mecanismos reguladores celulares predominantemente antiproliferativos . Eles se ligam e inativam o mais conhecido desses mecanismos, as proteínas supressoras de tumor p53 e a proteína de retinoblastoma pRB (pRb), levando à instabilidade genômica e, em seguida , à desregulação do ciclo celular ( ver Chung et al., 2016 Fig. 35.2). Além disso, ainda a serem eliciados, são necessários mecanismos para as etapas finais da transformação maligna de células infectadas por HPV.
HPV- e HPV + OPC são distinguíveis a nível molecular. O p53 de ocorrência natural ( tipo selvagem ) está amplamente envolvido em processos celulares , incluindo autofagia , resposta a danos no DNA, regulação e senescência do ciclo celular , apoptose e geração de trifosfato de adenosina (ATP) por fosforilação oxidativa . O gene que codifica p53 é inativado por E6 ao nível da proteína e é encontrado como o tipo selvagem em HPV + OPC, mas com mutação em HPV-OPC. No HPV + OPC a proteína p53 sofre degradação acelerada pelo E6, reduzindo drasticamente seus níveis, enquanto no HPV-OPC sofre mutação genética , que pode resultar na síntese de uma proteína p53 anormal, que pode não só ser inativa como supressora de tumor, mas também pode ligar e inativar qualquer p53 de tipo selvagem não mutado, com um aumento na atividade oncogênica. Embora as mutações do p53 ocorram no HPV + OPC, são muito menos comuns do que no HPV-OPC (26% vs 48%) e não parecem afetar o resultado clínico.
A proteína pRb é inativada por E7 em HPV + OPC, mas em HPV-OPC é a parte supressora de tumor p16 da rede supressora de tumor pRb que é inativada. Além disso, a via pRb é inativada por E7 em vez da amplificação da ciclina D1 . CDKN2A é um gene supressor de tumor que codifica uma proteína supressora de tumor, p16 (inibidor de quinase dependente de ciclina 2A) e inibe a atividade de quinase das quinases dependentes de ciclina CDK4 e CDK6 , que por sua vez induzem a parada do ciclo celular. A expressão de p16 é dependente do ciclo celular e é expressa focalmente em apenas cerca de 5–10% do epitélio escamoso normal. Como a maioria dos cânceres HPV +, HPV + OPC expressa p16, mas o último não funciona como um supressor de tumor, porque o mecanismo pelo qual isso é alcançado, pRb, foi inativado por E7. O p16 é regulado positivamente (superexpresso) devido à perda de pRB relacionada a E7 com feedback negativo reduzido, ao passo que é regulado para baixo em até 90% do HPV-OPC. Essa superexpressão difusa nas células tumorais fornece um marcador diagnóstico para o envolvimento do HPV. Embora os HPV E6 e E7 reduzam a atividade supressora de tumor, eles o fazem menos do que os processos genéticos e epigenéticos no HPV-OPC.
Os epitélios tonsilares ( palatino e lingual ) compartilham características semelhantes de não queratinização com o colo do útero , onde a infecção por HPV desempenha o papel principal nos casos de câncer cervical . Também E6 e E7 do HPV pode fazer + OPC mais imunogénico do que o HPV-OPC, uma vez que anti-E6 e E7 de anticorpos pode ser detectada nestes pacientes. Isso, por sua vez, pode restringir o comportamento maligno de HPV + OPC e a presença de anticorpos tem sido associada a um melhor prognóstico, enquanto o tratamento pode aumentar a imunogenicidade do tumor e, portanto, melhorar a resposta, embora até que ponto não esteja claro. Os resultados também estão associados à melhora da imunidade adaptativa .
Diagnóstico

Biópsia
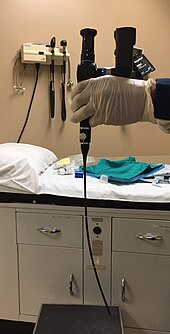
O diagnóstico inicial requer a visualização do tumor pela boca ou endoscopicamente pelo nariz usando um rinoscópio , ilustrado à direita, seguido de biópsia .
Diferenciando HPV + OPC de HPV-OPC
HPV + OPC é geralmente diagnosticado em um estágio mais avançado do que HPV-OPC, com 75–90% tendo envolvimento de linfonodos regionais. Além disso, o carcinoma de células escamosas não queratinizante está fortemente associado ao HPV-OPC.
As assinaturas genéticas de HPV + e HPV-OPC são diferentes. HPV + OPC está associado ao nível de expressão dos mRNAs E6 / E7 e de p16 . Os casos positivos para HPV16 E6 / E7 são histopatologicamente caracterizados por sua estrutura verrucosa ou papilar ( tipo mamilo ) e coilocitose da mucosa adjacente. Aproximadamente 15% dos HNSCCs são causados por infecção por HPV16 e a expressão constitutiva subsequente de E6 e E7, e alguns tumores iniciados por HPV podem perder suas características originais durante a progressão do tumor . Os tipos de HPV de alto risco podem estar associados ao carcinoma oral, pela desregulação do controle do ciclo celular , contribuindo para a carcinogênese oral e a superexpressão de mdm2, p27 e catepsina B.
HPV + OPC não é meramente caracterizado pela presença de HPV-16: apenas a expressão de oncogenes virais dentro das células tumorais mais a presença de anticorpos E6 ou E7 no soro é inequivocamente conclusiva para HPV + OPC.
Não existe um método de teste de HPV padrão em cânceres de cabeça e pescoço; tanto a hibridização in situ (ISH) quanto a reação em cadeia da polimerase (PCR) são comumente usadas. Ambos os métodos têm desempenho comparável para detecção de HPV, no entanto, é importante usar controles de sensibilidade apropriados . A coloração por imuno-histoquímica (IHC) do tecido para p16 é frequentemente usada como um substituto custo-efetivo para HPV em OPC, em comparação com ISH ou PCR, mas há uma pequena incidência de doença p16-positiva HPV-negativa responsável por cerca de 5% do HPV -OPC.
Staging
O estadiamento é geralmente pelo sistema UICC / AJCC TNM (Tumor, Nodes, Metastases). O estadiamento é baseado no exame clínico , diagnóstico por imagem e patologia. Na imagem, os linfonodos envolvidos podem parecer císticos , uma característica de HPV + OPC.
HPV + OPC foi tratado de forma semelhante ao OPC não relacionado ao HPV de estágio correspondente e local, mas seus recursos exclusivos, que contrastam com cânceres de cabeça e pescoço HPV-OPC relacionados ao fumo, para os quais os dados demográficos, comorbidades, fatores de risco e carcinogênese dos pacientes diferem marcadamente, sugerem que um sistema de estadiamento distinto seja desenvolvido para representar mais apropriadamente a gravidade da doença e seu prognóstico. O estadiamento TNM da AJCC padrão, como a sétima edição (2009), enquanto preditivo para HPV-OPC, não tem valor prognóstico em HPV + OPC. A 8ª edição do AJCC TNM Staging Manual (2016) incorpora este estadiamento específico para HPV + OPC. A partir de 2018, as diretrizes de tratamento estão evoluindo para levar em conta os diferentes resultados observados em HPV + OPC. Consequentemente, o uso menos intensivo (desintensificação) de radioterapia ou quimioterapia, bem como terapia específica, está sob investigação, envolvendo HPV + OPC em ensaios clínicos para preservar o controle da doença e minimizar a morbidade em grupos selecionados com base no estadiamento TNM modificado e tabagismo .
O câncer de HPV + da orofaringe é classificado como (AJCC 8ª ed. 2016): Estágio do tumor
- T0 sem identificação primária
- T1 2 cm ou menos na maior dimensão
- T2 2–4 cm
- T3> 4 cm, ou extensão para a superfície lingual da epiglote
- T4 doença local moderadamente avançada, invasão da laringe, músculo extrínseco da língua, pterigóide medial, palato duro ou mandíbula ou além
Estágio nodal
- Nx linfonodos regionais não podem ser avaliados
- N0 nenhum linfonodo regional envolvido
- N1 um ou mais nódulos ipsilaterais envolvidos, menos de 6 cm
- Linfonodos N2 contralaterais ou bilaterais, menos de 6 cm
- Linfonodo (s) N3 maior que 6 cm
Estágio clínico
- Estágio I: T0N1, T1–2N0–1
- Estágio II: T0N2, T1–3N2, T3N0–2
- Estágio III: T0-3N3, T4N0-3
- Estágio IV: quaisquer metástases (M1)
No entanto, a literatura publicada e os ensaios clínicos em andamento usam a sétima edição anterior que não faz distinção entre HPV + OPC e HPV-OPC - consulte Câncer Orofaríngeo - Estágios . Os estágios T são essencialmente semelhantes entre AJCC 7 e AJCC 8. com duas exceções. Tis ( carcinoma in situ ) foi eliminado e a divisão de T4 em subestágios (por exemplo, T4a) foi removida. As principais mudanças estão nos estágios N e, portanto, no estágio clínico geral. N0 permanece o mesmo, mas como com o estágio T, subestágios como N2a foram eliminados. A extensão extracapsular (ECE), também conhecida como extensão extranodal (ENE), que é a invasão do tumor além da cápsula do linfonodo, foi eliminada como critério de estadiamento.
Isso resulta em um tumor HPV + OPC recebendo um estágio inferior do que se fosse HPV-OPC. Por exemplo, um tumor de 5 cm com um nódulo ipsilateral envolvido que tem 5 cm de tamanho, mas tem ECE seria considerado T3N3bM0 Estágio IVB se HPV-, mas T3N1M0 Estágio II se HPV +.
Prevenção

Evitando exposição
A prevenção de HPV + OPC envolve evitar ou reduzir a exposição a fatores de risco, sempre que possível.
Vacinação
Cerca de 90% dos HPV + OPC carregam o HPV 16 e outros 5% do tipo 18. Esses dois tipos são alvos das vacinas disponíveis. As vacinas contra o HPV administradas antes da exposição podem prevenir a infecção genital persistente e o conseqüente estado pré-canceroso. Portanto, eles têm um potencial teórico para prevenir a infecção oral por HPV. Um estudo de revisão de 2010 descobriu que a infecção oral por HPV16 era rara (1,3%) entre os 3.977 indivíduos saudáveis analisados.
Tratamento
Os objetivos do tratamento são otimizar a sobrevida e o controle loco-regional da doença e prevenir a disseminação para áreas distantes do corpo ( metástases ), ao mesmo tempo em que minimiza a morbidade a curto e longo prazo . Não há evidência de nível I de alta qualidade de ensaios clínicos prospectivos em HPV + OPC, portanto, as diretrizes de tratamento devem se basear em dados do tratamento de OPC em geral e de alguns subconjuntos retrospectivos não planejados desses estudos, juntamente com dados de câncer de cabeça e pescoço em geral . O tratamento para OPC tem tradicionalmente baseado em radioterapia , quimioterapia e / ou outros tratamentos sistêmicos e ressecção cirúrgica. Dependendo do estágio e de outros fatores, o tratamento pode incluir uma combinação de modalidades . A base tem sido a radioterapia na maioria dos casos. uma análise conjunta de estudos publicados sugeriu controle de doença comparável entre radiação e cirurgia, mas taxas de complicações mais altas para cirurgia +/- radiação. Idealmente, uma abordagem de modalidade única é preferida, uma vez que a modalidade tripla está associada a muito mais toxicidade, e uma equipe multidisciplinar em um grande centro com alto volume de pacientes é recomendada.
As diferenças na resposta ao tratamento entre HPV-OPC e HPV + OPC podem incluir diferenças na extensão e na maneira em que as vias regulatórias do crescimento celular são alteradas nas duas formas de OPC. Por exemplo, em HPV + OPC, os oncogenes HPV E6 e E7 apenas tornam as vias p53 e pRb dormentes, deixando em aberto a possibilidade de reativação dessas vias por regulação negativa (redução) da expressão dos oncogenes. Isto está em contraste com a forma mutante de p53 encontrada no HPV-OPC que está associada à resistência ao tratamento. Além disso, sugere-se que os efeitos de E6 e E7 nessas vias tornam o tumor mais radiossensível, possivelmente por interferência com mecanismos como reparo de DNA , sinalização de repopulação e redistribuição do ciclo celular. O microambiente também é importante, com a radiação aumentando a resposta imune do hospedeiro aos antígenos virais expressos no tumor. Além disso, há uma associação entre um aumento nos linfócitos infiltrantes do tumor e nos leucócitos circulantes em pacientes com HPV + OPC e melhor prognóstico. Isso implica um papel para um sistema imunológico adaptativo na supressão da progressão do tumor .
Cirurgia
Historicamente, a cirurgia fornecia a abordagem única para o câncer de cabeça e pescoço. O tratamento cirúrgico de OPC carrega morbidade significativa com uma abordagem transcervical (através do pescoço), muitas vezes envolvendo mandibulotomia, em que o osso da mandíbula ( mandíbula ) é dividido. Isso é conhecido como uma técnica cirúrgica aberta. Consequentemente, as abordagens cirúrgicas declinaram em favor da radiação. Nos Estados Unidos, o uso de cirurgia diminuiu de 41% dos casos em 1998 para 30% em 2009, ano em que a Food and Drug Administration aprovou o uso das técnicas mais recentes.
Essas melhorias nas técnicas cirúrgicas permitiram que muitos tumores fossem ressecados (removidos) por abordagens cirúrgicas transorais (pela boca) (TOS), usando cirurgia endoscópica transoral de cabeça e pescoço (HNS). Consequentemente, a cirurgia passou a ser mais utilizada, aumentando para 35% dos casos em 2012. Essa abordagem tem segurança, eficácia e tolerabilidade comprovadas e inclui duas técnicas principais minimamente invasivas , cirurgia robótica transoral (TORS) e microcirurgia a laser transoral (TLM). Nenhuma comparação direta dessas duas técnicas foi conduzida, e os ensaios clínicos em câncer de cabeça e pescoço, como o ECOG 3311, também permitem. Eles estão associados a morbidade pós-operatória substancial, dependendo da extensão da ressecção, mas em comparação com técnicas mais antigas têm internação hospitalar mais curta, recuperação mais rápida, menos dor e menos necessidade de gastrostomia ou traqueostomia , e menos efeitos de longo prazo, que são mínimos na ausência de radiação pós-operatória (RT) ou quimiorradiação (CRT). O TORS tem a vantagem prática de que telescópios angulares e braços cirúrgicos robóticos rotativos fornecem melhor linha de visão. Os resultados dos procedimentos minimamente invasivos também se comparam favoravelmente com os mais invasivos. Na doença em estágio inicial, incluindo envolvimento dos nódulos cervicais, a TORS produz uma sobrevida de 2 anos de 80–90%. Da mesma forma, relatou-se que o TLM tem uma sobrevida em cinco anos de 78% e taxas de controle local de 85–97%. Além da doença precoce, a cirurgia minimamente invasiva tem sido usada em casos avançados, com até 90% de controle local e sobrevida específica da doença. A deglutição pós-operatória foi excelente em 87%, mas disfagia de longo prazo foi associada a cânceres maiores (T4), especialmente se envolvendo a base da língua.
Os detalhes da abordagem cirúrgica dependem da localização e do tamanho do tumor primário e de seu estágio N. O esvaziamento do pescoço para examinar os linfonodos de drenagem pode ser realizado simultaneamente ou como um segundo procedimento de estadiamento. Para tumores da amígdala e da parede lateral da faringe e doença com linfonodo clinicamente negativo (N0), a dissecção do pescoço geralmente envolve os níveis 2–4 ( ver diagrama em Dubner 2017 ) ipsilateralmente . Quando os nódulos estão clinicamente envolvidos, a dissecção dependerá da localização e do tamanho do nódulo ou nódulos. No caso de primários na base da língua, próximo à linha média , a dissecção bilateral é recomendada.
Estadiamento patológico
Uma vantagem de uma abordagem cirúrgica primária é a quantidade de informações patológicas disponibilizadas, incluindo grau, status da margem e grau de envolvimento dos linfonodos. Isso pode alterar o estadiamento, pois até 40% dos pacientes podem apresentar um estágio patológico pós-operatório diferente em relação ao estágio clínico pré-operatório. Em um estudo, 24% tiveram seu estágio reduzido (downstaged), o que pode impactar a tomada de decisão subsequente, incluindo redução de intensidade e morbidade. No Reino Unido, o Royal College of Pathologists (1998) padronizou o relato das margens cirúrgicas, com duas categorias, "mucosa" e "profunda", e para cada grupo criado com base na distância microscópica do câncer invasivo à margem, como segue: mais de 5 mm (transparente), 1–5 mm (próximo) e menos de 1 mm (envolvido).
Terapia adjuvante pós-operatória
Os dados sobre o uso de radioterapia pós-operatória (PORT) são amplamente confinados a estudos históricos ou retrospectivos, em vez de ensaios clínicos randomizados de alta qualidade e são baseados na população geral de pacientes com câncer de cabeça e pescoço, em vez de estudos específicos de HPV + OPC, o que teria formado uma proporção muito pequena da população estudada. Apesar da excisão cirúrgica, nos casos mais avançados são frequentes as recorrências locais e regionais do câncer, juntamente com a disseminação para fora da região da cabeça e pescoço ( metástases ). O risco de doença recorrente subsequente foi considerado mais alto nos tumores em que a patologia mostra tumor nas margens da ressecção (margens positivas), múltiplos linfonodos regionais envolvidos e extensão do tumor fora da cápsula do linfonodo (extensão extracapsular ), com base na experiência histórica com câncer de cabeça e pescoço. O PORT foi introduzido na década de 1950 em uma tentativa de reduzir a falha do tratamento apenas com a cirurgia. Embora nunca tenha sido testado em um ambiente controlado, o PORT foi amplamente adotado para esse propósito. Em uma análise da falha do tratamento cirúrgico no Memorial Sloan-Kettering Cancer Center , os pacientes tratados apenas com cirurgia entre 1960-1970 tiveram taxas de falha de 39 e 73% para aqueles com margens cirúrgicas negativas e positivas, respectivamente. Estes foram comparados com aqueles que receberam PORT (com ou sem quimioterapia) de 1975–1980. O último grupo teve menores taxas de falha de 2% e 11%, respectivamente. Além disso, um estudo randomizado da década de 1970 (RTOG 73-03) comparou a radiação pré-operatória com a PORT e encontrou taxas de falha mais baixas com a última.
A adição de outra modalidade de tratamento é referida como terapia adjuvante (literalmente ajudando), em comparação com seu uso como terapia inicial (primária), também conhecida como terapia radical. Consequentemente, muitos desses pacientes foram tratados com radiação adjuvante, com ou sem quimioterapia. Na série de relatórios acima de cirurgia minimamente invasiva, muitos (30–80%) pacientes receberam radiação adjuvante. No entanto, os resultados funcionais eram piores se a radiação fosse adicionada à cirurgia e piores se a radiação e a quimioterapia fossem usadas. A dosagem de radiação segue amplamente aquela derivada para todos os cânceres de cabeça e pescoço, neste cenário, com base no risco. Historicamente, apenas um ensaio clínico randomizado abordou a dosagem ideal, alocou os pacientes em dois níveis de dosagem, estratificados por risco, mas não mostrou diferença no controle do câncer entre as doses baixas e altas (63 e 68,4 Gy), mas uma maior incidência de complicações no doses mais altas. Consequentemente, a dose mais baixa de 57,6 Gy foi recomendada. Como os autores usaram um esquema de fracionamento de 1,8 Gy por tratamento, essa dosagem não foi amplamente adotada, os médicos preferindo uma fração maior de 2 Gy para produzir um tempo de tratamento mais curto e uma dose ligeiramente maior de 60 Gy em frações de 2 Gy (30 por dia tratamentos). Ainda, 57,6 Gy em frações de 1,8 Gy é equivalente (dose iso-efetiva) a apenas 56 Gy em frações de 2 Gy. 60 Gy corresponde aos 63 Gy usados como dose baixa no grupo de alto risco. 60 Gy também foi a dose usada no RTOG 73-03. Posteriormente, houve uma tendência de intensificar o tratamento do câncer de cabeça e pescoço, e vários centros adotaram uma dose de 66 Gy, pelo menos para os pacientes com características tumorais adversas. A eficácia do PORT em HPV + OPC recebe algum apoio de um estudo de coorte (Nível 2b), embora o número de pacientes tenha sido baixo e o número de eventos (doença recorrente ou morte) apenas 7%. Outro estudo retrospectivo em nível de população (Nível 4) do banco de dados SEER (1998-2011) concluiu que houve uma sobrevida global, mas não o efeito de sobrevida específica da doença da radiação em 410 pacientes com um único linfonodo envolvido, mas usado apenas estatísticas univariadas análise e não continha informações sobre o status do HPV. Um estudo subsequente muito maior em uma população semelhante no National Cancer Database (2004-2013) de mais de 9.000 pacientes encontrou uma vantagem de sobrevivência, mas isso foi apenas em HPV-OPC, não em 410 pacientes HPV + OPC, e um estudo subsequente de 2.500 os pacientes com HPV + OPC de risco baixo e intermediário mostraram sobrevida global semelhante, independentemente de a PORT ter sido administrada ou não.
Desintensificação
Embora menos estudos tenham sido concluídos examinando a desintensificação (descalonamento) nesse cenário do que na radiação radical primária para esse câncer (veja abaixo), é uma área de investigação ativa. Em um estudo de uma única instituição, foi tomada a decisão de reduzir a dose de radiação em pacientes de alto risco com HPV + OPC de 66 para 60 Gy, correspondendo à evidência real, e o acompanhamento não mostrou diminuição no controle do câncer. Os ensaios atuais, tanto na América do Norte quanto na Europa (como ECOG 3311 e PATHOS), usam 50 Gy como braço de comparação. O comparador de 50 Gy foi escolhido com base em (i) a excelente sensibilidade do HPV + OPC à radiação, tanto in vitro quanto in vivo ; ECOG 1308 mostrando excelente controle da doença em 54 Gy; e dados sugerindo que 50 Gy em 1,43 Gy (dose isoeficaz de 43 Gy em 2,0 Gy) foi suficiente para tratar eletivamente o pescoço. Outros estudos, como MC1273 e DART-HPV avaliaram doses tão baixas quanto 30-36 Gy. A redução da dose de radiação para 54 Gy foi identificada como um dos importantes Avanços Clínicos do Câncer de 2018 pela Sociedade Americana de Oncologia Clínica , sob o tema geral de "Menos é Mais: Preservando a Qualidade de Vida com Menos Tratamento". A quimioterapia tem sido usada concomitantemente com a radiação neste cenário, como no tratamento primário com radiação radical, particularmente onde as características patológicas indicam um risco maior de recorrência do câncer. Vários estudos sugeriram que isso não melhora o controle local, embora acrescente toxicidade.
Radioterapia
As preocupações sobre a morbidade associada à ressecção cirúrgica aberta tradicional em bloco, levaram à exploração de abordagens alternativas usando radiação. A radioterapia modulada por intensidade ( IMRT ) pode fornecer um bom controle de tumores primários enquanto preserva excelentes taxas de controle, com toxicidade reduzida para estruturas salivares e faríngeas em relação à tecnologia anterior. HPV + OPC mostrou sensibilidade aumentada à radiação com regressão mais rápida, em comparação com HPV-OPC. Geralmente, a radiação pode ser administrada com segurança apenas ao lado envolvido (ipsilateral), devido à baixa taxa de câncer recorrente no lado oposto (contralateral) e significativamente menos toxicidade em comparação com o tratamento bilateral. IMRT tem uma sobrevida livre de doença de dois anos entre 82 e 90%, e uma sobrevida específica da doença de dois anos de até 97% para os estágios I e II.
As toxicidades relatadas incluem boca seca ( xerostomia ) por dano à glândula salivar , 18% (grau 2); dificuldade para engolir ( disfagia ) devido a danos nos músculos constritores, laringe e esfíncter esofágico, 15% (nota 2); aspiração subclínica de até 50% (incidência relatada de pneumonia aspirativa de aproximadamente 14%); hipotireoidismo 28-38% em três anos (pode ser de até 55% dependendo da quantidade da glândula tireoide exposta a mais de 45 Gy de radiação; estenose esofágica 5%; osteonecrose da mandíbula 2,5%; e necessidade de colocação de tubo de gastrostomia em algum ponto durante ou até um ano após o tratamento 4% (até 16% com seguimento mais longo). Preocupações foram expressas em relação à toxicidade excessiva de curto e longo prazo, especialmente disfagia e xerostomia e, portanto, se as doses padrão expõem os pacientes com melhores prognósticos estão sendo expostos a tratamento excessivo e efeitos colaterais desnecessários.
Dosimetria
A probabilidade de xerostomia em um ano aumenta em 5% para cada aumento de 1 Gy na dose para a glândula parótida . Doses acima de 25-30 Gy estão associadas a xerostomia moderada a grave. Considerações semelhantes se aplicam à glândula submandibular , mas a xerostomia é menos comum se apenas uma glândula parótida for incluída no campo irradiado e a glândula submandibular contralateral for poupada (menos de 39 Gy). Da mesma forma, a dose de radiação para os músculos constritores da faringe , a laringe e a abertura cricofaríngea determinam o risco de disfagia (e, portanto, a dependência de alimentação por tubo de gastrostomia ). O limite para esta toxicidade é dependente do volume de 55-60 Gy, com comprometimento moderado a grave da deglutição, incluindo aspiração, estenose e dependência de tubo de alimentação acima de uma dose média de 47 Gy, com uma dose recomendada para o constritor inferior de menos de 41 Gy. As relações dose-toxicidade para os constritores superior e médio são acentuadas, com aumento de 20% na probabilidade de disfagia para cada 10 Gy. Para disfagia tardia, os limiares das doses constritoras totais médias, para limitar as taxas maiores ou iguais ao grau 2 e 3 abaixo de 5%, foram 58 e 61 Gy, respectivamente. Para disfagia de grau 2, a taxa aumentou 3,4% por Gy. Doses acima de 30 Gy na tireoide estão associadas a hipotireoidismo moderado a grave. Resultados subjetivos de qualidade de vida relatados pelo paciente também se correlacionam com a dose de radiação recebida.
Esquemas de fracionamento alterados , como RTOG 9003 e RTOG 0129 não conferiram benefício adicional. As recomendações de dose de radiação foram amplamente determinadas empiricamente em estudos clínicos com poucos pacientes com HPV + OPC e permaneceram inalteradas por meio século, tornando difícil determinar a dose ideal para este subgrupo. Uma abordagem comum usa 70 Gy bilateralmente e anteriormente, como RTOG 9003 (1991–1997) e RTOG 0129 (2002–2005). Para câncer de amígdala lateralizado, a radiação unilateral do pescoço é geralmente prescrita, mas para os primários da base da língua, a radiação bilateral do pescoço é mais comum, mas a radiação unilateral pode ser usada quando as lesões da base da língua são lateralizadas.
Desintensificação
Foram expressas preocupações com relação à toxicidade excessiva de curto e longo prazo, especialmente disfagia e xerostomia e, portanto, se as doses padrão expõem os pacientes com melhor prognóstico a tratamento excessivo e efeitos colaterais desnecessários. As toxicidades atuais foram descritas como "não toleráveis" e, portanto, um intenso interesse na diminuição da intensidade.
Embora a comparação com controles históricos tenha valor limitado em comparação com ensaios clínicos randomizados ( fase III ), estudos de fase II usando doses reduzidas de radiação em comparação com o padrão histórico de 70 Gy foram realizados. Um estudo usando 54–60 Gy (uma redução de 15–20%, estratificada pela resposta à quimioterapia de indução inicial) demonstrou níveis comparáveis de controle da doença com taxas de complicações muito menores, quando comparados a estudos semelhantes, usando 70 Gy, como ECOG 2399. A porcentagem de pacientes vivos após 2 anos foi de 95% com a dose mais alta e 98% com a dose mais baixa. O mesmo ocorre com a porcentagem livre de doenças (86 e 92%). As toxicidades foram bastante reduzidas de uma incidência de grau 3 ou maior de disfagia e mucosite de 54 e 53%, respectivamente, para 9%. Uma menor incidência e gravidade da disfagia também significa que menos pacientes precisam de alimentação por gastrostomia. Uma comparação semelhante pode ser feita com os dados combinados de dois estudos RTOG que utilizaram 70 Gy (0129 e 0522).
Nenhuma nova diretriz que trata especificamente de HPV + OPC foi desenvolvida, fora dos ensaios clínicos. Dados indiretos sugerem a eficácia de um tratamento menos intenso. Uma análise retrospectiva do avançado (N +) HPV + OPC sugeriu 96% de controle local de 5 anos com radiação não intensificada de 54 Gy e quimioterapia concomitante à base de cisplatina . As conclusões do par acima de estudos de fase II semelhantes foram apoiadas por vários outros estudos de fase II. Um estudo prospectivo ( ECOG 1308) demonstrou controle locorregional semelhante com 54 Gy, e outro estudo, uma alta taxa de resposta patológica completa a 60 Gy. O ensaio Quarterback mostrou resultados comparáveis entre 56 e 70 Gy. e foi seguido pelo Quarterback 2, comparando 50 a 56 Gy. Da mesma forma, o estudo Optima mostrou bom controle da doença com doses entre 45 e 50 Gy. Estudos em andamento, seguindo a experiência do ensaio da Clínica Mayo (MC1273), como o Memorial Sloan Kettering Cancer Center, estão explorando doses tão baixas quanto 30 Gy. Todos esses estudos usaram bem abaixo da dose padrão anterior de 70 Gy. Uma vez que a toxicidade de longo prazo está associada à dose de radiação, determinar a eficácia de doses mais baixas e, portanto, menos mórbidas de radiação é uma prioridade, uma vez que pode-se esperar que muitos pacientes com HPV + tenham sobrevida em longo prazo.
A radiação é comumente utilizada em combinação com quimioterapia, mas também pode ser usada como uma modalidade única, especialmente em estágios iniciais, por exemplo, T1-T2, N0-1, e seu uso em estágios posteriores está sendo explorado em ensaios clínicos como o RTOG 1333, que compara a radiação sozinha com a radiação com quimioterapia reduzida, em não fumantes ou não fumantes.
Quimioterapia
Tal como acontece com os dados da radioterapia, a maior parte do conhecimento disponível sobre a eficácia da quimioterapia deriva do tratamento de câncer avançado de cabeça e pescoço, em vez de estudos específicos de HPV + OPC. Desde 1976, muitos estudos clínicos compararam a TRC à RT isolada no tratamento primário de cânceres de cabeça e pescoço localmente avançados e demonstraram uma vantagem da TRC tanto na sobrevida quanto no controle loco-regional. A cisplatina é considerada o agente padrão e uma vantagem de sobrevida foi observada para os pacientes que receberam radiação com cisplatina concomitante. Apesar disso, nenhum ensaio comparando diretamente a cisplatina com outros agentes neste contexto foi realizado. O outro agente amplamente utilizado é o cetuximabe , um anticorpo monoclonal direcionado ao receptor do fator de crescimento epidérmico (EGFR). Uma vantagem de sobrevivência de 10% em três anos foi observada quando o cetuximabe foi administrado simultaneamente com a radiação (bioradiação). Os ensaios com cetuximabe foram concluídos antes do conhecimento do status do HPV. Os estudos laboratoriais e clínicos sobre a utilidade do cetuximabe neste contexto são conflitantes. A principal toxicidade é uma erupção cutânea acneiforme , mas não havia sido comparada diretamente à cisplatina em HPV + OPC, até que RTOG 1016 ( veja a palestra ) abordou esta questão. A análise dos resultados três anos após a conclusão do ensaio demonstra que o cetuximab é inferior à cisplatina. A quimioterapia concomitante também é superior à quimioterapia sozinha ( quimioterapia de indução ) seguida por radiação. O cetuximabe não mostra nenhuma vantagem quando adicionado à cisplatina em combinação com a radiação. Embora a quimiorradiação tenha se tornado um padrão de tratamento com base em ensaios clínicos e, em particular, meta-análises , um estudo subsequente de base populacional de pacientes com OPC, não indicou nenhuma vantagem para a adição de quimioterapia à radiação em HPV + OPC ou HPV-OPC, e significativa preocupações sobre a toxicidade adicionada.
A quimioterapia também tem um papel, combinada com a radiação, no cenário pós-operatório (terapia adjuvante). Geralmente é usado quando a patologia da amostra ressecada indica características associadas a alto risco de recorrência loco-regional (por exemplo, extensão extracapsular através de linfonodos envolvidos ou margens muito próximas). Ele mostrou sobrevida livre de doença melhorada e controle loco-regional em dois ensaios clínicos muito semelhantes em pacientes de alto risco, EORTC 22931 (1994–2000) e RTOG 9501 (1995–2000). No entanto, para pacientes com HPV + OPC, essa disseminação extracapsular não parece ser um fator adverso e a adição de quimioterapia à radiação neste grupo não ofereceu nenhuma vantagem adicional. Uma vez que o tamanho da amostra para detectar uma vantagem de sobrevivência é grande, dado o pequeno número de eventos neste grupo, esses estudos podem ter sido insuficientes e a questão da utilidade de adicionar quimioterapia está sendo abordada em um ensaio clínico randomizado (ADEPT) com dois controle locorregional de um ano e sobrevida livre de doença como ponto final. A adição de quimioterapia à radiação aumenta a toxicidade aguda e tardia. No estudo GORTEC, a quimioterapia com docetaxel proporcionou maior sobrevida e controle loco-regional em OPC localmente avançado, mas foi associada ao aumento da mucosite e necessidade de alimentação por gastrostomia. A quimioterapia e a radiação estão associadas a um risco de morte de 3–4% neste contexto. Não está claro se a toxicidade adicional da adição de quimioterapia à radiação é compensada por um benefício clínico significativo no controle da doença e na sobrevida.
Pensa-se que os pacientes HPV + OPC se beneficiam melhor da radioterapia e do tratamento concomitante com cetuximabe do que os pacientes HPV-OPC recebendo o mesmo tratamento, e que a radiação e a cisplatina induzem uma resposta imune contra um tumor antigênico que aumenta seu efeito nas células cancerosas. Embora a incidência de positividade para HPV seja baixa (10-20%), uma vantagem para HPV + OPC foi observada em ensaios de cetuximabe e panitumumabe , um agente anti-EGFR semelhante, mas não uma interação consistente com o tratamento, embora HPV + OPC parece não se beneficiar na mesma medida que HPV-OPC para terapia anti-EGFR de segunda linha, possivelmente devido à menor expressão de EGFR em HPV + OPC.
Escolha da abordagem de tratamento
Na ausência de evidências de alta qualidade comparando uma abordagem cirúrgica primária com outras modalidades, as decisões são baseadas na consideração de fatores como exposição cirúrgica adequada e características anatomicamente favoráveis para ressecção adequada, função pós-tratamento e qualidade de vida . Essa seleção de pacientes pode permitir que eles evitem a morbidade do tratamento adjuvante adicional. Na ausência de características cirúrgicas favoráveis, o tratamento primário de escolha continua sendo a radiação com ou sem quimioterapia. As características do tumor que favorecem uma abordagem não cirúrgica incluem invasão da base da língua a ponto de exigir a ressecção de 50% ou mais da língua, envolvimento do músculo pterigóide, extensão para a gordura parafaríngea adjacente à carótida , envolvimento da mandíbula ou maxila ou invasão do espaço pré - vertebral .
A adequação da ressecção cirúrgica é um fator importante na determinação do papel da terapia adjuvante pós-operatória. Na presença de uma margem positiva no exame patológico, a maioria dos oncologistas de radiação recomenda radiação no local primário e quimioterapia concomitante. Uma margem negativa tem maior probabilidade de ser tratada com doses mais baixas e um volume de tratamento menor. Além disso, a remoção de um tumor volumoso pode permitir uma dosagem reduzida para estruturas faríngeas adjacentes não envolvidas e, portanto, menos efeito na deglutição normal .
Os resultados do câncer (controle local, controle regional e sobrevida) para ressecção transoral seguida por terapia adjuvante são comparáveis à quimiorradiação primária, de modo que as decisões de tratamento dependem mais da morbidade relacionada ao tratamento, resultado funcional e qualidade de vida. Os fatores do paciente também precisam ser levados em consideração, incluindo funcionalidade basal geral, histórico de tabagismo, risco de anestesia, função orofaríngea, deglutição e proteção das vias aéreas e potencial para reabilitação. A preferência do paciente é igualmente importante. Muitos ensaios clínicos estão em andamento com foco na desintensificação, frequentemente com estratificação de risco , por exemplo, risco baixo, intermediário e alto ( ver Fundakowski e Lango, Tabela I ).
As decisões clínicas também levam em consideração as morbidades, particularmente se os resultados do câncer forem comparáveis, por exemplo, a cirurgia está associada a um risco de sangramento entre 5–10% e um risco de 0,3% de hemorragia pós-operatória fatal. A cirurgia também pode ser complicada por disfagia e, embora a maioria dos pacientes possa tolerar uma dieta no primeiro dia pós-operatório, o uso de tubo de alimentação em longo prazo foi relatado em até 10%. Pacientes com tumores maiores, envolvimento da base da língua e necessidade de terapia adjuvante pós-operatória têm maior probabilidade de necessitar de sonda de alimentação de longo prazo. No geral, a função e a qualidade de vida parecem relativamente semelhantes entre a cirurgia com radiação pós-operatória e quimiorradiação primária, mas os pacientes com HPV + OPC tendem a ter melhor qualidade de vida no diagnóstico do que HPV-OPC, mas podem sofrer maiores perdas após o tratamento.
As considerações anatômicas também podem ditar a preferência por abordagens cirúrgicas ou não cirúrgicas. Por exemplo , trismo , língua volumosa, extensão limitada do pescoço, dentes proeminentes, toro da mandíbula (um crescimento ósseo na mandíbula) ou largura limitada da mandíbula seriam todas contra-indicações relativas à cirurgia. As considerações relacionadas ao tumor incluem invasão da mandíbula, base do crânio e extenso envolvimento da laringe ou mais da metade da base da língua. As considerações técnicas na oferta de cirurgia como modalidade primária incluem a capacidade presumida de atingir margens adequadas na amostra ressecada e o grau de defeito resultante, uma vez que margens fechadas ou positivas provavelmente resultarão em terapia adjuvante subsequente para atingir o controle da doença, com morbidade aumentada resultante . Os custos são difíceis de estimar, mas um estudo norte-americano, baseado em estimativas de 25% de todos os pacientes com OPC que receberam cirurgia isolada e 75% da cirurgia seguida de terapia adjuvante, usando os critérios do NCCN , descobriu que essa abordagem era menos cara do que a quimiorradiação primária.
A doença em estágio inicial está associada a um resultado relativamente favorável, para o qual a terapia de modalidade única é recomendada, a escolha dependendo da localização do tumor e acessibilidade. Por exemplo, tonsila unilateral ou tumores na base da língua geralmente serão tratados com ressecção transoral e esvaziamento cervical ipsilateral seletivo. Por outro lado, uma grande lesão na linha média da língua exigiria esvaziamento cervical bilateral, mas na ausência do que é considerado patologia adversa (margens positivas, extensão extracapsular) provavelmente será tratada apenas por cirurgia ou radiação, incluindo campos de radiação ipsilateral ou bilateral no pescoço, com cirurgia para os casos em que a probabilidade de terapia adjuvante é baixa.
Mas muitos HPV + OPC apresentam envolvimento dos linfonodos no pescoço e, portanto, um estágio mais avançado da doença, geralmente referido como doença localmente avançada. Este grupo é tratado principalmente com terapia multimodal, com exceção de um dos subgrupos mais favoráveis com pequenos tumores primários e envolvimento de linfonodos confinados a um único linfonodo não maior que 3 cm de tamanho, que, como observado, são considerados doença em estágio inicial. As três opções principais para doença localmente avançada, mas operável, são ressecção, esvaziamento cervical e terapia adjuvante; quimiorradiação (com possível cirurgia de resgate ); quimioterapia de indução seguida de radiação ou quimiorradiação. No entanto, a última opção não foi apoiada em ensaios clínicos que a testaram. A consideração primária da cirurgia para doença localmente avançada é obter margens negativas adequadas e poupar o paciente de quimiorradiação pós-operatória. Mas isso deve ser balanceado contra a morbidade e perda funcional da ressecção extensa, particularmente quando a base da língua está envolvida. Para evitar tal morbidade, a quimiorradiação primária é preferida. O manejo da doença nos linfonodos cervicais deve ser levado em consideração no tratamento da doença localmente avançada. As diretrizes para todos os OPC determinam que a extensão ectracapsular receba quimiorradiação pós-operatória. Quando a doença macroscópica do pescoço é evidente inicialmente, geralmente é administrada quimiorradiação primária.
Preferências do paciente
As diretrizes atuais são baseadas em dados para OPC como um todo, de modo que os pacientes geralmente estão sendo tratados independentemente do status do HPV, embora muitos médicos e pesquisadores estejam considerando a desintensificação. É provável que o tratamento dessa condição continue a evoluir no sentido de desintensificação, a fim de minimizar a perda de função, mas manter o controle da doença. Na ausência de ensaios clínicos e diretrizes específicas, as preferências do paciente devem ser levadas em consideração para minimizar a toxicidade e perda funcional de curto e longo prazo e otimizar a qualidade de vida, dada a sobrevida prolongada freqüentemente observada. Isso pode envolver a exploração dos valores dos pacientes em relação às compensações entre o controle da doença e os efeitos adversos do tratamento. Os pacientes que receberam CRT como tratamento primário para OPC colocam um alto valor na sobrevivência e, embora concordem que a desintensificação é desejável, relutam em trocar muitas vantagens de sobrevivência por toxicidade mais baixa, embora sejam mais propensos a renunciar à quimioterapia do que aceitar radiação reduzida.
Carcinoma de primário desconhecido
Em algumas situações, HPV + OPC pode se apresentar com linfonodos cervicais, mas sem doença evidente de um tumor primário (T0 N1-3) e, portanto, é classificado como Carcinoma de células escamosas de origem primária desconhecida . Ocorre em 2 a 4% dos pacientes que apresentam câncer metastático nos nódulos cervicais. A incidência de positividade para HPV está aumentando em uma taxa semelhante à observada em OPC. Nessas situações, a ressecção das tonsilas linguais e palatinas associada ao esvaziamento cervical pode ser diagnóstica e constituir intervenção suficiente, visto que as taxas de recorrência são baixas.
Prognóstico
A presença de HPV dentro do tumor é considerada um fator importante para predizer a sobrevida desde a década de 1990.
Comparação com câncer orofaríngeo HPV-negativo
O status do HPV do tumor está fortemente associado à resposta terapêutica positiva e à sobrevida em comparação com o câncer HPV-negativo, independentemente da modalidade de tratamento escolhida e mesmo após o ajuste para o estágio. Embora os pacientes com HPV + OPC tenham uma série de características demográficas favoráveis em comparação com os pacientes com HPV-OPC, essas diferenças representam apenas cerca de dez por cento da diferença de sobrevida observada entre os dois grupos. Taxas de resposta de mais de 80% são relatadas no câncer HPV + e a sobrevida livre de progressão de três anos foi relatada como 75–82% e 45–57%, respectivamente, para câncer HPV + e HPV-, e melhorando com o passar do tempo. É provável que o HPV + OPC seja inerentemente menos maligno do que o HPV-OPC, uma vez que os pacientes tratados apenas por cirurgia têm uma sobrevida melhor após o ajuste para o estágio.
Determinantes da sobrevivência
No ensaio clínico RTOG 0129, no qual todos os pacientes com doença avançada receberam radiação e quimioterapia, uma análise retrospectiva (análise de partição recursiva ou RPA) em três anos identificou três grupos de risco para sobrevivência (baixo, intermediário e alto) com base no HPV status, tabagismo, estágio T e estágio N ( ver Ang et al., Fig. 2). O status do HPV foi o principal determinante da sobrevida, seguido pela história de tabagismo e estágio. 64% eram HPV + e todos estavam no grupo de risco baixo e intermediário, com todos os pacientes não fumantes com HPV + no grupo de baixo risco. 82% dos pacientes com HPV + estavam vivos em três anos em comparação com 57% dos pacientes com HPV-, uma redução de 58% no risco de morte. A falha loco-regional também é menor no HPV +, sendo 14% contra 35% para o HPV-.
Determinantes da progressão da doença
A positividade para HPV confere um risco 50–60% menor de progressão da doença e morte, mas o uso de tabaco é um fator prognóstico negativo de forma independente. Uma análise conjunta de pacientes HPV + OPC e HPV-OPC com progressão da doença nos ensaios RTOG 0129 e 0522 mostrou que, embora menos HPV + OPC experimentou progressão da doença (23 v. 40%), o tempo médio para a progressão da doença após o tratamento foi semelhante ( 8 meses). A maioria (65%) das recorrências em ambos os grupos ocorreu no primeiro ano após o tratamento e foram loco-regionais. Embora a taxa de falha no pescoço oposto após o tratamento de apenas um lado seja de 2,4%, a taxa de recorrência isolada no pescoço oposto é de 1,7%, e ocorreram principalmente onde o tumor primário envolvia a linha média. No entanto, a taxa de falha no pescoço contralateral também é maior para HPV +. Daqueles que reaparecem neste local, quase todos foram tratados com sucesso (recuperados) por mais tratamento local no pescoço oposto.
Determinantes das taxas de metástase
O HPV + não reduziu a taxa de metástases (cerca de 45% dos pacientes com progressão), que são predominantemente nos pulmões (70%), embora alguns estudos relatem uma taxa mais baixa. com taxas de recorrência à distância de 3 anos de cerca de 10% para pacientes tratados com radiação primária ou quimiorradiação. Mesmo se ocorrer recorrência ou metástases, a positividade para HPV ainda confere uma vantagem. Em contraste, o uso de tabaco é um fator prognóstico independentemente negativo, com diminuição da resposta à terapia, aumento das taxas de recorrência da doença e diminuição da sobrevida. Os efeitos negativos do tabagismo aumentam com a quantidade fumada, principalmente se for superior a 10 anos-maço .
Preditores de sobrevivência
Após quimiorradiação
Para pacientes como aqueles tratados com RTOG 0129 com quimiorradiação primária, nomogramas detalhados foram derivados desse conjunto de dados combinado com RTOG 0522, permitindo a previsão do resultado com base em um grande número de variáveis . Por exemplo, um colegial casado com 71 anos, não fumante e graduado no ensino médio com um status de desempenho (PS) de 0, sem perda de peso ou anemia e um T3N1 HPV + OPC esperaria ter uma sobrevida livre de progressão de 92% em 2 anos e 88% em 5 anos. Um solteiro de 60 anos, não-fumante, formado no ensino médio com um PS de 1, perda de peso e anemia e um T4N2 HPV + OPC teria uma expectativa de sobrevivência de 70% em dois anos e 48% em cinco anos.
Depois da cirurgia
Informações menos detalhadas estão disponíveis para aqueles tratados principalmente com cirurgia, para os quais menos pacientes estão disponíveis, bem como baixas taxas de recorrência (7–10%), mas recursos que têm sido tradicionalmente úteis na previsão do prognóstico em outros cânceres de cabeça e pescoço, parecem ser menos úteis em HPV + OPC. Esses pacientes são frequentemente estratificados em três grupos de risco:
- Baixo risco: Sem características patológicas adversas
- Risco intermediário: invasão primária, perineural ou linfovascular T3 – T4, N2 (AJCC 7)
- Alto risco: margens positivas, ECE
Desenvolvimento de outros cânceres
Pacientes com HPV + OPC são menos propensos a desenvolver outros tipos de câncer, em comparação com outros pacientes com câncer de cabeça e pescoço. Uma possível explicação para o impacto favorável do HPV + é "a menor probabilidade de ocorrência de amplificação do gene 11q13, que é considerada um fator subjacente à recorrência mais rápida e mais frequente da doença" Presença de mutações TP53, um marcador para HPV-OPC, está associado a pior prognóstico. Acredita-se que a coloração de p16 de alto grau seja melhor do que a análise de PCR de HPV na previsão da resposta à radioterapia.
Recidiva regional após cirurgia
O risco de recorrência regional do câncer após o esvaziamento cervical é frequentemente estimado a partir de uma grande série com base em todos os cânceres de células escamosas aerodigestivas superiores. Nesta série, os riscos gerais em três anos por estágio patológico (AJCC 7) foram:
- pN0 4,7%
- pN1 4,9%
- pN2 12,1%
Epidemiologia
Em 2015, o câncer de células escamosas da região de cabeça e pescoço foi o quinto câncer mais comum além do câncer de pele, globalmente, com uma incidência anual de 600.000 casos e cerca de 60.000 casos anualmente nos Estados Unidos e na Europa. A incidência global de câncer de faringe em 2013 foi estimada em 136.000 casos. Para 2008, a Carga Global de Doenças para OPC em 2008 é estimada em 85.000 casos, dos quais 22.000 foram atribuíveis ao HPV, uma fração atribuível populacional (PAF) de 26%. Destes, 17.000 eram do sexo masculino e 4.400 do feminino, 13.000 (60%) tinham entre 50 e 69 anos de idade e a maioria dos casos (15.000) ocorreram em regiões desenvolvidas em comparação com as regiões em desenvolvimento (6.400). As taxas de incidência padronizadas por idade (ASR) diferem consideravelmente por região e país ( ver de Martel et al., 2017 Fig. 2b). ASRs para 2012 foram mais altos na Europa (Hungria 3,0) e América do Norte (Estados Unidos 1,7), mas muito mais baixos na África (≤ 0,3), Ásia (≤ 0,6), América Latina (≤ 0,4) e Oceania (≤ 0,2) (exceto Australasia , Austrália 0.9). Os números médios estimados de casos e ASR para os EUA no período de 2008 a 2012 foram de 15.738 e 4,5, respectivamente. HPV + OPC foi muito mais comum em homens do que mulheres (12.638, 7,6 e 3.100, 1,7). A faixa etária de maior incidência foi de 60-69 anos e foi maior em caucasianos do que em outras raças.
Os pacientes com HPV + OPC tendem a ser mais jovens do que os pacientes com HPV em geral. A apresentação clínica também está mudando do paciente “típico” com câncer de cabeça e pescoço com idade avançada e uso de substâncias importantes . Em contraste, os pacientes com câncer de HPV + são mais jovens (4ª – 6ª décadas), homens (proporção 8: 1) com nenhum ou apenas um histórico mínimo de tabagismo, geralmente caucasianos, atingiram níveis de educação mais altos, são casados e têm renda mais alta. Os fatores de risco para HPV-OPC e HPV + OPC tendem a ser independentes, com exceção do tabagismo, que tem efeito adverso em ambos. Os recursos de apresentação também são diferentes entre HPV + e HPV-OPC. Os tumores HPV + têm lesões primárias menores (menos de 4 cm), mas doença nodal mais avançada, resultando em estadiamento TNM mais alto. Isso, por sua vez, pode superestimar a gravidade do estado da doença.
Tendências
Tem havido uma tendência global de aumento da incidência de OPC, particularmente na América do Norte e no norte da Europa, mas mesmo em Taiwan, que tem uma taxa muito alta para todos os cânceres da região de cabeça e pescoço, as taxas de OPC aumentaram mais rapidamente entre 1995 e 2009 do que qualquer outro local de câncer. A carga global de HPV + OPC aumentou de 22.000 em 2008 para 29.000 em 2012, e o PAF de 26% para 31%, e é considerada uma epidemia . Nos Estados Unidos, o número estimado de casos foi de 12.410 em 2008, 13.930 em 2013 e 17.000 em 2017. Desses casos, o câncer de HPV + tem aumentado em comparação com o câncer de HPV-, mas o aumento de HPV + OPC excede o declínio de HPV- OPC resultando em um aumento geral no OPC. O aumento na incidência de câncer de faringe contrasta com um declínio marginal em outros cânceres de cabeça e pescoço. Como resultado, o câncer mais comum de cabeça e pescoço mudou da laringe para a orofaringe. Uma pesquisa de 23 países entre 1983 e 2002 mostrou um aumento no carcinoma de células escamosas da orofaringe que foi particularmente notável em homens jovens em países economicamente desenvolvidos . No Reino Unido, a incidência de câncer oral e orofaríngeo em homens aumentou 51%, de 7 / 100.000 para 11 / 100.000 entre 1989 e 2006. Nos Estados Unidos, há uma incidência crescente de câncer orofaríngeo associado ao HPV. No início da década de 1980, o HPV + foi contabilizado para apenas 7,5% dos casos nos EUA, mas em 2016 isso era de 70%, talvez como resultado da mudança de comportamentos sexuais, diminuição da popularidade das tonsilectomias, melhor avaliação radiológica e patológica e mudanças na classificação. Os cânceres de amígdala e orofaríngeo aumentaram na predominância masculina entre 1975 e 2004, apesar das reduções no tabagismo. HPV-OPC diminuiu com a diminuição das taxas de tabagismo de 1988 a 2004, enquanto HPV + OPC aumentou quase 7,5% ao ano de cerca de 16% de todos os casos de OPC no início de 1980 para quase 70% em 2004. O declínio no tabagismo pode ser ligada à diminuição da proporção de cânceres HPV negativos, enquanto as mudanças na atividade sexual podem ser refletidas no aumento da proporção de cânceres HPV positivos. Recentemente, nos EUA, a OPC associada ao HPV representa cerca de 60% dos casos de OPC em comparação com 40% na década anterior. Em 2007, nos EUA, a incidência de OPC geral, incluindo não associada ao HPV, é de 3,2 casos por 100.000 homens / ano e 1,9 por 100.000 todos os sexos / ano. Isso torna o HPV + OPC um dos cinco cânceres que aumentaram em incidência nos Estados Unidos desde 1975. O maior aumento na incidência ocorreu em pacientes com menos de 50 anos.
O aumento na incidência de OPC associado ao HPV também é visto em outros países, como a Suécia , com uma incidência de mais de 80% em 2007 para câncer nas amígdalas, Finlândia e República Tcheca . Parceiros de pacientes com câncer orofaríngeo HPV positivo não parecem ter infecção oral por HPV elevada em comparação com a população em geral. Na Austrália, a incidência de OPC associada ao HPV foi de 1,56 casos por 100.000 homens / ano (2001–2005), aumentando de 19% (1987–90) para 47% (2001–05) e 63,5% (2006–2010). No Canadá, a porcentagem de casos de OPC atribuíveis ao HPV aumentou de 47% em 2000 para 74% em 2012.
Veja também
Notas
Referências
Bibliografia
- "Critérios de Terminologia Comum para Eventos Adversos (CTCAE) Versão 4.0 Publicado: 28 de maio de 2009 (v4.03)" (PDF) . CTCAE . Instituto Nacional do Câncer . 14 de junho de 2010. Arquivado do original (PDF) em 30 de agosto de 2017 . Retirado em 3 de agosto de 2017 .
Artigos
- Fakhry, Carole; Gillison, Maura L. (10 de junho de 2006). "Implicações clínicas do papilomavírus humano em cânceres de cabeça e pescoço" . Journal of Clinical Oncology (Review). 24 (17): 2606–2611. doi : 10.1200 / JCO.2006.06.1291 . PMC 4696042 . PMID 16763272 .
- Lindberg, Robert (junho de 1972). "Distribuição de metástases de linfonodo cervical de carcinoma de células escamosas do trato respiratório superior e digestivo". Câncer . 29 (6): 1446–1449. doi : 10.1002 / 1097-0142 (197206) 29: 6 <1446 :: AID-CNCR2820290604> 3.0.CO; 2-C . PMID 5031238 .
- Mehanna, H .; Jones, TM; Gregoire, V .; Ang, KK (24 de abril de 2010). "Carcinoma orofaríngeo relacionado ao papilomavírus humano". BMJ (Editorial). 340 (7752): 879–880. doi : 10.1136 / bmj.c1439 . JSTOR 40701677 . PMID 20339160 . S2CID 27997605 .
- Nguyen, NP; Chi, A .; Nguyen, LM; Ly, BH; Karlsson, U .; Vinh-Hung, V. (2009). Câncer orofaríngeo associado ao papilomavírus humano: uma nova entidade clínica " . QJM (revisão). 103 (4): 229–236. doi : 10.1093 / qjmed / hcp176 . PMID 20015950 .
- Psyrri, A .; Gouveris, P .; Vermorken, JB (2009). "Tumores de cabeça e pescoço relacionados ao papilomavírus humano: implicação clínica e de pesquisa". Opinião Atual em Oncologia (Revisão). 21 (3): 201–205. doi : 10.1097 / CCO.0b013e328329ab64 . PMID 19370803 . S2CID 35188456 .
- Ramqvist, Torbjörn; Dalianis, Tina (novembro de 2010). "Oropharyngeal Cancer Epidemic and Human Papillomavirus" . Doenças infecciosas emergentes (revisão). 16 (11): 1671–1677. doi : 10.3201 / eid1611.100452 . PMC 3294514 . PMID 21029523 .
- Westra, WH (2009). "As mudanças na face do câncer de cabeça e pescoço no século 21: o impacto do HPV na epidemiologia e na patologia do câncer bucal" . Patologia de Cabeça e Pescoço (Revisão). 3 (1): 78–81. doi : 10.1007 / s12105-009-0100-y . PMC 2807531 . PMID 20596995 .
Vírus do papiloma humano (HPV) e biologia molecular
- Adelstein, DJ; Rodriguez, Cristina P. (3 de fevereiro de 2010). "Human Papillomavirus: Changing Paradigms in Oropharyngeal Cancer". Relatórios atuais de oncologia . 12 (2): 115-120. doi : 10.1007 / s11912-010-0084-5 . PMID 20425596 . S2CID 11091993 .
- Agoston, E..; Robinson, S..; Mehra, K. .; et al. (2010). "Detecção da reação em cadeia da polimerase do HPV no carcinoma escamoso da orofaringe" . American Journal of Clinical Pathology . 134 (1): 36–41. doi : 10.1309 / AJCP1AAWXE5JJCLZ . PMID 20551264 .
- Ault, KA (2006). "Epidemiologia e história natural das infecções por papilomavírus humano no trato genital feminino" . Doenças infecciosas em obstetrícia e ginecologia . 2006 : 1–5. doi : 10.1155 / IDOG / 2006/40470 . PMC 1581465 . PMID 16967912 .
- Chung, CH; Gillison, ML (27 de outubro de 2009). "Papilomavírus humano no câncer de cabeça e pescoço: seu papel na patogênese e implicações clínicas" . Clinical Cancer Research . 15 (22): 6758–6762. doi : 10.1158 / 1078-0432.CCR-09-0784 . PMID 19861444 .
- Cristina Mazon, Renata; Rovigatti Gerbelli, Thaís; Benatti Neto, Carlos; et al. (Fevereiro de 2011). "Expressão anormal do ciclo celular das proteínas p27, mdm2 e catepsina B no carcinoma de células escamosas oral infectado com papilomavírus humano". Acta Histochemica . 113 (2): 109–116. doi : 10.1016 / j.acthis.2009.08.008 . PMID 19811804 .
- D'Souza, cigano; Gross, Neil D .; Pai, Sara I .; Haddad, Robert; Anderson, Karen S .; Rajan, Shirani; Gerber, Jennifer; Gillison, Maura L .; Posner, Marshall R. (10 de agosto de 2014). "Oral Human Papillomavirus (HPV) Infection in HPV-Positive Patients With Oropharyngeal Cancer and their Partners" . Journal of Clinical Oncology . 32 (23): 2408–2415. doi : 10.1200 / JCO.2014.55.1341 . PMC 4263818 . PMID 24778397 .
- Elmofty, S .; Patil, S. (2006). "Carcinoma de células escamosas não queratinizantes orofaríngeo relacionado ao papilomavírus humano (HPV): Caracterização de um fenótipo distinto". Cirurgia Oral, Medicina Oral, Patologia Oral, Radiologia Oral e Endodontologia . 101 (3): 339–345. doi : 10.1016 / j.tripleo.2005.08.001 . PMID 16504868 .
- Frisch, M .; Biggar, R. (1999). "Paralelo etiológico entre carcinomas tonsilares e anogenitais de células escamosas" . The Lancet (manuscrito enviado). 354 (9188): 1442–1443. doi : 10.1016 / S0140-6736 (99) 92824-6 . PMID 10543674 . S2CID 33391604 .
- Gillison, ML; Koch, WM; Capone, RB; et al. (Maio de 2000). "Evidência de uma associação causal entre o papilomavírus humano e um subconjunto de cânceres de cabeça e pescoço" . Jornal do Instituto Nacional do Câncer . 92 (9): 709–720. doi : 10.1093 / jnci / 92.9.709 . ISSN 0027-8874 . PMID 10793107 .
- Guan, X .; Sturgis, E .; Lei, D .; Liu, Z .; Dahlstrom, K .; Wei, Q .; Li, G. (2010). "Associação de variantes genéticas TGF-beta1 com câncer orofaríngeo HPV16-positivo" . Clinical Cancer Research . 16 (5): 1416–1422. doi : 10.1158 / 1078-0432.CCR-09-2877 . PMC 2831118 . PMID 20179236 .
- Ha, Patrick K; Califano, Joseph A (janeiro de 2006). "Promotor de metilação e inativação de genes supressores de tumor no carcinoma de células escamosas oral". The Lancet Oncology . 7 (1): 77–82. doi : 10.1016 / S1470-2045 (05) 70540-4 . PMID 16389187 .
- Haeggblom, Linnea; Ramqvist, Torbjörn; Tommasino, Massimo; Dalianis, Tina; Näsman, Anders (dezembro de 2017). "É hora de mudar as perspectivas sobre o HPV no câncer orofaríngeo. Uma revisão sistemática da prevalência do HPV por sub-site orofaríngeo nos últimos 3 anos" . Papillomavirus Research . 4 : 1-11. doi : 10.1016 / j.pvr.2017.05.002 . PMC 5883233 . PMID 29179862 .
- Hong, Angela; Zhang, Xiaoying; Jones, Deanna; Veillard, Anne-Sophie; Zhang, Mei; Martin, Andrew; Lyons, J. Guy; Lee, C. Soon; Rose, Barbara (fevereiro de 2016a). "Relações entre a mutação p53, o status do HPV e o resultado no carcinoma de células escamosas da orofaringe". Radioterapia e Oncologia . 118 (2): 342–349. doi : 10.1016 / j.radonc.2016.02.009 . PMID 26952933 .
- Howard, Jason D .; Chung, Christine H. (julho de 2012). "Biologia do câncer orofaríngeo relacionado ao papilomavírus humano" . Seminars in Radiation Oncology . 22 (3): 187–193. doi : 10.1016 / j.semradonc.2012.03.002 . PMC 3715056 . PMID 22687942 .
- Jung, A .; Briolat, J .; Millon, R .; De Reyniès, A .; Rickman, D .; Thomas, E .; Abecassis, J .; Clavel, C .; Wasylyk, B. (2009). "Relevância biológica e clínica da infecção pelo papilomavírus humano (HPV) transcricionalmente ativo no carcinoma de células escamosas da orofaringe". International Journal of Cancer . 126 (8): 1882–1894. doi : 10.1002 / ijc.24911 . PMID 19795456 . S2CID 3441257 .
- Klussmann, J .; Mooren, J .; Lehnen, M .; et al. (Março de 2009). "Assinaturas genéticas do carcinoma orofaríngeo relacionado e não relacionado ao HPV e suas implicações prognósticas" . Clinical Cancer Research . 15 (5): 1779–1786. doi : 10.1158 / 1078-0432.CCR-08-1463 . ISSN 1078-0432 . PMID 19223504 .
- Kreimer, Aimée R .; Bhatia, Rohini K .; Messeguer, Andrea L .; González, Paula; Herrero, Rolando; Giuliano, Anna R. (janeiro de 2010). "O Papilomavírus Humano Oral em Indivíduos Saudáveis: Uma Revisão Sistemática da Literatura" . Doenças sexualmente transmissíveis . 37 (6): 386–91. doi : 10.1097 / OLQ.0b013e3181c94a3b . PMID 20081557 . S2CID 32378293 .
- Lajer, CB; Buchwald, CV (2010). "O papel do papilomavírus humano no câncer de cabeça e pescoço" . APMIS . 118 (6–7): 510–519. doi : 10.1111 / j.1600-0463.2010.02624.x . PMID 20553531 . S2CID 7199240 .
- Lassen, P. (2010). "O papel do papilomavírus humano no câncer de cabeça e pescoço e o impacto no resultado da radioterapia". Radioterapia e Oncologia . 95 (3): 371–380. doi : 10.1016 / j.radonc.2010.04.022 . PMID 20493569 .
- Lawrence MS, Sougnez C, Lichtenstein L, et al. (28 de janeiro de 2015). "Caracterização genômica abrangente de carcinomas de células escamosas de cabeça e pescoço" . Nature . 517 (7536): 576–582. Bibcode : 2015Natur.517..576T . doi : 10.1038 / nature14129 . PMC 4311405 . PMID 25631445 .
- Lohavanichbutr, P .; Houck, J .; Fan, W .; et al. (Fevereiro de 2009). "Perfis de expressão gênica de todo o genoma de câncer orofaríngeo HPV-positivo e HPV-negativo: implicações potenciais para as opções de tratamento" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 135 (2): 180–188. doi : 10.1001 / archoto.2008.540 . ISSN 0886-4470 . PMC 2761829 . PMID 19221247 .
- Mannarini, L .; Kratochvil, V .; Calabrese, L .; Gomes Silva, L .; Morbini, P .; Betka, J .; Benazzo, M. (2009). "Vírus do papiloma humano (HPV) na região da cabeça e pescoço: revisão da literatura" . Acta Otorhinolaryngologica Italica . 29 (3): 119–126. PMC 2815356 . PMID 20140157 .
- Martinez, I .; Wang, J .; Hobson, K .; Ferris, R .; Khan, S. (janeiro de 2007). "Identificação de genes diferencialmente expressos em carcinomas de células escamosas da orofaringe HPV-positivos e HPV-negativos" . European Journal of Cancer . 43 (2): 415–432. doi : 10.1016 / j.ejca.2006.09.001 . ISSN 0959-8049 . PMC 1847595 . PMID 17079134 .
- Maslon, Magda M .; Hupp, Ted R. (setembro de 2010). "Descoberta de drogas e p53 mutante". Trends in Cell Biology . 20 (9): 542–555. doi : 10.1016 / j.tcb.2010.06.005 . PMID 20656489 .
- Michl, P; Pazdera, J; Prochazka, M; Rosa, R; Stosova, T (2010). "Papilomavírus humano na etiologia dos carcinomas de cabeça e pescoço" (PDF) . Artigos Biomédicos da Faculdade de Medicina da Universidade Palacky, Olomouc, Tchecoslováquia . 154 (1): 9–12. doi : 10.5507 / bp.2010.004 . PMID 20445705 .
- Robinson, M .; Sloan, P .; Shaw, R. (2010). "Refinando o diagnóstico de carcinoma de células escamosas da orofaringe usando o teste do papilomavírus humano". Oncologia Oral . 46 (7): 492–496. doi : 10.1016 / j.oraloncology.2010.02.013 . PMID 20227331 .
- Schlecht, N .; Burk, R .; Adrien, L .; et al. (Novembro de 2007). Perfis de expressão gênica em câncer de cabeça e pescoço infectado por HPV ". The Journal of Pathology . 213 (3): 283–293. doi : 10.1002 / path.2227 . ISSN 0022-3417 . PMID 17893858 . S2CID 11205618 .
- Seiwert, Tanguy Y. (10 de dezembro de 2014). "Ties That Bind: p16 As a Prognostic Biomarker and the Need for High-Accuracy Human Papillomavirus Testing". Journal of Clinical Oncology . 32 (35): 3914–3916. doi : 10.1200 / JCO.2014.57.9268 . PMID 25366683 .
- Smeets, S .; Van Der Plas, M .; Schaaij-Visser, T .; Van Veen, E .; Van Meerloo, J .; Braakhuis, B .; Steenbergen, R .; Brakenhoff, R. (2010). Imortalização de queratinócitos orais por inativação funcional das vias p53 e pRb " . International Journal of Cancer . 128 (7): 1596–605. doi : 10.1002 / ijc.25474 . PMID 20499310 . S2CID 21846809 .
- Syrjänen, S. (2004). "Infecções por HPV e carcinoma tonsilar" . Journal of Clinical Pathology . 57 (5): 449–455. doi : 10.1136 / jcp.2003.008656 . PMC 1770289 . PMID 15113849 .
- Syrjänen, Kari; Syrjänen, Stina; Lamberg, Matti; Pyrhönen, Seppo; Nuutinen, Juhant (dezembro de 1983). "Evidências morfológicas e imunohistoquímicas que sugerem o envolvimento do papilomavírus humano (HPV) na carcinogênese de células escamosas oral". International Journal of Oral Surgery . 12 (6): 418–424. doi : 10.1016 / S0300-9785 (83) 80033-7 . PMID 6325356 .
- Underbrink, M .; Hoskins, S .; Pou, A .; Albrecht, T. (2008). "Interação viral: um possível fator contribuinte na progressão do câncer de cabeça e pescoço". Acta Oto-Laryngologica . 128 (12): 1361–1369. doi : 10.1080 / 00016480801965001 . PMID 18607925 . S2CID 205395382 .
- Vidal, L .; Gillison, M. (2008). Human papillomavirus in HNSCC: reconhecimento de um tipo de doença distinto ". Hematology Oncology Clinics of North America . 22 (6): 1125–1142, vii. doi : 10.1016 / j.hoc.2008.08.006 . PMID 19010263 .
- Vokes, EE; Agrawal, N; Seiwert, TY (dezembro de 2015). "Câncer de cabeça e pescoço associado ao HPV" . Jornal do Instituto Nacional do Câncer . 107 (12): djv344. doi : 10.1093 / jnci / djv344 . PMID 26656751 .
- Weinberger, P .; Yu, Z .; Kountourakis, P .; Sasaki, C .; Haffty, B .; Kowalski, D .; Merkley, M .; Rimm, D .; Camp, R .; Psyrri, A. (setembro de 2009). "Definindo fenótipos moleculares do carcinoma de células escamosas da orofaringe associado ao papilomavírus humano: Validação da hipótese de três classes". Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 141 (3): 382–389.e1. doi : 10.1016 / j.otohns.2009.04.014 . ISSN 0194-5998 . PMID 19716018 . S2CID 207300943 .
- Yamakawa-Kakuta, Y; Kawamata, H; Doi, Y; Fujimori, T; Imai, Y (15 de setembro de 2009). "A expressão de HPV16 / 18 E6 / E7 em carcinomas de células escamosas de cabeça e pescoço está relacionada às suas características clínico-patológicas?" . International Journal of Oncology . 35 (5): 983–988. doi : 10.3892 / ijo_00000412 . PMID 19787251 .
- zur Hausen, Harald (1 de maio de 2002). "Papilomavírus e câncer: dos estudos básicos à aplicação clínica". Nature Reviews Cancer . 2 (5): 342–350. doi : 10.1038 / nrc798 . PMID 12044010 . S2CID 4991177 .
Diagnóstico e estadiamento
- Chenevert, J; Seethala, RR; Barnes, EL; Chiosea, SI (abril de 2012). "Carcinoma de células escamosas metastático para o pescoço de um primário desconhecido: o impacto potencial da avaliação patológica moderna na incidência percebida de carcinoma orofaríngeo positivo para papilomavírus humano antes de 1970". O laringoscópio . 122 (4): 793–796. doi : 10.1002 / lary.21899 . PMID 22252715 . S2CID 25749527 .
- Goldenberg, David; Begum, Shahnaz; Westra, William H .; Khan, Zubair; Sciubba, James; Pai, Sara I .; Califano, Joseph A .; Tufano, Ralph P .; Koch, Wayne M. (julho de 2008). "Metástase de linfonodo cístico em pacientes com câncer de cabeça e pescoço: Um fenômeno associado ao HPV" (PDF) . Cabeça e pescoço . 30 (7): 898–903. doi : 10.1002 / hed.20796 . PMID 18383529 . S2CID 32614424 .
- Huang, Shao Hui; Xu, Wei; Waldron, John; et al. (10 de março de 2015). "Refining American Joint Committee on Cancer / Union for International Cancer Control TNM Stage and Prognostic Groups for Human Papillomavirus-Related Oropharyngeal Carcinomas". Journal of Clinical Oncology . 33 (8): 836–845. doi : 10.1200 / JCO.2014.58.6412 . PMID 25667292 .
- Keane, Florence K .; Chen, Yui-Hui; Neville, Bridget A .; Tishler, Roy B .; Schoenfeld, Jonathan D .; Catalano, Paul J .; Margalit, Danielle N. (1 de agosto de 2015). "Mudança do significado prognóstico do estágio do tumor e do estágio nodal em pacientes com carcinoma de células escamosas da orofaringe na era do papilomavírus humano". Câncer . 121 (15): 2594–2602. doi : 10.1002 / cncr.29402 . PMID 25873094 . S2CID 205670627 .
- Lydiatt, William M .; Patel, Snehal G .; O'Sullivan, Brian; Brandwein, Margaret S .; Ridge, John A .; Migliacci, Jocelyn C .; Loomis, Ashley M .; Shah, Jatin P. (março de 2017). "Mudanças principais em câncer de cabeça e pescoço no manual de estadiamento do câncer da oitava edição do Comitê Conjunto Americano de Câncer" . CA: A Cancer Journal for Clinicians . 67 (2): 122–137. doi : 10.3322 / caac.21389 . PMID 28128848 .
- O'Sullivan, Brian; Huang, Shao Hui; Su, Jie; et al. (Abril de 2016). "Desenvolvimento e validação de um sistema de estadiamento para câncer orofaríngeo relacionado ao HPV pela Colaboração Internacional na Rede de Câncer Orofaríngeo para Estadiamento (ICON-S): um estudo de coorte multicêntrico". The Lancet Oncology . 17 (4): 440–451. doi : 10.1016 / S1470-2045 (15) 00560-4 . PMID 26936027 .
- Porceddu, Sandro V (abril de 2016). "Uma classificação TNM para câncer orofaríngeo HPV +". The Lancet Oncology (Editorial). 17 (4): 403–404. doi : 10.1016 / S1470-2045 (15) 00611-7 . PMID 26936026 .
Tratamento
- Brockstein, Bruce E .; Vokes, Everett E. (fevereiro de 2011). "Câncer de cabeça e pescoço em 2010: maximizando a sobrevivência e minimizando a toxicidade". Nature Reviews Clinical Oncology . 8 (2): 72–74. doi : 10.1038 / nrclinonc.2010.226 . PMID 21278773 . S2CID 1347226 .
- Corry, junho; Peters, Lester J .; Rischin, Danny (10 de janeiro de 2015). "Impacto do tamanho do centro e da experiência nos resultados em câncer de cabeça e pescoço". Journal of Clinical Oncology . 33 (2): 138-140. doi : 10.1200 / JCO.2014.58.2239 . PMID 25488964 .
- Fakhry, C .; Westra, W .; Li, S .; Cmelak, A .; Ridge, J .; Pinto, H .; Forastiere, A .; Gillison, M. (fevereiro de 2008). "Melhoria da sobrevida de pacientes com carcinoma epidermóide de cabeça e pescoço positivo para papilomavírus humano em um ensaio clínico prospectivo" . Jornal do Instituto Nacional do Câncer . 100 (4): 261–269. doi : 10.1093 / jnci / djn011 . ISSN 0027-8874 . PMID 18270337 .
- Fakhry, Carole; Zhang, Qiang; Nguyen-Tan, Phuc Felix; et al. (20 de outubro de 2014). "Human Papillomavirus and Overall Survival After Progression of Oropharyngeal Squamous Cell Carcinoma" . Journal of Clinical Oncology . 32 (30): 3365–3373. doi : 10.1200 / JCO.2014.55.1937 . PMC 4195851 . PMID 24958820 .
- Fundakowski, Christopher E .; Lango, Miriam (11 de julho de 2016). "Considerações no tratamento cirúrgico versus não cirúrgico do câncer orofaríngeo HPV positivo" . Câncer de cabeça e pescoço (revisão). 1 (1): 6. doi : 10.1186 / s41199-016-0007-8 . PMC 6457136 . PMID 31093336 .
- Galloway, TJ; Ridge, JA (10 de outubro de 2015). Management of Squamous Cancer Metastatic to Cervical Nodes With an Unknown Primary Site ". Journal of Clinical Oncology (Review). 33 (29): 3328–3337. CiteSeerX 10.1.1.1029.7347 . doi : 10.1200 / JCO.2015.61.0063 . PMID 26351351 .
- Maxwell, Jessica H .; Mehta, Vikas; Wang, Hong; Cunningham, Diana; Duvvuri, Umamaheswar; Kim, Seungwon; Johnson, Jonas; Ferris, Robert L. (julho de 2014). Qualidade de vida em pacientes com câncer de cabeça e pescoço: Impacto do HPV e modalidade de tratamento primário ". O laringoscópio . 124 (7): 1592–1597. doi : 10.1002 / lary.24508 . PMID 24353066 . S2CID 8040452 .
- Mehanna, H; Evans, M; Beasley, M; Chatterjee, S; Dilkes, M; Homer, J; O'Hara, J; Robinson, M; Shaw, R; Sloan, P (12 de maio de 2016). "Oropharyngeal cancer: United Kingdom National Multidisciplinary Guidelines" . The Journal of Laryngology & Otology . 130 (S2): S90 – S96. doi : 10.1017 / S0022215116000505 . PMC 4873902 . PMID 27841123 .
- Mais, Yogesh I .; Tsue, Terance T .; Girod, Douglas A .; Harbison, John; Sykes, Kevin J .; Williams, Carson; Shnayder, Yelizaveta (1 de janeiro de 2013). "Resultados funcionais da deglutição após cirurgia robótica transoral vs quimiorradioterapia primária em pacientes com câncer de orofaringe e supraglote em estágio avançado" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 139 (1): 43–48. doi : 10.1001 / jamaoto.2013.1074 . PMID 23247974 .
- Sharma, Arun; Méndez, Eduardo; Yueh, Bevan; Lohavanichbutr, Pawadee; Houck, John; Doody, David R .; Futran, Neal D .; Upton, Melissa P .; Schwartz, Stephen M .; Chen, Chu (24 de janeiro de 2012). "Pacientes com câncer de orofaringe e cavidade oral positiva para papilomavírus humano não têm trajetórias de melhor qualidade de vida" . Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 146 (5): 739–745. doi : 10.1177 / 0194599811434707 . PMC 3535430 . PMID 22275190 .
- Spanos, William C .; Nowicki, Paul; Lee, Dong Wook; Hoover, Andrew; Hostager, Bruce; Gupta, Anjali; Anderson, Mary E .; Lee, John H. (1 de novembro de 2009). "Resposta imunológica durante a terapia com cisplatina ou radiação para câncer de cabeça e pescoço relacionado ao papilomavírus humano" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 135 (11): 1137–46. doi : 10.1001 / archoto.2009.159 . PMID 19917928 .
- Wansom, Derrick; Luz, Emily; Worden, Frank; et al. (20 de dezembro de 2010). "Correlação da imunidade celular com o status e resultado do papilomavírus humano 16 em pacientes com câncer orofaríngeo avançado" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 136 (12): 1267–73. doi : 10.1001 / archoto.2010.211 . PMC 3342998 . PMID 21173378 .
Cirurgia
- Adelstein, David J .; Ridge, John A .; Brizel, David M .; et al. (Dezembro 2012). "Ressecção transoral de câncer faríngeo: Resumo de uma reunião de planejamento de ensaios clínicos do Comitê Diretor de Câncer de Cabeça e Pescoço do Instituto Nacional do Câncer, 6 a 7 de novembro de 2011, Arlington, Virgínia" . Cabeça e pescoço . 34 (12): 1681–1703. doi : 10.1002 / hed.23136 . hdl : 2027,42 / 94490 . PMC 7721598 . PMID 23015475 . S2CID 542.440 .
- de Almeida, John R .; Byrd, James K .; Wu, Rebecca; Stucken, Chaz L .; Duvvuri, Uma; Goldstein, David P .; Miles, Brett A .; Teng, Marita S .; Gupta, Vishal; Genden, Eric M. (setembro de 2014). "Uma revisão sistemática de cirurgia robótica transoral e radioterapia para câncer de orofaringe precoce: Uma revisão sistemática". O laringoscópio . 124 (9): 2096–2102. doi : 10.1002 / lary.24712 . PMID 24729006 . S2CID 20283441 .
- Ambrosch, Petra; Kron, Martina; Pradier, O .; Steiner, W. (2001). "Eficácia da dissecção seletiva do pescoço: Uma revisão de 503 casos de tratamento eletivo e terapêutico do pescoço no carcinoma de células escamosas do trato aerodigestivo superior". Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 124 (2): 180–187. doi : 10.1067 / mhn.2001.111598 . PMID 11226954 . S2CID 25298496 .
- Canis, Martin; Martin, Alexios; Kron, Martina; Konstantinou, Alexandra; Ihler, Friedrich; Wolff, Hendrik A .; Matthias, Christoph; Steiner, Wolfgang (29 de dezembro de 2012). "Resultados da microcirurgia transoral a laser em 102 pacientes com carcinoma de células escamosas da amígdala" . Arquivos Europeus de Oto-Rhino-Laryngology . 270 (8): 2299–2306. doi : 10.1007 / s00405-012-2335-6 . PMC 3699702 . PMID 23274878 .
- Chen, Allen M .; Daly, Megan E .; Luu, Quang; Donald, Paul J .; Farwell, D. Gregory (março de 2015). "Comparação de resultados funcionais e qualidade de vida entre cirurgia transoral e quimiorradioterapia definitiva para câncer de orofaringe". Cabeça e pescoço . 37 (3): 381–385. doi : 10.1002 / hed.23610 . PMID 24431059 . S2CID 28264800 .
- Chia, Stanley H .; Gross, Neil D .; Richmon, Jeremy D. (dezembro de 2013). "Experiência do cirurgião e complicações com cirurgia robótica transoral (TORS)". Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 149 (6): 885–892. doi : 10.1177 / 0194599813503446 . PMID 24013139 . S2CID 3339804 .
- Choby, Garret W .; Kim, Jeehong; Ling, Diane C .; Abberbock, Shira; Mandal, Rajarsi; Kim, Seungwon; Ferris, Robert L .; Duvvuri, Umamaheswar (1 de junho de 2015). "Transoral Robotic Surgery Alone for Oropharyngeal Cancer" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 141 (6): 499–504. doi : 10.1001 / jamaoto.2015.0347 . PMID 25834991 .
- Cohen, Marc A .; Weinstein, Gregory S .; O'Malley, Bert W .; Feldman, Michael; Quon, Harry (abril de 2011). "Cirurgia robótica transoral e status do papilomavírus humano: resultados oncológicos". Cabeça e pescoço . 33 (4): 573–580. doi : 10.1002 / hed.21500 . PMID 21425382 . S2CID 24704123 .
- Durmus, K; Rangarajan, SV; Antigo, MO; Agrawal, A; Teknos, TN; Ozer, E (junho de 2014). "Abordagem robótica transoral para carcinoma de primário desconhecido" . Cabeça e pescoço . 36 (6): 848–52. doi : 10.1002 / hed.23385 . PMC 4266274 . PMID 23720223 .
- Dziegielewski, Peter T .; Teknos, Theodoros N .; Durmus, Kasim; Velho, Matthew; Agrawal, Amit; Kakarala, Kiran; Marcinow, Anna; Ozer, Enver (1 de novembro de 2013). "Cirurgia Robótica Transoral para Câncer Orofaríngeo" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 139 (11): 1099–108. doi : 10.1001 / jamaoto.2013.2747 . PMC 4274181 . PMID 23576186 .
- Dowthwaite, Samuel A .; Franklin, Jason H .; Palma, David A .; Fung, Kevin; Yoo, John; Nichols, Anthony C. (2012). "O papel da cirurgia robótica transoral no tratamento do câncer orofaríngeo: uma revisão da literatura" . ISRN Oncology . 2012 : 945162. doi : 10.5402 / 2012/945162 . PMC 3347745 . PMID 22606380 .
- Genden, Eric M .; Kotz, Tamar; Tong, Charles CL; Smith, Claris; Sikora, Andrew G .; Teng, Marita S .; Packer, Stuart H .; Lawson, William L .; Kao, Johnny (agosto de 2011). "Ressecção e reconstrução robótica transoral para câncer de cabeça e pescoço". O laringoscópio . 121 (8): 1668–1674. doi : 10.1002 / lary.21845 . PMID 21792953 . S2CID 25175486 .
- Graboyes, EM; Sinha, P; Thorstad, WL; Rich, JT; Haughey, BH (novembro de 2015). "Manejo de primárias desconhecidas relacionadas ao papilomavírus humano da cabeça e pescoço com uma abordagem cirúrgica transoral". Cabeça e pescoço . 37 (11): 1603–11. doi : 10.1002 / hed.23800 . PMID 24931847 . S2CID 33000811 .
- Haughey, Bruce H .; Hinni, Michael L .; Salassa, John R .; Hayden, Richard E .; Grant, David G .; Rich, Jason T .; Milov, Simon; Lewis, James S .; Krishna, Murli (dezembro de 2011). "Microcirurgia transoral a laser como tratamento primário para câncer orofaríngeo em estágio avançado: Um estudo multicêntrico dos Estados Unidos". Cabeça e pescoço . 33 (12): 1683–1694. doi : 10.1002 / hed.21669 . PMID 21284056 . S2CID 10611085 .
- Mehta, V; Johnson, P; Tassler, A; Kim, S; Ferris, RL; Nance, M; Johnson, JT; Duvvuri, U (janeiro de 2013). "Um novo paradigma para o diagnóstico e tratamento de tumores primários desconhecidos da cabeça e pescoço: um papel para a cirurgia robótica transoral" . O laringoscópio . 123 (1): 146–151. doi : 10.1002 / lary.23562 . PMID 23154813 . S2CID 321364 .
- Moore, Eric J .; Hinni, Michael L .; Olsen, Kerry D .; Price, Daniel L .; Laborde, Rebecca R .; Inman, Jared C. (junho de 2012). "Considerações de custo no tratamento do carcinoma de células escamosas da orofaringe". Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 146 (6): 946–951. doi : 10.1177 / 0194599812437534 . PMID 22344182 . S2CID 40004254 .
- Moore, Eric J .; Henstrom, Doug K .; Olsen, Kerry D .; Kasperbauer, Jan L .; McGree, Michaela E. (março de 2009). "Ressecção transoral do carcinoma de células escamosas tonsilar". O laringoscópio . 119 (3): 508–515. doi : 10.1002 / lary.20124 . PMID 19235742 . S2CID 26256802 .
- Moore, Eric J .; Olsen, Kerry D .; Kasperbauer, Jan L. (novembro de 2009). "Cirurgia robótica transoral para carcinoma de células escamosas da orofaringe: Um estudo prospectivo de viabilidade e resultados funcionais". O laringoscópio . 119 (11): 2156–2164. doi : 10.1002 / lary.20647 . PMID 19824067 . S2CID 20097467 .
- Moore, Eric J .; Olsen, Steven M .; Laborde, Rebecca R .; García, Joaquín J .; Walsh, Francis J .; Price, Daniel L .; Janus, Jeffrey R .; Kasperbauer, Jan L .; Olsen, Kerry D. (março de 2012). "Resultados funcionais e oncológicos de longo prazo da cirurgia robótica transoral para carcinoma de células escamosas da orofaringe" . Mayo Clinic Proceedings . 87 (3): 219–225. doi : 10.1016 / j.mayocp.2011.10.007 . PMC 3538408 . PMID 22386176 .
- Moore, Eric J .; Hinni, Michael L. (abril de 2013). "Revisão crítica: Microcirurgia a laser transoral e cirurgia com assistência robótica para câncer de orofaringe incluindo câncer relacionado ao papilomavírus humano". International Journal of Radiation Oncology, Biology, Physics (Review). 85 (5): 1163–1167. doi : 10.1016 / j.ijrobp.2012.08.033 . PMID 23182390 .
- Patel, SA; Magnuson, JS; Holsinger, FC; et al. (Novembro de 2013). "Cirurgia robótica para carcinoma de células escamosas primário de cabeça e pescoço de local desconhecido" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 139 (11): 1203–1211. doi : 10.1001 / Jamaoto.2013.5189 . PMID 24136446 .
- Pollei, Taylor R .; Hinni, Michael L .; Moore, Eric J .; Hayden, Richard E .; Olsen, Kerry D .; Casler, John D .; Walter, Logan C. (1 de novembro de 2013). "Análise de sangramento pós-operatório e fatores de risco em cirurgia transoral da orofaringe" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 139 (11): 1212–8. doi : 10.1001 / jamaoto.2013.5097 . PMID 24113922 .
- Rinaldi, V; Pagani, D; Torretta, S; Pignataro, L (26 de setembro de 2013). "Cirurgia robótica transoral no tratamento de tumores de cabeça e pescoço" . Ecancermedicalscience . 7 : 359. doi : 10.3332 / ecancer.2013.359 . PMC 3782590 . PMID 24073017 .
- Sinclair, CF; McColloch, NL; Carroll, WR; Rosenthal, EL; Desmond, RA; Magnuson, JS (novembro de 2011). "Resultados funcionais percebidos pelo paciente e objetivos após cirurgia robótica transoral para carcinoma orofaríngeo precoce" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 137 (11): 1112–6. doi : 10.1001 / archoto.2011.172 . PMID 22106235 .
- Steiner, Wolfgang; Fierek, Oliver; Ambrosch, Petra; Hommerich, Christian P .; Kron, Martina (1 de janeiro de 2003). "Microcirurgia Transoral a Laser para Carcinoma de Células Escamosas da Base da Língua" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 129 (1): 36–43. doi : 10.1001 / archotol.129.1.36 . PMID 12525192 .
- Walvekar, Rohan R .; Li, Ryan J .; Gooding, William E .; Gibson, Michael K .; Heron, Dwight; Johnson, Jonas T .; Ferris, Robert L. (dezembro de 2008). "Papel da cirurgia em cânceres limitados (T1-2, N0-1) da orofaringe". O laringoscópio . 118 (12): 2129–2134. doi : 10.1097 / MLG.0b013e3181857950 . PMID 18948826 . S2CID 8072424 .
- Weinstein, Gregory S .; O'Malley, Bert W .; Magnuson, J. Scott; Carroll, William R .; Olsen, Kerry D .; Daio, Lixia; Moore, Eric J .; Holsinger, F. Christopher (agosto de 2012). "Cirurgia robótica transoral: Um estudo multicêntrico para avaliar a viabilidade, segurança e margens cirúrgicas". O laringoscópio . 122 (8): 1701-1707. doi : 10.1002 / lary.23294 . PMID 22752997 . S2CID 30048884 .
- White, Hilliary N .; Moore, Eric J .; Rosenthal, Eben L .; Carroll, William R .; Olsen, Kerry D .; Desmond, Reneé A .; Magnuson, J. Scott (20 de dezembro de 2010). "Cirurgia assistida por robô transoral para carcinoma de células escamosas de cabeça e pescoço" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 136 (12): 1248–52. doi : 10.1001 / archoto.2010.216 . PMID 21173375 .
- Woolgar, Julia Anne; Triantafyllou, Asterios (novembro de 2005). "Uma avaliação histopatológica das margens cirúrgicas em espécimes de ressecção de câncer oral e orofaríngeo". Oncologia Oral . 41 (10): 1034–1043. doi : 10.1016 / j.oraloncology.2005.06.008 . PMID 16129652 .
Radiação
- Adelstein, David J .; Li, Yi; Adams, George L .; Wagner, Henry; Kish, Julie A .; Ensley, John F .; Schuller, David E .; Forastiere, Arlene A. (janeiro de 2003). "Uma comparação de fase III entre grupos de terapia de radiação padrão e duas programações de quimiorradioterapia simultânea em pacientes com câncer de cabeça e pescoço de células escamosas irressecáveis". Journal of Clinical Oncology . 21 (1): 92–98. doi : 10.1200 / JCO.2003.01.008 . PMID 12506176 .
- Al-Mamgani, Abrahim; van Rooij, Peter; Verduijn, Gerda M .; Mehilal, Robert; Kerrebijn, Jeroen D .; Levendag, Peter C. (fevereiro de 2013). "O impacto da modalidade de tratamento e da técnica de radiação nos resultados e na toxicidade de pacientes com câncer orofaríngeo localmente avançado". O laringoscópio . 123 (2): 386–393. doi : 10.1002 / lary.23699 . PMID 23404489 . S2CID 37351159 .
- Bedi, Meena; Firat, Selim; Semenenko, Vladimir A .; Schultz, Christopher; Tripp, Patrick; Byhardt, Roger; Wang, Dian (maio de 2012). "Irradiação eletiva de linfonodo com radioterapia modulada por intensidade: o fracionamento de dose convencional é necessário?". International Journal of Radiation Oncology, Biology, Physics . 83 (1): e87 – e92. doi : 10.1016 / j.ijrobp.2011.12.016 . PMID 22516389 .
- Beitler, Jonathan J .; Zhang, Qiang; Fu, Karen K .; Trotti, Andy; Spencer, Sharon A .; Jones, Christopher U .; Garden, Adam S .; Shenouda, George; Harris, Jonathan; Ang, Kian K. (maio de 2014). "Resultados Finais de Controle Local-Regional e Toxicidade Tardia de RTOG 9003: Um Ensaio Randomizado de Radiação de Fracionamento Alterada para Câncer de Cabeça e Pescoço Localmente Avançado" . International Journal of Radiation Oncology, Biology, Physics . 89 (1): 13–20. doi : 10.1016 / j.ijrobp.2013.12.027 . PMC 4664465 . PMID 24613816 .
- Bourhis, Jean; Overgaard, Jens; Audry, Hélène; et al. (Setembro de 2006). "Radioterapia hiperfracionada ou acelerada no câncer de cabeça e pescoço: uma meta-análise". The Lancet . 368 (9538): 843–854. doi : 10.1016 / S0140-6736 (06) 69121-6 . PMID 16950362 . S2CID 20670949 .
- Caudell, Jimmy J .; Schaner, Philip E .; Desmond, Renee A .; Meredith, Ruby F .; Spencer, Sharon A .; Bonner, James A. (fevereiro de 2010). "Fatores dosimétricos associados à disfagia de longo prazo após radioterapia definitiva para carcinoma de células escamosas de cabeça e pescoço". International Journal of Radiation Oncology, Biology, Physics . 76 (2): 403–409. doi : 10.1016 / j.ijrobp.2009.02.017 . PMID 19467801 .
- Chen, Allen M .; Li, Judy; Beckett, Laurel A .; Zhara, Talia; Farwell, Gregory; Lau, Derick H .; Gandour-Edwards, Regina; Vaughan, Andrew T .; Purdy, James A. (janeiro de 2013). "Taxas de resposta diferencial à irradiação entre pacientes com câncer orofaríngeo positivo e negativo do papilomavírus humano". O laringoscópio . 123 (1): 152-157. doi : 10.1002 / lary.23570 . PMID 23008061 . S2CID 5106261 .
- Queixo, Re-I; Spencer, Christopher R .; DeWees, Todd; et al. (Novembro de 2016). "Reavaliação da dose de radiação pós-operatória na gestão do câncer orofaríngeo positivo para papilomavírus humano". Cabeça e pescoço . 38 (11): 1643–1649. doi : 10.1002 / hed.24486 . PMID 27152851 . S2CID 3577182 .
- Cramer, John David; Ferris, Robert L .; Duvvuri, Umamaheswar (20 de maio de 2018). "Desintensificação do tratamento para cirurgia apenas para câncer orofaríngeo associado ao papilomavírus humano estágio I". Journal of Clinical Oncology . 36 (suplemento 15): 6003. doi : 10.1200 / JCO.2018.36.15_suppl.6003 .
- Daly, Megan E .; Le, Quynh-Thu; Maxim, Peter G .; Loo, Billy W .; Kaplan, Michael J .; Fischbein, Nancy J .; Pinto, Harlan; Chang, Daniel T. (abril de 2010). "Radioterapia com intensidade modulada no tratamento do câncer orofaríngeo: resultados clínicos e padrões de falha". International Journal of Radiation Oncology, Biology, Physics . 76 (5): 1339–1346. doi : 10.1016 / j.ijrobp.2009.04.006 . PMID 19540068 .
- Deasy, Joseph O .; Moiseenko, Vitali; Marks, Lawrence; Chao, KS Clifford; Nam, Jiho; Eisbruch, Avraham (março de 2010). "Radiotherapy Dose – Volume Effects on Salivary Gland Function" . International Journal of Radiation Oncology, Biology, Physics . 76 (3): S58 – S63. doi : 10.1016 / j.ijrobp.2009.06.090 . PMC 4041494 . PMID 20171519 .
- Dok, Rüveyda; Kalev, Peter; Van Limbergen, Evert Jan; Asbagh, Layka Abbasi; Vázquez, Iria; Hauben, Esther; Sablina, Anna; Nuyts, Sandra (15 de março de 2014). "p16INK4a Impairs Homologous Recombination – Mediated DNA Repair in Human Papillomavirus – Positive Head and Neck Tumors" . Cancer Research . 74 (6): 1739–1751. doi : 10.1158 / 0008-5472.CAN-13-2479 . PMID 24473065 .
- Feng, Felix Y .; Kim, Hyungjin M .; Lyden, Teresa H .; Haxer, Marc J .; Feng, Mary; Worden, Frank P .; Chepeha, Douglas B .; Eisbruch, Avraham (agosto de 2007). "Radioterapia modulada por intensidade do câncer de cabeça e pescoço com o objetivo de reduzir a disfagia: relações iniciais de dose-efeito para as estruturas de deglutição". International Journal of Radiation Oncology, Biology, Physics . 68 (5): 1289–1298. doi : 10.1016 / j.ijrobp.2007.02.049 . PMID 17560051 .
- Forastiere, Arlene A .; Zhang, Qiang; Weber, Randal S .; et al. (Março de 2013). "Resultados de longo prazo de RTOG 91-11: Uma comparação de três estratégias de tratamento não cirúrgico para preservar a laringe em pacientes com câncer de laringe localmente avançado" . Journal of Clinical Oncology . 31 (7): 845–852. doi : 10.1200 / JCO.2012.43.6097 . PMC 3577950 . PMID 23182993 .
- Fu, Karen K .; Pajak, Thomas F .; Trotti, Andy; Jones, Christopher U .; Spencer, Sharon A .; Phillips, Theodore L .; Garden, Adam S .; Ridge, John A .; Cooper, Jay S .; Ang, K.Kian (agosto de 2000). "Um estudo randomizado de fase III do grupo de radioterapia oncológica (RTOG) para comparar o hiperfracionamento e duas variantes do fracionamento acelerado à radioterapia de fracionamento padrão para carcinomas de células escamosas de cabeça e pescoço: primeiro relato do RTOG 9003". International Journal of Radiation Oncology, Biology, Physics . 48 (1): 7–16. doi : 10.1016 / S0360-3016 (00) 00663-5 . PMID 10924966 .
- Garden, Adam S .; Dong, Lei; Morrison, William H .; et al. (Março de 2013). "Padrões de recorrência de doença após tratamento de câncer orofaríngeo com terapia de radiação modulada de intensidade". International Journal of Radiation Oncology, Biology, Physics . 85 (4): 941–947. doi : 10.1016 / j.ijrobp.2012.08.004 . PMID 22975604 .
- Heymach, John; Krilov, Lada; Alberg, Anthony; Baxter, Nancy; Chang, Susan Marina; Corcoran, Ryan B .; Dale, William; DeMichele, Angela; Magid Diefenbach, Catherine S .; Dreicer, Robert; Epstein, Andrew S .; Gillison, Maura L .; Graham, David L .; Jones, Joshua; Ko, Andrew H .; Lopez, Ana Maria; Maki, Robert G .; Rodriguez-Galindo, Carlos; Schilsky, Richard L .; Sznol, Mario; Westin, Shannon Neville; Burstein, Harold (abril de 2018). "Clinical Cancer Advances 2018: Relatório Anual sobre o Progresso Contra o Câncer da Sociedade Americana de Oncologia Clínica". Journal of Clinical Oncology . 36 (10): 1020–1044. doi : 10.1200 / JCO.2017.77.0446 . PMID 29380678 .
- Kramer, Simon; Gelber, Richard D .; Snow, James B .; Marcial, Victor A .; Lowry, Louis D .; Davis, Lawrence W .; Chandler, Richard (setembro de 1987). "Radioterapia e cirurgia combinadas no tratamento do câncer avançado de cabeça e pescoço: Relatório final do estudo 73-03 do grupo de oncologia da radioterapia". Cirurgia de Cabeça e Pescoço . 10 (1): 19–30. doi : 10.1002 / hed.2890100105 . PMID 3449477 .
- Langendijk, Johannes A .; Doornaert, Patricia; Verdonck-de Leeuw, Irma M .; Leemans, Charles R .; Aaronson, Neil K .; Slotman, Ben J. (agosto de 2008). "Impacto da toxicidade relacionada ao tratamento tardio na qualidade de vida entre pacientes com câncer de cabeça e pescoço tratados com radioterapia". Journal of Clinical Oncology . 26 (22): 3770–3776. doi : 10.1200 / JCO.2007.14.6647 . PMID 18669465 .
- Levendag, Peter C .; Teguh, David N .; Voet, Peter; et al. (Outubro de 2007). "Os distúrbios da disfagia em pacientes com câncer de orofaringe são significativamente afetados pela dose da radioterapia no músculo constritor superior e médio: uma relação dose-efeito". Radioterapia e Oncologia . 85 (1): 64–73. doi : 10.1016 / j.radonc.2007.07.009 . PMID 17714815 .
- Li, Baoqing; Li, Dan; Lau, Derick H; Farwell, D Gregory; Luu, Quang; Rocke, David M; Newman, Kathleen; Courquin, Jean; Purdy, James A; Chen, Allen M (2009). "Análise clínica-dosimétrica de medidas de disfagia, incluindo dependência de tubo de gastrostomia entre pacientes com câncer de cabeça e pescoço tratados definitivamente por radioterapia modulada em intensidade com quimioterapia concomitante" . Radiation Oncology . 4 (1): 52. doi : 10.1186 / 1748-717X-4-52 . PMC 2785826 . PMID 19909531 .
- Maccomb, WS; Fletcher, GH (março de 1957). "Combinação planejada de cirurgia e radiação no tratamento de cânceres primários avançados de cabeça e pescoço". The American Journal of Roentgenology, Radium Therapy, and Nuclear Medicine . 77 (3): 397–414. PMID 13403033 .
- Monroe, Marcus M .; Buchmann, Luke O .; Hunt, Jason P .; Hitchcock, Ying J .; Lloyd, Shane; Hashibe, Mia (abril de 2017). "O benefício da radiação adjuvante no carcinoma de células escamosas da orofaringe T1-2 N1 tratado cirurgicamente" . Laryngoscope Investigative Otolaryngology . 2 (2): 57–62. doi : 10.1002 / lio2.64 . PMC 5527368 . PMID 28894823 .
- O'Sullivan, B; Warde, P; Grice, B; Goh, C; Payne, D; Liu, F.-F; Waldron, J; Bayley, A; Irlandês, J; Gullane, P; Cummings, B (outubro de 2001). "Os benefícios e as armadilhas da radioterapia ipsilateral no carcinoma da região tonsilar". International Journal of Radiation Oncology, Biology, Physics . 51 (2): 332–343. doi : 10.1016 / S0360-3016 (01) 01613-3 . PMID 11567806 .
- Parsons, James T .; Mendenhall, William M .; Stringer, Scott P .; et al. (1 de junho de 2002). "Carcinoma de células escamosas da orofaringe: cirurgia, radioterapia ou ambos" . Câncer . 94 (11): 2967–2980. doi : 10.1002 / cncr.10567 . PMID 12115386 . S2CID 34438428 .
- Peters, Lester J; Goepfert, Helmuth; Ang, K.Kian; et al. (Abril de 1993). Avaliação da dose de radioterapia pós-operatória de câncer de cabeça e pescoço: primeiro relatório de um estudo prospectivo randomizado ". International Journal of Radiation Oncology, Biology, Physics . 26 (1): 3–11. doi : 10.1016 / 0360-3016 (93) 90167-T . PMID 8482629 .
- Rich, Jason T .; Milov, Simon; Lewis, James S .; Thorstad, Wade L .; Adkins, Douglas R .; Haughey, Bruce H. (setembro de 2009). "Microcirurgia transoral a laser (TLM) ± terapia adjuvante para câncer orofaríngeo em estágio avançado" . O laringoscópio . 119 (9): 1709–1719. doi : 10.1002 / lary.20552 . PMC 3877921 . PMID 19572271 .
- Robin, Tyler P .; Gan, Gregory N.; Tam, Moisés; Westerly, David; Riaz, Nadeem; Karam, Sana D .; Lee, Nancy; Raben, David (abril de 2016). "Segurança da glândula submandibular contralateral poupando em cânceres orofaríngeos localmente avançados: Uma revisão multicêntrica". Cabeça e pescoço . 38 (4): 506–511. doi : 10.1002 / hed.23928 . PMID 25482748 . S2CID 2317606 .
- Rosenthal, David I .; Mohamed, Abdallah SR; Garden, Adam S .; Morrison, William H .; El-Naggar, Adel K .; Kamal, Mona; Weber, Randal S .; Fuller, Clifton D .; Peters, Lester J. (agosto de 2017). "Relatório final de um estudo prospectivo randomizado para avaliar a relação dose-resposta para radioterapia pós-operatória e grupos de risco patológico em pacientes com câncer de cabeça e pescoço" . International Journal of Radiation Oncology, Biology, Physics . 98 (5): 1002–1011. doi : 10.1016 / j.ijrobp.2017.02.218 . PMC 5518636 . PMID 28721881 .
- Sher, David J .; Adelstein, David J .; Bajaj, Gopal K .; et al. (Julho de 2017). "Radioterapia para carcinoma de células escamosas da orofaringe: Resumo executivo de um ASTRO Evidence-Based Clinical Practice Guideline" . Oncologia de Radiação Prática . 7 (4): 246–253. doi : 10.1016 / j.prro.2017.02.002 . PMID 28428019 .
- Tsai, Chiaojung Jillian; Jackson, Andrew; Setton, Jeremy; Riaz, Nadeem; McBride, Sean; Leeman, Jonathan; Kowalski, Alex; Happersett, Laura; Lee, Nancy Y. (novembro de 2017). "Modelagem de resposta à dose para disfagia tardia em pacientes com câncer de cabeça e pescoço na era moderna de quimiorradiação definitiva" . JCO Clinical Cancer Informatics . 1 (1): 1–7. doi : 10.1200 / cci.17.00070 . PMC 6873915 . PMID 30657398 .
- Vikram, Bhadrasain; Strong, Elliot W .; Shah, Jatin P .; Spiro, Ronald (janeiro de 1984). "Falha no local primário após tratamento multimodal em câncer avançado de cabeça e pescoço". Cirurgia de Cabeça e Pescoço . 6 (3): 720–723. doi : 10.1002 / hed.2890060303 . PMID 6693287 .
- Tupchong, Leslie; Phil, D .; Scott, Charles B .; et al. (Janeiro de 1991). "Estudo randomizado de radioterapia pré-operatória versus pós-operatória em carcinoma avançado de cabeça e pescoço: acompanhamento de longo prazo do estudo RTOG 73-03". International Journal of Radiation Oncology, Biology, Physics . 20 (1): 21–28. doi : 10.1016 / 0360-3016 (91) 90133-O . PMID 1993628 .
- Woody, Neil M .; Koyfman, Shlomo A .; Xia, Ping; et al. (Fevereiro de 2016). “O controle regional é preservado após a redução da dose de radioterapia para linfonodos envolvidos no câncer orofaríngeo positivo para HPV”. Oncologia Oral . 53 : 91–96. doi : 10.1016 / j.oraloncology.2015.11.004 . PMID 26711089 .
Quimioterapia e quimiorradiação
- Ang, K. Kian; Zhang, Qiang; Rosenthal, David I .; et al. (20 de setembro de 2014). "Ensaio de Fase III Randomizado de Radiação Acelerada Simultânea Mais Cisplatina com ou Sem Cetuximabe para Carcinoma de Cabeça e Pescoço em Estágio III a IV: RTOG 0522" . Journal of Clinical Oncology . 32 (27): 2940–2950. doi : 10.1200 / JCO.2013.53.5633 . PMC 4162493 . PMID 25154822 .
- Bachaud, Jean-Marc; Cohen-Jonathan, Elizabeth; Alzieu, Claude; David, Jean-Marc; Serrano, Elie; Daly-Schveitzer, Nicolas (dezembro de 1996). "Radioterapia pós-operatória combinada e infusão semanal de cisplatina para carcinoma de cabeça e pescoço avançado localmente: Relatório final de um ensaio clínico randomizado". International Journal of Radiation Oncology, Biology, Physics . 36 (5): 999–1004. doi : 10.1016 / S0360-3016 (96) 00430-0 . PMID 8985019 .
- Bernier, Jacques; Domenge, cristão; Ozsahin, Mahmut; et al. (6 de maio de 2004). "Irradiação pós-operatória com ou sem quimioterapia concomitante para câncer de cabeça e pescoço localmente avançado". New England Journal of Medicine . 350 (19): 1945–1952. doi : 10.1056 / NEJMoa032641 . PMID 15128894 .
- Bernier, Jacques; Cooper, Jay S .; Pajak, TF; et al. (Outubro de 2005). "Definindo os níveis de risco em cânceres de cabeça e pescoço localmente avançados: Uma análise comparativa da radiação pós-operatória simultânea mais os ensaios de quimioterapia do EORTC (# 22931) e RTOG (# 9501)". Cabeça e pescoço . 27 (10): 843–850. doi : 10.1002 / hed.20279 . PMID 16161069 . S2CID 13746453 .
- Blanchard, Pierre; Baujat, Bertrand; Holostenco, Victoria; Bourredjem, Abderrahmane; Baey, Charlotte; Bourhis, Jean; Pignon, Jean-Pierre (julho de 2011). "Meta-análise da quimioterapia no câncer de cabeça e pescoço (MACH-NC): Uma análise abrangente por local do tumor". Radioterapia e Oncologia . 100 (1): 33–40. doi : 10.1016 / j.radonc.2011.05.036 . PMID 21684027 .
- Bonner, James A; Harari, Paul M; Giralt, Jordi; et al. (Janeiro de 2010). "Radioterapia mais cetuximabe para câncer de cabeça e pescoço avançado loco-regional: dados de sobrevida de 5 anos de um estudo randomizado de fase 3 e relação entre erupção cutânea induzida por cetuximabe e sobrevida". The Lancet Oncology . 11 (1): 21–28. doi : 10.1016 / S1470-2045 (09) 70311-0 . PMID 19897418 .
- Calais, Gilles; Bardet, Etienne; Senhor, cristão; Alfonsi, Marc; Bourhis, Jean; Rhein, Béatrix; Tortochaux, Jacques; Cara, Yooye Tao Kong; Auvray, Hugues; Garaud, Pascal (janeiro de 2004). "Radioterapia com docetaxel semanal concomitante para carcinoma de orofaringe em estágios III / IV. Resultados do ensaio de Fase II de GORTEC 98-02". International Journal of Radiation Oncology, Biology, Physics . 58 (1): 161–166. doi : 10.1016 / S0360-3016 (03) 01370-1 . PMID 14697434 .
- Chen, Allen M; Felix, Carol; Wang, Pin-Chieh; et al. (Junho de 2017). "Radioterapia de dose reduzida para carcinoma de células escamosas associado ao papilomavírus humano da orofaringe: um estudo de fase 2 de braço único" . The Lancet Oncology (manuscrito submetido). 18 (6): 803–811. doi : 10.1016 / S1470-2045 (17) 30246-2 . PMC 6488353 . PMID 28434660 .
- Chera, Bhishamjit S .; Amdur, Robert J .; Tepper, Joel; et al. (Dezembro de 2015). "Teste de Fase 2 de Terapia de Quimioradiação Desintensificada para Carcinoma de Célula Escamosa Orofaríngea Associado ao Papilomavírus Humano de Risco Favorável". International Journal of Radiation Oncology, Biology, Physics . 93 (5): 976–985. doi : 10.1016 / j.ijrobp.2015.08.033 . PMID 26581135 .
- Cmelak, Anthony J .; Li, Sigui; Goldwasser, Meredith A .; Murphy, Barbara; Cannon, Michael; Pinto, Harlan; Rosenthal, David I .; Gillison, Maura; Forastiere, Arlene A. (setembro de 2007). "Fase II Trial of Chemoradiation for Organ Preservation in Resectable Stage III ou IV Squamous Cell Carcinomas of the Larynx or Oropharynx: Results of Eastern Cooperative Oncology Group Study E2399". Journal of Clinical Oncology . 25 (25): 3971–3977. doi : 10.1200 / JCO.2007.10.8951 . PMID 17761982 .
- Cohen, EE; Karrison, TG; Kocherginsky, M; et al. (1 de setembro de 2014). "Ensaio randomizado de fase III de quimioterapia de indução em pacientes com câncer de cabeça e pescoço N2 ou N3 localmente avançado" . Journal of Clinical Oncology . 32 (25): 2735–43. doi : 10.1200 / JCO.2013.54.6309 . PMC 4876357 . PMID 25049329 .
- Cooper, Jay S .; Pajak, Thomas F .; Forastiere, Arlene A .; et al. (6 de maio de 2004). "Radioterapia simultânea pós-operatória e quimioterapia para carcinoma de células escamosas de alto risco da cabeça e pescoço". New England Journal of Medicine . 350 (19): 1937–1944. doi : 10.1056 / NEJMoa032646 . PMID 15128893 .
- Cooper, Jay S .; Zhang, Qiang; Pajak, Thomas F .; et al. (Dezembro 2012). "Long-term Follow-up of the RTOG 9501 / Intergroup Phase III Trial: Pós-operatório Concurrent Radiation Therapy and Chemotherapy in High-Risk Squamous Cell Carcinoma of the Head and Neck" . International Journal of Radiation Oncology, Biology, Physics . 84 (5): 1198–1205. doi : 10.1016 / j.ijrobp.2012.05.008 . PMC 3465463 . PMID 22749632 .
- Diaz, Roberto; Jaboin, Jerry J .; Morales-Paliza, Manuel; et al. (Junho de 2010). Hipothyroidism as a Consequence of Intensity-Modulated Radiotherapy With Concurrent Taxane-Based Chemotherapy for Locally Advanced Head-and-Neck Cancer ". International Journal of Radiation Oncology, Biology, Physics . 77 (2): 468–476. doi : 10.1016 / j.ijrobp.2009.05.018 . PMID 19577867 .
- Eisbruch, Avraham; Schwartz, Marco; Rasch, Coen; Vineberg, Karen; Damen, Eugene; Van As, Corina J .; Marsh, Robin; Pameijer, Frank A .; Balm, Alfons JM (dezembro de 2004). "Disfagia e aspiração após quimiorradioterapia para câncer de cabeça e pescoço: quais estruturas anatômicas são afetadas e podem ser poupadas por IMRT?". International Journal of Radiation Oncology, Biology, Physics . 60 (5): 1425–1439. doi : 10.1016 / j.ijrobp.2004.05.050 . PMID 15590174 .
- Eriksen, JG; Lassen, P .; Overgaard, J. (2010). “Todos os pacientes com câncer de cabeça e pescoço se beneficiam de radioterapia e cetuximabe concomitante?”. The Lancet Oncology . 11 (4): 312–313. doi : 10.1016 / S1470-2045 (10) 70035-8 . PMID 20359659 .
- Givens, Daniel J .; Karnell, Lucy Hynds; Gupta, Anjali K .; Clamon, Gerald H .; Pagedar, Nitin A .; Chang, Kristi E .; Van Daele, Douglas J .; Funk, Gerry F. (21 de dezembro de 2009). "Eventos adversos associados à terapia de quimiorradiação simultânea em pacientes com câncer de cabeça e pescoço" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 135 (12): 1209–17. doi : 10.1001 / archoto.2009.174 . PMID 20026818 .
- Haddad, R; O'Neill, A; Rabinowits, G; et al. (Março de 2013). “Quimioterapia de indução seguida por quimiorradioterapia concomitante (quimiorradioterapia sequencial) versus quimiorradioterapia concomitante sozinha em câncer de cabeça e pescoço localmente avançado (PARADIGM): um ensaio randomizado de fase 3”. The Lancet Oncology . 14 (3): 257–64. doi : 10.1016 / S1470-2045 (13) 70011-1 . PMID 23414589 .
- Hall, SF; Irlandês, JC; Gregg, RW; Groome, PA; Rohland, S. (8 de janeiro de 2015). "Aderência e compreensão das diretrizes de prática clínica: lições aprendidas de uma diretriz de prática clínica sobre quimioterapia concomitante com radioterapia no câncer de cabeça e pescoço" . Oncologia atual . 22 (2): e61–8. doi : 10.3747 / co.22.2235 . PMC 4399625 . PMID 25908922 .
- Hall, Stephen F; Liu, Fei-Fei; O'Sullivan, Brian; Shi, Willa; Rohland, Susan; Griffiths, Rebecca; Groome, Patti (22 de agosto de 2017). “A adição de quimioterapia concomitante à radioterapia convencional melhorou a sobrevida de pacientes com HPV + ve e HPV-ve câncer de orofaringe? Um estudo de base populacional” . British Journal of Cancer . 117 (8): 1105–1112. doi : 10.1038 / bjc.2017.275 . PMC 5674099 . PMID 28829763 .
- Hunter, Klaudia U .; Schipper, Matthew; Feng, Felix Y .; Lyden, Teresa; Haxer, Mark; Murdoch-Kinch, Carol-Anne; Cornwall, Benjamin; Lee, Connie SY; Chepeha, Douglas B .; Eisbruch, Avraham (março de 2013). "Toxicidades que afetam a qualidade de vida após quimio-IMRT de câncer orofaríngeo: estudo prospectivo de resultados relatados pelo paciente, avaliados pelo observador e objetivos" . International Journal of Radiation Oncology, Biology, Physics . 85 (4): 935–940. doi : 10.1016 / j.ijrobp.2012.08.030 . PMC 3556374 . PMID 23040224 .
- Machtay, Mitchell; Moughan, Jennifer; Trotti, Andrew; Garden, Adam S .; Weber, Randal S .; Cooper, Jay S .; Forastiere, Arlene; Ang, K. Kian (20 de julho de 2008). Fatores associados com toxicidade tardia severa após quimioradiação simultânea para câncer de cabeça e pescoço localmente avançado: uma análise de RTOG " . Journal of Clinical Oncology . 26 (21): 3582–3589. doi : 10.1200 / JCO.2007.14.8841 . PMC 4911537 . PMID 18559875 .
- Marur, Shanthi; Li, Shuli; Cmelak, Anthony J .; et al. (10 de fevereiro de 2017). "E1308: Ensaio de Fase II de Quimioterapia de Indução Seguido por Radiação de Dose Reduzida e Cetuximabe Semanal em Pacientes com Carcinoma de Célula Escamosa Ressecável Associado ao HPV da Orofaringe - ECOG-ACRIN Cancer Research Group" . Journal of Clinical Oncology . 35 (5): 490–497. doi : 10.1200 / JCO.2016.68.3300 . PMC 5455313 . PMID 28029303 .
- Nguyen-Tan, Phuc Felix; Zhang, Qiang; Ang, K. Kian; et al. (Dezembro de 2014). "Randomized Fase III Trial to Test Accelerated Versus Standard Fractionation in Combination With Concurrent Cisplatin for Head and Neck Carcinomas in the Radiation Therapy Oncology Group 0129 Trial: Long-Term Report of Efficacy and Toxicity" . Journal of Clinical Oncology . 32 (34): 3858–3867. doi : 10.1200 / JCO.2014.55.3925 . PMC 4239304 . PMID 25366680 .
- Olson, Brennan; Clayburgh, Daniel R (30 de agosto de 2017). Utilidade da terapia adjuvante para carcinoma de orofaringe pN1 . Apresentações orais. Reunião Anual da American Academy of Otolaryngology, Chicago, de 10 a 13 de setembro de 2017. Otolaryngology – Head and Neck Surgery . 157 (1 suplemento). pp. P40 – P173. doi : 10.1177 / 0194599817717251d . PMID 28854010 .
- Owadally, Waheeda; Machucado, Chris; Timmins, Hayley; et al. (27 de agosto de 2015). "PATHOS: um ensaio de fase II / III de tratamento adjuvante estratificado de risco, de intensidade reduzida em pacientes submetidos à cirurgia transoral para câncer orofaríngeo positivo para papilomavírus humano (HPV)" . BMC Cancer . 15 (1): 602. doi : 10.1186 / s12885-015-1598-x . PMC 4549836 . PMID 26311526 .
- Pignon, Jean-Pierre; le Maître, Aurélie; Bourhis, Jean (outubro de 2007). "Meta-análises de quimioterapia em câncer de cabeça e pescoço (MACH-NC): uma atualização". International Journal of Radiation Oncology, Biology, Physics . 69 (2): S112 – S114. doi : 10.1016 / j.ijrobp.2007.04.088 . PMID 17848275 .
- Posner, MR; Lorch, JH; Goloubeva, O .; Tan, M .; Schumaker, LM; Sarlis, NJ; Haddad, RI; Cullen, KJ (maio de 2011). "Sobrevivência e vírus do papiloma humano no câncer de orofaringe no TAX 324: uma análise de subconjunto de um ensaio internacional de fase III" . Annals of Oncology . 22 (5): 1071–1077. doi : 10.1093 / annonc / mdr006 . PMC 4351352 . PMID 21317223 .
- Seiwert, T .; Melotek, JM; Foster, CC; Blair, EA; Karrison, TG; Agrawal, N .; Portugal, L .; Gooi, Z .; Stenson, KM; Brisson, RJ; Arshad, S .; Dekker, A .; Kochanny, S .; Saloura, V .; Spiotto, MT; Villaflor, VM; Haraf, DJ; Vokes, EE (abril de 2018). "OPTIMA-A Fase 2 Trial of Induction Chemotherapy Response-Stratified Radiation Therapy Dose and Volume De-Escalation for HPV + Oropharyngeal Cancer: Efficacy, Toxicity, and HPV Subtype Analysis" . International Journal of Radiation Oncology, Biology, Physics . 100 (5): 1309. doi : 10.1016 / j.ijrobp.2017.12.025 .
- Su, William; Liu, Jerry; Miles, Brett A .; Genden, Eric M .; Misiukiewicz, Krzysztof J .; Posner, Marshall; Gupta, Vishal; Bakst, Richard L .; Chu, Pei-Yi (8 de dezembro de 2016). "Terapia de radiação adjuvante sozinha para câncer orofaríngeo relacionado ao HPV com características de alto risco" . PLOS One . 11 (12): e0168061. Bibcode : 2016PLoSO..1168061S . doi : 10.1371 / journal.pone.0168061 . PMC 5145232 . PMID 27930732 .
- Szturz, Petr; Seiwert, Tanguy Y .; Vermorken, Jan B. (10 de julho de 2017). "Qual é o padrão do cetuximabe de segunda linha no câncer recorrente ou metastático de cabeça e pescoço em 2017?". Journal of Clinical Oncology . 35 (20): 2229–2231. doi : 10.1200 / JCO.2016.71.8072 . PMID 28471725 .
- Vlacich, Gregory; Spratt, Daniel E .; Diaz, Roberto; Phillips, John G .; Crass, Jostin; Li, Chung-I; Shyr, Yu; Cmelak, Anthony J. (março de 2014). "A dose para o constritor inferior da faringe prevê dependência prolongada do tubo de gastrostomia com radioterapia e quimioterapia com intensidade modulada concomitantes para câncer de cabeça e pescoço localmente avançado". Radioterapia e Oncologia . 110 (3): 435–440. doi : 10.1016 / j.radonc.2013.12.007 . PMID 24440043 .
- Wirth, Lori J. (20 de abril de 2016). "Cetuximab no Papilomavírus Humano? Carcinoma de Orofaringe Positivo". Journal of Clinical Oncology . 34 (12): 1289–1291. doi : 10.1200 / JCO.2015.65.1414 . PMID 26884569 .
Desintensificação
- An, Yi; Holsinger, F. Christopher; Husain, Zain A. (20 de dezembro de 2016). "Desintensificação da terapia adjuvante no câncer orofaríngeo associado ao papilomavírus humano" . Câncer de cabeça e pescoço (revisão). 1 (1): 18. doi : 10.1186 / s41199-016-0016-7 . PMC 6460758 . PMID 31093347 .
- Arnaoutakis, Demetri; Sumer, Baran D. (10 de agosto de 2017). "Tratamento de desintensificação para câncer orofaríngeo associado ao papilomavírus humano" . Annals of Surgical Oncology . 24 (12): 3463–3465. doi : 10.1245 / s10434-017-6045-6 . PMID 28799138 .
- Brotherston, Drew C .; Poon, Ian; Le, Tuyen; Leung, Martin; Beijo, Alex; Ringash, Jolie; Balogh, Judith; Lee, Justin; Wright, James R. (fevereiro de 2013). "Preferências do paciente para redução do tratamento do câncer orofaríngeo" . Cabeça e pescoço . 35 (2): 151–159. doi : 10.1002 / hed.22930 . PMID 22431201 . S2CID 30301638 .
- Chera, Bhishamjit S .; Amdur, Robert J. (janeiro de 2018). "Status atual e direções futuras de desintensificação do tratamento no carcinoma de células escamosas orofaríngeo associado ao vírus do papiloma humano". Seminars in Radiation Oncology . 28 (1): 27–34. doi : 10.1016 / j.semradonc.2017.08.001 . PMID 29173753 .
- Kelly, Jacqueline R .; Husain, Zain A .; Burtness, Barbara (novembro de 2016). "Estratégias de desintensificação do tratamento para o câncer de cabeça e pescoço" . European Journal of Cancer . 68 : 125–133. doi : 10.1016 / j.ejca.2016.09.006 . PMC 5734050 . PMID 27755996 .
- Ma, DJ; Price, K .; Moore, EJ; Patel, SH; Hinni, ML; Chintakuntlawar, AV; Garcia, JJ; Graner, D .; Neben-Wittich, MA; Garces, Y .; Hallemeier, CL; Preço, DL; Kasperbauer, JL; Janus, JR; Foster, NR; Foote, RL (dezembro de 2017). "Resultados de dois anos para MC1273, uma avaliação de fase 2 de desescalonamento de dose agressiva para quimiorradiação adjuvante em HPV + carcinoma de células escamosas de orofaringe (OPSCC)". International Journal of Radiation Oncology, Biology, Physics . 99 (5): 1320. doi : 10.1016 / j.ijrobp.2017.09.021 .
- Masterson, L; Moualed, D; Liu, ZW; et al. (Outubro de 2014). "Protocolos de tratamento de escalonamento para carcinoma de células escamosas da orofaringe associada ao papilomavírus humano: uma revisão sistemática e meta-análise dos ensaios clínicos atuais". European Journal of Cancer . 50 (15): 2636–48. doi : 10.1016 / j.ejca.2014.07.001 . PMID 25091798 .
- Mirghani, H .; Amém, F .; Blanchard, P .; Moreau, F .; Guigay, J .; Hartl, DM; Lacau St Guily, J. (abril de 2015). "Desescalonamento do tratamento no carcinoma orofaríngeo HPV-positivo: Ensaios em andamento, questões críticas e perspectivas" . International Journal of Cancer . 136 (7): 1494-1503. doi : 10.1002 / ijc.28847 . PMID 24622970 . S2CID 21854274 .
- Mirghani, Haitham; Blanchard, Pierre (janeiro de 2018). "Redução da escalada do tratamento para o câncer orofaríngeo causado pelo HPV: Onde estamos?" . Oncologia de radiação clínica e translacional . 8 : 4-11. doi : 10.1016 / j.ctro.2017.10.005 . PMC 5862680 . PMID 29594236 .
- Quon, Harry; Richmon, Jeremy D. (agosto de 2012). "Estratégias de Desintensificação de Tratamento para Carcinomas de Cabeça e Pescoço Associados ao HPV". Clínicas Otorrinolaringológicas da América do Norte . 45 (4): 845–861. doi : 10.1016 / j.otc.2012.04.007 . PMID 22793856 .
Prognóstico
- Al-Mamgani, Abrahim; van Werkhoven, Erik; Navran, Arash; Karakullukcu, Baris; Hamming-Vrieze, Olga; Machiels, Melanie; van der Velden, Lilly-Ann; Vogel, Wouter V .; Klop, W. Martin (setembro de 2017). "Recorrência regional contralateral após irradiação cervical unilateral eletiva em carcinoma orofaríngeo: uma revisão crítica baseada na literatura". Revisões do tratamento do câncer . 59 : 102–108. doi : 10.1016 / j.ctrv.2017.07.004 . PMID 28779635 .
- Ang, KK; Harris, J .; Wheeler, R .; et al. (2010). "Papilomavírus Humano e Sobrevivência de Pacientes com Câncer Orofaríngeo" . New England Journal of Medicine . 363 (1): 24–35. doi : 10.1056 / NEJMoa0912217 . PMC 2943767 . PMID 20530316 .
- Bhattasali, O .; Thompson, LD; Schumacher, A .; Iganej, S. (abril de 2018). "Fatores prognósticos radiográficos nodais no câncer orofaríngeo p16-positivo do novo estágio I da 8ª edição do AJCC: todas as doenças N1 são iguais?" . International Journal of Radiation Oncology, Biology, Physics . 99 (2): S137. doi : 10.1016 / j.ijrobp.2017.06.317 .
- Chernock, RD; El-mofty, SK; Thorstad, WL; Parvin, CA; Lewis, JS (2009). "Carcinoma de células escamosas não queratinizantes relacionadas ao HPV da orofaringe: utilidade das características microscópicas na previsão do resultado do paciente" . Patologia de Cabeça e Pescoço . 3 (3): 186–194. doi : 10.1007 / s12105-009-0126-1 . PMC 2811624 . PMID 20596971 .
- Fakhry, Carole; Zhang, Qiang; Nguyen-Tân, Phuc Felix; et al. (4 de agosto de 2017). "Desenvolvimento e validação de nomogramas preditivos de sobrevida geral e livre de progressão em pacientes com câncer orofaríngeo" . Journal of Clinical Oncology . 35 (36): 4057–4065. doi : 10.1200 / JCO.2016.72.0748 . PMC 5736236 . PMID 28777690 .
- Fischer, CA; Kampmann, M .; Zlobec, I .; Green, E .; Tornillo, L .; Lugli, A .; Wolfensberger, M .; Terracciano, LM (27 de abril de 2010). "Expressão de p16 no câncer orofaríngeo: seu impacto no estadiamento e prognóstico em comparação com os parâmetros de estadiamento clínico convencionais" (PDF) . Annals of Oncology . 21 (10): 1961–1966. doi : 10.1093 / annonc / mdq210 . PMID 20423915 .
- Gillison, Maura L. (20 de dezembro de 2006). "Human Papillomavirus and Prognosis of Oropharyngeal Squamous Cell Carcinoma: Implications for Clinical Research in Head and Neck Cancer". Journal of Clinical Oncology (Editorial). 24 (36): 5623–5625. doi : 10.1200 / JCO.2006.07.1829 . PMID 17179099 .
- Gillison, Maura L .; Zhang, Qiang; Jordan, Richard; Xiao, Weihong; Westra, William H .; Trotti, Andy; Spencer, Sharon; Harris, Jonathan; Chung, Christine H .; Ang, K. Kian (10 de junho de 2012). "Tabagismo e aumento do risco de morte e progressão para pacientes com câncer orofaríngeo p16-positivo e p16-negativo" . Journal of Clinical Oncology . 30 (17): 2102–2111. doi : 10.1200 / JCO.2011.38.4099 . PMC 3397696 . PMID 22565003 .
- Hafkamp, Harriët C .; Manni, JJ; Haesevoets, A .; Voogd, AC; Schepers, M .; Bot, FJ; Hopman, AHN; Ramaekers, FCS; Speel, Ernst-Jan M. (15 de junho de 2008). "Diferenças marcantes na taxa de sobrevivência entre fumantes e não fumantes com carcinomas tonsilares associados ao HPV 16" . International Journal of Cancer . 122 (12): 2656–2664. doi : 10.1002 / ijc.23458 . PMID 18360824 . S2CID 25320075 .
- Haughey, Bruce H .; Sinha, Parul (setembro de 2012). "Fatores prognósticos e sobrevida exclusivos para câncer orofaríngeo p16 + tratado cirurgicamente". O laringoscópio . 122 (S2): S13 – S33. doi : 10.1002 / lary.23493 . PMID 22926949 . S2CID 31772853 .
- Huang, Shao Hui; Waldron, John N .; Milosevic, Michael; et al. (15 de fevereiro de 2015). "Valor prognóstico do pré-tratamento de neutrófilos, monócitos e linfócitos circulantes no câncer orofaríngeo estratificado pelo status do papilomavírus humano" . Câncer . 121 (4): 545–555. doi : 10.1002 / cncr.29100 . PMID 25336438 . S2CID 926930 .
- Huang, K .; Banerjee, RN; Debenham, B .; Patel, A .; Sabiq, F .; Harold, L .; Skarsgard, DP; Lysack, J .; Ghosh, S .; Quon, HC (abril de 2018). "Qual é o problema com os nós emaranhados? Significado dos nós de linfa emaranhados no carcinoma de células escamosas orofaríngeo relacionado ao HPV: Um estudo de coorte baseado na população multi-institucional" . International Journal of Radiation Oncology, Biology, Physics . 100 (5): 1328. doi : 10.1016 / j.ijrobp.2017.12.059 .
- de Jong, MC; Pramana, J .; Knegjens, JL; Balm, AJM; Van Den Brekel, MWM; Hauptmann, M .; Begg, AC; Rasch, CRN (24 de março de 2010). "HPV e perfis de expressão gênica de alto risco predizem a resposta à quimiorradioterapia no câncer de cabeça e pescoço, independente de fatores clínicos". Radioterapia e Oncologia . 95 (3): 365–370. doi : 10.1016 / j.radonc.2010.02.001 . ISSN 1879-0887 . PMID 20346528 .
- Kato, Masanari G .; Ellis, Mark A .; Nguyen, Shaun A .; Day, Terry A. (fevereiro de 2018). "Predictors of contralateral-bilateral nodal disease in oropharyngeal cancer: A National Cancer Data Base Study". Cabeça e pescoço . 40 (2): 338–348. doi : 10.1002 / hed.24964 . PMID 28963823 . S2CID 10627950 .
- Lewis, James S; Carpenter, Danielle H; Thorstad, Wade L; Zhang, Qin; Haughey, Bruce H (24 de junho de 2011). "A extensão extracapsular é um mau preditor de recorrência da doença em carcinoma de células escamosas de orofaringe tratado cirurgicamente" . Patologia moderna . 24 (11): 1413–1420. doi : 10.1038 / modpathol.2011.105 . PMC 3925389 . PMID 21701534 .
- Licitra, Lisa; Perrone, Federica; Bossi, Paolo; et al. (20 de dezembro de 2006). "O papilomavírus humano de alto risco afeta o prognóstico em pacientes com carcinoma de células escamosas orofaríngeo tratado cirurgicamente". Journal of Clinical Oncology . 24 (36): 5630–5636. doi : 10.1200 / JCO.2005.04.6136 . PMID 17179101 .
- Lowy, D .; Munger, K. (2010). "Implicações prognósticas do HPV no câncer orofaríngeo" . The New England Journal of Medicine (Editorial). 363 (1): 82–84. doi : 10.1056 / NEJMe1003607 . PMID 20530315 .
- Martel, María; Alemany, Laia; Taberna, Miren; Mena, Marisa; Tous, Sara; Bagué, Silvia; Castellsagué, Xavier; Quer, Miquel; León, Xavier (janeiro de 2017). "O papel do HPV no risco de segunda neoplasia primária em pacientes com carcinoma orofaríngeo". Oncologia Oral . 64 : 37–43. doi : 10.1016 / j.oraloncology.2016.11.011 . PMID 28024722 .
- Maxwell, JH; Kumar, B .; Feng, FY; et al. (9 de fevereiro de 2010). "Uso de tabaco em pacientes com câncer de orofaringe avançado positivo para papilomavírus humano relacionado ao aumento do risco de metástases distantes e recorrência de tumor" . Clinical Cancer Research . 16 (4): 1226–1235. doi : 10.1158 / 1078-0432.CCR-09-2350 . PMC 2822887 . PMID 20145161 .
- Maxwell, Jessica H .; Ferris, Robert L .; Gooding, William; Cunningham, Diana; Mehta, Vikas; Kim, Seungwon; Myers, Eugene N .; Johnson, Jonas; Chiosea, Simion (setembro de 2013). "Extensão extracapsular no carcinoma de cabeça e pescoço: Impacto do local e status do papilomavírus humano". Câncer . 119 (18): 3302–3308. CiteSeerX 10.1.1.663.564 . doi : 10.1002 / cncr.28169 . PMID 23797868 . S2CID 32595866 .
- Nguyen, Nam P .; Ly, Bevan Hong; Betz, Michael; Vinh-Hung, Vincent (18 de junho de 2010). "Importance of Age as a Prognostic Factor for Tonsillar Carcinoma". Annals of Surgical Oncology . 17 (10): 2570–2577. doi : 10.1245 / s10434-010-1167-0 . PMID 20559738 . S2CID 8833627 .
- O'Sullivan, Brian; Huang, Shao Hui; Siu, Lillian L .; et al. (10 de fevereiro de 2013). "Subgrupos de candidatos à desintensificação em câncer orofaríngeo relacionado ao papilomavírus humano de acordo com o risco mínimo de metástase à distância". Journal of Clinical Oncology . 31 (5): 543–550. doi : 10.1200 / JCO.2012.44.0164 . PMID 23295795 .
- Ragin, Camille CR; Taioli, Emanuela (15 de outubro de 2007). "Sobrevivência do carcinoma de células escamosas da cabeça e pescoço em relação à infecção pelo papilomavírus humano: revisão e meta-análise" . International Journal of Cancer . 121 (8): 1813–1820. doi : 10.1002 / ijc.22851 . PMID 17546592 . S2CID 23657353 .
- Rischin, Danny; Young, Richard J .; Fisher, Richard; et al. (20 de setembro de 2010). "Prognostic Significance of p16INK4A and Human Papillomavirus in Do Oropharyngeal Cancer Treated on TROG 02.02 Phase III Trial" . Journal of Clinical Oncology . 28 (27): 4142–4148. doi : 10.1200 / JCO.2010.29.2904 . PMC 2953971 . PMID 20697079 .
- Routman, David M .; Funk, Ryan K .; Tangsriwong, Kanograt; et al. (Junho de 2017). "Taxas de recaída com cirurgia sozinha no câncer de células escamosas da orofaringe de grupo de alto risco e intermediário relacionado ao papilomavírus humano: uma revisão multi-institucional". International Journal of Radiation Oncology, Biology, Physics . 99 (4): 938–946. doi : 10.1016 / j.ijrobp.2017.06.2453 . PMID 28847412 .
- Sinha, Parul; Lewis, James S .; Piccirillo, Jay F .; Kallogjeri, Dorina; Haughey, Bruce H. (15 de julho de 2012). "Disseminação extracapsular e terapia adjuvante no carcinoma orofaríngeo p16-positivo relacionado ao papilomavírus humano". Câncer . 118 (14): 3519–3530. doi : 10.1002 / cncr.26671 . PMID 22086669 . S2CID 28111538 .
- Sinha, P .; Thorstad, WT; Nussenbaum, B .; Haughey, BH; Adkins, DR; Kallogjeri, D .; Lewis Jr., JS (janeiro de 2014). "Metástase à distância no carcinoma de células escamosas da orofaringe p16-positivo: Uma análise crítica de padrões e resultados" . Oncologia Oral . 50 (1): 45–51. doi : 10.1016 / j.oraloncology.2013.10.007 . PMC 3942323 . PMID 24211084 .
- Sinha, Parul; Kallogjeri, Dorina; Gay, Hiram; Thorstad, Wade L .; Lewis, James S .; Chernock, Rebecca; Nussenbaum, Brian; Haughey, Bruce H. (maio de 2015). "Alto número de nódulos metastáticos, não disseminação extracapsular ou classificação N é um prognosticador relacionado a nódulos em câncer de orofaringe positivo para p16 ressecado transoralmente e com pescoço dissecado". Oncologia Oral . 51 (5): 514–520. doi : 10.1016 / j.oraloncology.2015.02.098 . PMID 25771076 .
- Trosman, Samuel J .; Koyfman, Shlomo A .; Ward, Matthew C .; et al. (1 de maio de 2015). "Efeito do papilomavírus humano nos padrões de falha metastática distante no carcinoma de células escamosas da orofaringe tratada com quimioradioterapia" . JAMA Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 141 (5): 457–62. doi : 10.1001 / jamaoto.2015.136 . PMID 25742025 .
- Ward, MJ; Thirdborough, SM; Mellows, T; et al. (29 de outubro de 2013). "Linfócitos infiltrantes de tumor predizem o resultado em câncer orofaríngeo HPV-positivo" . British Journal of Cancer . 110 (2): 489–500. doi : 10.1038 / bjc.2013.639 . PMC 3899750 . PMID 24169344 .
Epidemiologia
- Anantharaman, Devasena; Muller, David C; Lagiou, Pagona; et al. (Junho de 2016). "Efeitos combinados do tabagismo e HPV16 no câncer orofaríngeo" . International Journal of Epidemiology . 45 (3): 752–761. doi : 10.1093 / ije / dyw069 . PMC 5841602 . PMID 27197530 .
- Chaturvedi, A .; Engels, E .; Anderson, W .; Gillison, M. (fevereiro de 2008). "Tendências de incidência de carcinomas de células escamosas orais relacionados e não relacionados ao papilomavírus humano nos Estados Unidos". Journal of Clinical Oncology . 26 (4): 612–619. doi : 10.1200 / JCO.2007.14.1713 . PMID 18235120 .
- Chaturvedi, Anil K .; Engels, Eric A .; Pfeiffer, Ruth M .; et al. (10 de novembro de 2011). "Human Papillomavirus and Rising Oropharyngeal Cancer Incidence in the United States" . Journal of Clinical Oncology . 29 (32): 4294–4301. doi : 10.1200 / JCO.2011.36.4596 . PMC 3221528 . PMID 21969503 .
- Chaturvedi, Anil K .; Anderson, William F .; Lortet-Tieulent, Joannie; Curado, Maria Paula; Ferlay, Jacques; Franceschi, Silvia; Rosenberg, Philip S .; Bray, Freddie; Gillison, Maura L. (20 de dezembro de 2013). "Tendências mundiais nas taxas de incidência de câncer de cavidade oral e orofaringe" . Journal of Clinical Oncology . 31 (36): 4550–4559. doi : 10.1200 / JCO.2013.50.3870 . PMC 3865341 . PMID 24248688 .
- Chenevert, J; Chiosea, S (janeiro de 2012). "Incidência do papilomavírus humano em carcinomas de células escamosas da orofaringe: agora e 50 anos atrás". Patologia Humana . 43 (1): 17–22. doi : 10.1016 / j.humpath.2011.03.009 . PMID 21777945 .
- Cook, M .; Dawsey, S .; Freedman, N .; Inskip, P .; Wichner, S .; Quraishi, S .; Devesa, S .; McGlynn, K. (2009). "Disparidades sexuais na incidência de câncer por período de tempo e idade" . Epidemiologia do câncer, biomarcadores e prevenção . 18 (4): 1174–1182. doi : 10.1158 / 1055-9965.EPI-08-1118 . PMC 2793271 . PMID 19293308 .
- Dayyani, Farshid; Etzel, Carol J; Liu, Mei; Ho, Chung-Han; Lippman, Scott M; Tsao, Anne S (2010). "Meta-análise do impacto do papilomavírus humano (HPV) no risco de câncer e na sobrevida geral em carcinomas de células escamosas de cabeça e pescoço (HNSCC)" . Oncologia de Cabeça e Pescoço . 2 (1): 15. doi : 10.1186 / 1758-3284-2-15 . PMC 2908081 . PMID 20587061 .
- D'Souza, G .; Kreimer, A .; Viscidi, R .; Pawlita, M .; Fakhry, C .; Koch, W .; Westra, W .; Gillison, M. (maio de 2007). "Estudo de caso-controle de papilomavírus humano e câncer orofaríngeo" . The New England Journal of Medicine . 356 (19): 1944–1956. doi : 10.1056 / NEJMoa065497 . ISSN 0028-4793 . PMID 17494927 . S2CID 18819678 .
- de Martel, Catherine; Ferlay, Jacques; Franceschi, Silvia; Vignat, Jérôme; Bray, Freddie; Forman, David; Plummer, Martyn (junho de 2012). "Carga global de câncer atribuível a infecções em 2008: uma revisão e análise sintética". The Lancet Oncology . 13 (6): 607–615. doi : 10.1016 / S1470-2045 (12) 70137-7 . PMID 22575588 .
- de Martel, Catherine; Plummer, Martyn; Vignat, Jerome; Franceschi, Silvia (15 de agosto de 2017). "Carga mundial de câncer atribuível ao HPV por local, país e tipo de HPV" . International Journal of Cancer . 141 (4): 664–670. doi : 10.1002 / ijc.30716 . PMC 5520228 . PMID 28369882 .
- Ernster, J .; Sciotto, C .; O'Brien, M .; Finch, J .; Robinson, L .; Willson, T .; Mathews, M. (dezembro de 2007). "Aumento da incidência de câncer orofaríngeo e o papel do vírus do papiloma humano oncogênico". O laringoscópio . 117 (12): 2115–2128. doi : 10.1097 / MLG.0b013e31813e5fbb . ISSN 0023-852X . PMID 17891052 . S2CID 38017888 .
- Forman, David; de Martel, Catherine; Lacey, Charles J .; et al. (Novembro de 2012). "Global Burden of Human Papillomavirus and Related Diseases" . Vaccine . 30 : F12 – F23. doi : 10.1016 / j.vaccine.2012.07.055 . PMID 23199955 .
- Gillison, Maura L .; Chaturvedi, Anil K .; Anderson, William F .; Fakhry, Carole (10 de outubro de 2015). "Epidemiologia do carcinoma de células escamosas positivo do papilomavírus humano na cabeça e no pescoço" . Journal of Clinical Oncology . 33 (29): 3235–3242. doi : 10.1200 / JCO.2015.61.6995 . PMC 4979086 . PMID 26351338 .
- Habbous, Steven; Chu, Karen P .; Lau, Harold; et al. (13 de agosto de 2017). "Papilomavírus humano no câncer orofaríngeo no Canadá: análise de 5 centros abrangentes de câncer usando imputação múltipla" . Canadian Medical Association Journal . 189 (32): E1030 – E1040. doi : 10.1503 / cmaj.161379 . PMC 5555753 . PMID 28808115 .
- Hammarstedt, L .; Lindquist, D .; Dahlstrand, H .; et al. (Dezembro de 2006). “O papilomavírus humano como fator de risco para o aumento da incidência de câncer tonsilar” . International Journal of Cancer . 119 (11): 2620–2623. doi : 10.1002 / ijc.22177 . ISSN 0020-7136 . PMID 16991119 . S2CID 20541360 .
- Caramba, Julia E; Berthiller, Julien; Vaccarella, Salvatore; et al. (Fevereiro de 2010). "Comportamentos sexuais e o risco de câncer de cabeça e pescoço: uma análise agrupada no consórcio Internacional de Epidemiologia do Câncer de Cabeça e Pescoço (INHANCE)" . International Journal of Epidemiology . 39 (1): 166–181. doi : 10.1093 / ije / dyp350 . PMC 2817092 . PMID 20022926 .
- Hemminki, K; Dong, C; Frisch, M (dezembro de 2000). "Tonsilares e outros cânceres do trato aerodigestivo superior entre pacientes com câncer cervical e seus maridos". European Journal of Cancer Prevention . 9 (6): 433–437. doi : 10.1097 / 00008469-200012000-00010 . PMID 11201683 . S2CID 10517792 .
- Hong, Angela M .; Grulich, Andrew E .; Jones, Deanna; Lee, C. Soon; Garland, Suzanne M .; Dobbins, Timothy A .; Clark, Jonathan R .; Harnett, Gerald B .; Milross, Christopher G .; O'Brien, Christopher J .; Rose, Barbara R. (abril de 2010). "Carcinoma de células escamosas da orofaringe em machos australianos induzido por alvos da vacina do papilomavírus humano". Vaccine . 28 (19): 3269–3272. doi : 10.1016 / j.vaccine.2010.02.098 . PMID 20226244 .
- Hong, Angela; Lee, C. Soon; Jones, Deanna; et al. (Maio de 2016b). "Aumento da prevalência de câncer orofaríngeo relacionado ao papilomavírus humano na Austrália nas últimas 2 décadas". Cabeça e pescoço . 38 (5): 743–750. doi : 10.1002 / hed.23942 . PMID 25521312 . S2CID 1974978 .
- Hwang, Tzer-Zen; Hsiao, Jenn-Ren; Tsai, Chia-Rung; Chang, Jeffrey S. (15 de julho de 2015). "Tendências de incidência de câncer de cabeça e pescoço relacionado ao papilomavírus humano em Taiwan, 1995-2009" . International Journal of Cancer . 137 (2): 395–408. doi : 10.1002 / ijc.29330 . PMID 25395239 . S2CID 20551422 .
- Jemal, A .; Siegel, R .; Ward, E .; Hao, Y .; Xu, J .; Murray, T .; Thun, MJ (28 de janeiro de 2008). "Cancer Statistics, 2008" . CA: A Cancer Journal for Clinicians . 58 (2): 71–96. doi : 10.3322 / CA.2007.0010 . PMID 18287387 . S2CID 43737426 .
- Marur, S .; D'souza, G .; Westra, WH; Forastiere, AA (2010). Câncer de cabeça e pescoço associado ao HPV: uma epidemia de câncer relacionada ao vírus " . The Lancet Oncology . 11 (8): 781–789. doi : 10.1016 / S1470-2045 (10) 70017-6 . PMC 5242182 . PMID 20451455 .
- Näsman, A .; Attner, P .; Hammarstedt, L .; et al. (Julho de 2009). "Incidência de carcinoma tonsilar positivo do papilomavírus humano (HPV) em Estocolmo, Suécia: uma epidemia de carcinoma induzido por vírus?" . International Journal of Cancer . 125 (2): 362–366. doi : 10.1002 / ijc.24339 . PMID 19330833 . S2CID 36268685 .
- Salem, A. (2010). "Dispensando ligações entre HPV e câncer de língua agressivo em pacientes jovens" . Annals of Oncology . 21 (1): 13–17. doi : 10.1093 / annonc / mdp380 . PMID 19825879 .
- Schwartz, SM; Daling, JR; Madeleine, MM; et al. (4 de novembro de 1998). "Risco de câncer oral em relação à história sexual e evidência de infecção por papilomavírus humano" . JNCI Journal of the National Cancer Institute . 90 (21): 1626–1636. doi : 10.1093 / jnci / 90.21.1626 . PMID 9811312 .
- Siegel, Rebecca; Naishadham, Deepa; Jemal, Ahmedin (janeiro de 2013). "Estatísticas do câncer, 2013" . CA: A Cancer Journal for Clinicians . 63 (1): 11–30. doi : 10.3322 / caac.21166 . PMID 23335087 . S2CID 24926725 .
- Siegel, Rebecca L .; Miller, Kimberly D .; Jemal, Ahmedin (janeiro de 2015). "Estatísticas do câncer, 2015" . CA: A Cancer Journal for Clinicians . 65 (1): 5–29. doi : 10.3322 / caac.21254 . PMID 25559415 . S2CID 10193624 .
- Siegel, Rebecca L .; Miller, Kimberly D .; Jemal, Ahmedin (janeiro de 2017). "Estatísticas do câncer, 2017" . CA: A Cancer Journal for Clinicians . 67 (1): 7–30. doi : 10.3322 / caac.21387 . PMID 28055103 .
- Smith, E .; Ritchie, J .; Summersgill, K .; Klussmann, J .; Lee, J .; Wang, D .; Haugen, T .; Turek, L. (fevereiro de 2004). "Idade, comportamento sexual e infecção por papilomavírus humano na cavidade oral e câncer orofaríngeo". International Journal of Cancer . 108 (5): 766–772. doi : 10.1002 / ijc.11633 . ISSN 0020-7136 . PMID 14696105 . S2CID 25146008 .
- Sturgis, E .; Cinciripini, P. (outubro de 2007). "Tendências na incidência de câncer de cabeça e pescoço em relação à prevalência de tabagismo: uma epidemia emergente de cânceres associados ao papilomavírus humano?". Câncer . 110 (7): 1429–1435. doi : 10.1002 / cncr.22963 . ISSN 0008-543X . PMID 17724670 . S2CID 20189903 .
- Sturgis, EM; Ang, KK (1 de junho de 2011). “A epidemia de câncer orofaríngeo associado ao HPV está aqui: é hora de mudar nossos paradigmas de tratamento?”. Journal of the National Comprehensive Cancer Network . 9 (6): 665–73. doi : 10.6004 / jnccn.2011.0055 . PMID 21636538 .
- Tachezy, R (maio de 2005). "HPV e outros fatores de risco de câncer da cavidade oral / orofaríngeo na República Tcheca". Doenças orais . 11 (3): 181–185. doi : 10.1111 / j.1601-0825.2005.01112.x . PMID 15888110 .
- Tezal, meu; Sullivan Nasca, Maureen; Stoler, Daniel L .; Melendy, Thomas; Hyland, Andrew; Smaldino, Philip J .; Rigual, Nestor R .; Loree, Thom R. (1 de abril de 2009). "Sinergia de periodontite crônica-papilomavírus humano na base de cânceres de língua" . Arquivos de Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . 135 (4): 391–6. doi : 10.1001 / archoto.2009.6 . PMID 19380363 .
- Tezal, M .; Sullivan, MA; Hyland, A .; et al. (10 de setembro de 2009). "Periodontite crônica e a incidência de carcinoma de células escamosas de cabeça e pescoço" . Epidemiologia do câncer, biomarcadores e prevenção . 18 (9): 2406–2412. doi : 10.1158 / 1055-9965.EPI-09-0334 . PMID 19745222 .
- Viens, Laura J .; Henley, S. Jane; Watson, Meg; Markowitz, Lauri E .; Thomas, Cheryll C .; Thompson, Trevor D .; Razzaghi, Hilda; Saraiya, Mona (8 de julho de 2016). "Human Papillomavirus – Associated Cancers - United States, 2008–2012" . MMWR. Relatório semanal de morbidade e mortalidade . 65 (26): 661–666. doi : 10.15585 / mmwr.mm6526a1 . PMID 27387669 .
Livros e anais de conferências
- Bernier , Jacques, ed. (2016). Câncer de Cabeça e Pescoço: Gerenciamento Multimodal . Springer International Publishing . ISBN 978-3-319-27601-4.
- Brierley, JD; Gospodarowicz, MK; Wittekind, Ch., Eds. (2017). Classificação TNM de tumores malignos (8ª ed.). Chichester, West Sussex, Reino Unido: Wiley-Blackwell . ISBN 978-1-4443-3241-4.
- Cardesa, Antonio; Slootweg, Pieter J .; Gale, Nina; Franchi, Alessandro, eds. (2017). Patologia da Cabeça e Pescoço (2ª ed.). Springer . ISBN 978-3-662-49672-5.
- Golusiński, Wojciech; Leemans, C. René; Dietz, Andreas, eds. (2017). Infecção por HPV no câncer de cabeça e pescoço . Resultados recentes na pesquisa do câncer. 206 . Springer . ISBN 978-3-319-43580-0.
- DeVita, Vincent T .; Lawrence, Theodore S .; Rosenberg, Steven A., eds. (2008) [1982]. DeVita, Hellman e Rosenberg's Cancer: Principles & Practice of Oncology (8ª ed.). Filadélfia: Lippincott Williams & Wilkins . ISBN 978-0-7817-7207-5.
- Hayat, MA, ed. (2010). Métodos de diagnóstico de câncer, terapia e prognóstico: Volume 7 - Visão geral, câncer de cabeça e pescoço e câncer de tireoide . Springer Science & Business Media . ISBN 978-90-481-3186-0.
- Kerr, David J .; Haller, Daniel G .; van de Velde, Cornelis JH; Baumann, Michael, eds. (2016) [1995]. Oxford Textbook of Oncology (3ª ed.). Oxford University Press . ISBN 978-0-19-965610-3.
- Myers, Jeffrey N .; Sturgis, Erich M., eds. (2013). Cavidade Oral e Câncer Orofaríngeo, An Issue of Otolaryngologic Clinics, E-Book . Elsevier Health Sciences . ISBN 978-0-323-18632-2.
- Olshan, Andrew F., ed. (2010). Epidemiologia, Patogênese e Prevenção do Câncer de Cabeça e Pescoço . Springer Science & Business Media . ISBN 978-1-4419-1471-2.
- Sobin, LH; Gospodarowicz, MK; Wittekind, Ch., Eds. (2010). Classificação TNM de tumores malignos (7ª ed.). Chichester, West Sussex, Reino Unido: Wiley-Blackwell . ISBN 978-1-4443-3241-4.
- Standring, Susan , ed. (2015). Gray's Anatomy: The Anatomical Basis of Clinical Practice (41ª ed.). Elsevier Health Sciences . ISBN 978-0-7020-6851-5., veja também Anatomia de Gray
Capítulos, monografias, relatórios e teses
- Bruni, L; Barrionuevo-Rosas, L; Albero, G; Serrano, B; Mena, M; Gómez, D; Muñoz, J; Bosch, FX; de Sanjosé, S (7 de julho de 2017). Vírus do papiloma humano e doenças relacionadas no mundo (PDF) . HPVIC . Retirado em 11 de agosto de 2017 ., em HPVIC (2017)
- Chaturvedi, Anil; Gillison, Maura L. (04/03/2010). Papilomavírus Humano e Câncer de Cabeça e Pescoço . pp. 87-116. ISBN 978-1-4419-1471-2., em Olshan (2010)
- Chung, Christine H; Dietz, Andreas; Gregoire, Vincent; et al. (2016). Câncer de cabeça e pescoço . pp. 329-364. ISBN 9780199656103., em Kerr et al (2016)
- Hammarstedt, Lalle (25 de abril de 2008), Tonsillar Cancer - Incidence, Prevalence of HPV and Survival (tese de doutorado), Estocolmo: Departamento de Neurociência Clínica, Karolinska Institutet , ISBN 978-91-7357-587-4, recuperado em 3 de junho de 2017
- McHanwell, Stephen (07/08/2015). Pharynx . pp. 571–585. ISBN 9780702068515., em Standring (2015)
- Helliwell, T; Woolgar, JA (1998). Padrões e conjuntos de dados mínimos para relatar cânceres comuns. Conjunto mínimo de dados para relatórios histopatológicos de cabeça e pescoço . Londres: The Royal College of Pathologists .
- Johnson, Newell; Chaturvedi, Anil (2016). Carga global de cânceres da cavidade oral e da faringe (PDF) (white paper da Conferência) . Retirado em 12 de agosto de 2017 ., em GOCF (2016)
- Mehanna, H. "Update on De-Intensification and Intensification Studies in HPV". Em Golusiński, Leemans & Dietz (2017) , pp. 251–256. . trecho aqui
- Munck-Wikland, Eva; Hammarstedt, Lalle; Dahlstrand, Hanna (07-04-2010). Papel do Papilomavírus Humano no Câncer Amigdaliano . pp. 271–283. ISBN 9789048131860., em Hayat (2010) ( extrato adicional aqui )
- Grupo de Trabalho IARC sobre Avaliação de Riscos Carcinogênicos para Humanos (1995). "Vírus do papiloma humano" . Monografias da IARC sobre a avaliação de riscos cancerígenos para humanos . 64 : 1–378. PMC 5366848 . PMID 16755705 .
- Grupo de Trabalho da IARC sobre Avaliação de Riscos Carcinogênicos para Humanos (2007). "Vírus do papiloma humano" . Monografias da IARC sobre a avaliação de riscos cancerígenos para humanos . 90 : 1–636. PMC 4781057 . PMID 18354839 .
- Grupo de Trabalho da IARC sobre Avaliação de Riscos Carcinogênicos para Humanos (2012). "Papilovírus humanos" . Agentes Biológicos . Monografias da IARC sobre a avaliação de riscos cancerígenos para humanos . 100B . Lyon: Agência Internacional de Pesquisa sobre o Câncer . pp. 255–314. ISBN 978-9283213192.
Sites
- Bath, Charlotte (25 de abril de 2017). "O tratamento deintensificação do câncer orofaríngeo HPV-positivo pode reduzir a toxicidade ao manter a função e a sobrevivência" . ASCO Post (Relatório do Simpósio Multidisciplinar de Cabeça e Pescoço de 2016). ASCO . Retirado em 3 de agosto de 2017 .
- Hunt, Jennifer L (21 de março de 2010). "Avaliação molecular do HPV em pacientes com tumores de cabeça e pescoço" (PDF) . Association for Molecular Pathology . Estados Unidos e Academia Canadense de Patologia . Arquivado do original (PDF) em 16 de julho de 2011 . Retirado em 30 de maio de 2017 .
- "Cancer of the Oral Cavity and Pharynx by Subsite" (PDF) . SEER Cancer Statistics Review 1975-2007 . Programa de Vigilância, Epidemiologia e Resultados Finais (SEER). 15 de abril de 2010 . Retirado em 3 de junho de 2017 .
- “A faringe” . TeachMeAnatomy . Ensine-me. 29 de abril de 2017 . Retirado em 20 de junho de 2017 .
- Dubner, Sanford (19 de junho de 2017). "Câncer de Cabeça e Pescoço - Ressecção e Dissecção do Pescoço: Anatomia Relevante" . Medscape . WebMD . Retirado em 17 de julho de 2017 .
- Joshi, Arjun S; Vashishta, Rishi; George, Philip E (18 de novembro de 2013). "Anatomia da faringe" . Medscape . WebMD . Retirado em 20 de junho de 2017 .
- "Tratamento do câncer orofaríngeo" . Câncer de Cabeça e Pescoço - Versão Paciente . National Institutes of Health - National Cancer Institute . Dezembro de 2016 . Página visitada em 12 de junho de 2017 .
- "Oropharyngeal Cancer Treatment (Adult) (PDQ®): Health Professional Version" . Tratamento do Câncer Orofaríngeo (Adulto) (PDQ®) . Câncer de Cabeça e Pescoço. Versão para profissionais de saúde . National Institutes of Health - National Cancer Institute . 28 de março de 2018 . Retirado em 1 de julho de 2018 .
- "Tratamento do câncer orofaríngeo" . emedicinehealth . WebMD . 1 de agosto de 2017 . Retirado em 6 de agosto de 2017 .
- O sexo oral é seguro? (Produção para televisão). Inglaterra: BBC Three . 10 de janeiro de 2011.
- "Centro de Informações HPV" . Lyon : Agência Internacional de Pesquisa sobre Câncer e Instituto Catalão de Oncologia . Retirado em 11 de agosto de 2017 .
- "The Global Oral Cancer Forum 2016" (anais da conferência). Fundação Henry Schein Cares. 2017 . Retirado em 12 de agosto de 2017 .
- "Cetuximabe com radiação considerado inferior ao tratamento padrão no câncer orofaríngeo HPV-positivo" . Comunicados à imprensa . Institutos Nacionais de Saúde . 14 de agosto de 2018 . Retirado em 15 de agosto de 2018 .
Diretrizes de tratamento
- "Série baseada em evidências de câncer de cabeça e pescoço (EBS) e diretrizes de prática (PG)" . Diretrizes baseadas em evidências . Cancer Care Ontario . 31 de março de 2017 . Retirado em 22 de maio de 2017 .
- "The Management of Head and Neck Cancer in Ontario. EBS 5-3" . Dezembro de 2009 . Retirado em 22 de maio de 2017 ., em CCO (2017)
- "Routine HPV Testing in Head and Neck Squamous Cell Carcinoma. EBS 5-9" . Maio de 2013 . Retirado em 22 de maio de 2017 ., em CCO (2017)
- "Câncer de cabeça e pescoço" (PDF) . Diretrizes da NCCN 2.2018 . Rede Nacional de Câncer Abrangente . 20 de junho de 2018 . Página visitada em 22 de junho de 2018 .
- "Cabeça e pescoço" . Diretrizes de manejo do câncer . British Columbia: BC Cancer Agency . 2017 . Retirado em 30 de junho de 2017 .
links externos
| Classificação | |
|---|---|
| Fontes externas |