Doença de Castleman idiopática multicêntrica - Idiopathic multicentric Castleman disease
| Doença de Castleman idiopática multicêntrica | |
|---|---|
| Outros nomes | Hiperplasia de linfonodo gigante, hamartoma linfóide, hiperplasia de linfonodo angiofolicular |
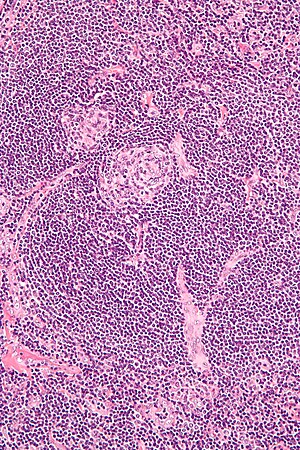 | |
| Micrografia de biópsia de linfonodo demonstrando características vasculares hialinas consistentes com doença de Castleman | |
| Especialidade | Hematologia, imunologia, reumatologia, patologia |
| Método de diagnóstico | Com base na história do paciente, exame físico, exames laboratoriais, imagens médicas, histopatologia |
| Frequência | aproximadamente 1500-1800 novos casos por ano nos Estados Unidos |
A doença de Castleman multicêntrica idiopática (iMCD) é um subtipo da doença de Castleman (também conhecida como hiperplasia de linfonodo gigante , hamartoma linfóide ou hiperplasia de linfonodo angiofolicular ), um grupo de distúrbios linfoproliferativos caracterizados por aumento dos linfonodos , características na análise microscópica de linfonodos aumentados tecido de linfonodos e uma série de sintomas e achados clínicos.
Pessoas com iMCD têm linfonodos aumentados em várias regiões e geralmente apresentam sintomas semelhantes aos da gripe, achados anormais em exames de sangue e disfunção de órgãos vitais, como fígado, rins e medula óssea.
iMCD tem características freqüentemente encontradas em doenças autoimunes e cânceres, mas o mecanismo da doença subjacente é desconhecido. O tratamento para iMCD pode envolver o uso de uma variedade de medicamentos, incluindo imunossupressores e quimioterapia.
A doença de Castleman foi nomeada em homenagem ao Dr. Benjamin Castleman , que descreveu a doença pela primeira vez em 1956. A Castleman Disease Collaborative Network é a maior organização focada na doença e está envolvida em pesquisa, conscientização e apoio ao paciente.
sinais e sintomas
Pacientes com iMCD podem apresentar linfonodos aumentados em várias regiões de linfonodos; sintomas sistêmicos (febre, suores noturnos, perda de peso não intencional, fadiga); aumento do fígado e / ou baço ; acúmulo de líquido extravascular nas extremidades ( edema ), abdômen ( ascite ) ou revestimento dos pulmões ( derrame pleural ); sintomas pulmonares, como tosse e falta de ar; e achados cutâneos, como hemangiomas cereja .
Causas
A causa da iMCD não é conhecida e nenhum fator de risco foi identificado. Variantes genéticas foram observadas em casos de doença de Castleman; no entanto, nenhuma variante genética foi validada como causadora de doenças.
Ao contrário do MCD associado ao HHV-8 , o iMCD não é causado por infecção não controlada pelo HHV-8.
Mecanismo
O mecanismo da doença de iMCD não foi totalmente descrito. Sabe-se que a interleucina-6 (IL-6) , molécula que estimula as células do sistema imunológico, desempenha um papel em alguns casos de iMCD. Os níveis de IL-6 medidos em alguns pacientes com iMCD aumentam e diminuem com as alterações correspondentes na atividade da doença, camundongos tratados com IL-6 desenvolvem características de iMCD e o bloqueio da via de IL-6 usando os medicamentos siltuximabe e tocilizumabe trata efetivamente alguns pacientes com iMCD. No entanto, muitos pacientes com iMCD não demonstram níveis elevados de IL-6 e os níveis de IL-6 não estão fortemente correlacionados com a resposta ao tratamento com medicamentos anti-IL-6. Nos casos em que a IL-6 desempenha um papel, a causa subjacente dos níveis elevados de IL-6 e as células responsáveis pela produção de IL-6 permanecem desconhecidas.
Vários mecanismos teóricos para iMCD foram propostos com base em pesquisas existentes e observaram semelhanças entre iMCD e outras doenças que apresentam resultados clínicos e histologia de linfonodos semelhantes:
- Autoimune - o sistema imunológico pode produzir anticorpos que têm como alvo células saudáveis no corpo em vez de bactérias e vírus. Os anticorpos autodirecionados são comumente vistos em doenças autoimunes, como lúpus eritematoso sistêmico e artrite reumatóide .
- Autoinflamatório - Uma mutação em um gene que controla os sistemas inflamatórios pode contribuir para a ativação prejudicial das vias inflamatórias em pacientes com iMCD.
- Neoplásica - mutações genéticas que se desenvolvem em células maduras ( mutações somáticas ) podem causar um crescimento excessivo de células anormais, como em cânceres como o linfoma .
- Patógeno - o herpesvírus humano 8 (HHV-8) é o conhecido agente causador do MCD associado ao HHV-8, que apresenta sintomas e achados muito semelhantes aos do iMCD. Embora o iMCD, por definição, não seja causado pelo HHV-8, um vírus desconhecido pode causar a doença.
Não houve nenhum caso relatado de UCD transformando-se em iMCD.
Diagnóstico
O iMCD é diagnosticado de acordo com critérios diagnósticos consensuais baseados em evidências, que requerem uma avaliação completa, incluindo histórico do paciente , exame físico , testes laboratoriais , imagens radiológicas e análise microscópica (histologia) de tecido biopsiado de um linfonodo aumentado. O diagnóstico de iMCD requer anormalidades clínicas, exclusão de outras doenças e uma biópsia de linfonodo mostrando características consistentes com a doença de Castleman. A biópsia de linfonodo por si só não é suficiente para fazer o diagnóstico.
Testando em laboratório "ou" Teste experimental
O teste de laboratório pode demonstrar elevados de proteína C-reactiva , diminuição da hemoglobina níveis ( anemia ), baixa albumina níveis, elevada creatinina , aumento de imunoglobulina níveis, e anormais (elevado ou reduzido) de plaquetas contagens. Os pacientes também podem ter elevações de moléculas envolvidas na inflamação ( citocinas ), como a interleucina 6 (IL-6) e o fator de crescimento endotelial vascular (VEGF) .
Imagens médicas
As imagens radiológicas demonstrarão linfonodos aumentados em várias regiões, que são tipicamente 18F-fluorodoxyglucose (FDG) ávidos na tomografia por emissão de pósitrons (PET) .
Doenças associadas
A iMCD é comumente observada em pacientes com síndrome POEMS , mas não está claro se a iMCD ocorre como um processo de doença independente ou uma manifestação da síndrome POEMS nesses pacientes. Pacientes com iMCD têm risco aumentado de tumores sólidos e cânceres do sangue. Ocasionalmente, os pacientes com iMCD apresentam pneumonite intersticial linfocítica .
Síndrome TAFRO
pacientes com IMCD t hrombocytopenia, um nasarca, mielo f ibrosis, r disfunção enal, e o síndrome rganomegaly (síndrome TAFRO) são considerados como tendo um subtipo clínica distinta de IMCD. Os pacientes freqüentemente apresentam rápida progressão dos sintomas e freqüentemente desenvolvem disfunção orgânica grave. Em comparação com pacientes com iMCD sem síndrome TAFRO, os pacientes com iMCD com síndrome TAFRO têm maior probabilidade de apresentar dor abdominal intensa, níveis de plaquetas baixos, disfunção renal progressiva e níveis de imunoglobulina normais a levemente elevados. Embora iMCD com síndrome TAFRO tenha sido descrito pela primeira vez em pacientes japoneses em 2010, casos de iMCD com síndrome TAFRO foram relatados em pacientes não japoneses em muitos outros países.
Classificação
A doença de Castleman descreve um grupo de pelo menos 3 distúrbios distintos - doença de Castleman unicêntrica (UCD), doença de Castleman multicêntrica associada ao herpesvírus humano 8 (MCD associada a HHV-8) e doença de Castleman multicêntrica idiopática (iMCD) . Identificar o subtipo correto da doença é importante, pois os três distúrbios variam significativamente em sintomas, achados clínicos, mecanismo da doença, abordagem de tratamento e prognóstico.
- Na doença de Castleman unicêntrica, os linfonodos aumentados com achados microscópicos característicos estão presentes em apenas uma única região linfonodal.
- Nos subtipos multicêntricos da doença de Castleman, linfonodos aumentados com achados característicos estão presentes em várias regiões de linfonodos. As variantes multicêntricas da doença de Castleman são posteriormente classificadas por causas conhecidas da doença.
- O MCD associado ao HHV-8 é causado por infecção não controlada pelo herpesvírus humano 8 (HHV-8).
- Na doença de Castleman multicêntrica idiopática (iMCD), a causa da doença é desconhecida ( idiopática ). O teste para HHV-8 deve ser negativo para diagnosticar iMCD.
Doença de Castleman idiopática multicêntrica
IMCD pode ser adicionalmente diferenciado pela presença de doenças associadas, tais como p olyneuropathy, o rganomegaly, e ndocrinopathy, m proteína onoclonal, s parentes muda síndrome (síndrome POEMS), ou por características clínicas distintas, tais como t hrombocytopenia, um nasarca, mielo f ibrosis, r disfunção enal, e o síndrome rganomegaly (síndrome TAFRO).
Critério de diagnóstico
O diagnóstico de iMCD requer: a presença de ambos os critérios principais, várias regiões de linfonodos aumentados, conforme demonstrado por imagens médicas; a presença de pelo menos dois critérios menores, pelo menos um dos quais deve ser um teste laboratorial anormal; e exclusão de doenças que podem mimetizar iMCD.
Critérios principais 1: múltiplas regiões de linfonodos aumentados
As imagens radiológicas devem demonstrar linfonodos aumentados em várias regiões.
Critérios principais 2: análise microscópica de biópsia de linfonodo consistente com iMCD
A aparência microscópica (histologia) do tecido biopsiado de um linfonodo aumentado deve demonstrar uma constelação de características consistentes com a doença de Castleman. Existem três padrões de características histológicas associadas ao iMCD:
- Hipervascular - centros germinativos regredidos , proeminência das células dendríticas foliculares , hipervascularização nas regiões interfoliculares e zonas do manto proeminentes com aparência de “casca de cebola”.
- Plasmocítico - aumento do número de folículos com grandes centros germinativos hiperplásicos e plasmocitose em forma de folha (aumento do número de células plasmáticas ).
- Misto - características de hipervascular e plasmocítica.
O iMCD mais comumente demonstra características plasmocíticas; no entanto, características hipervasculares ou uma mistura de características hipervasculares e plasmocíticas também podem ser observadas em linfonodos iMCD. A utilidade clínica da subtipagem de iMCD por características histológicas é incerta, pois os subtipos histológicos não predizem consistentemente a gravidade da doença ou a resposta ao tratamento.
A coloração com antígeno nuclear associado à latência (LANA-1) , um marcador de infecção por HHV-8, deve ser negativa para o diagnóstico de iMCD.
Critérios menores
Os pacientes devem experimentar pelo menos dois dos 11 critérios menores a seguir, com pelo menos um sendo um teste laboratorial anormal.
Testes laboratoriais:
- Proteína C reativa elevada ou taxa de sedimentação de eritrócitos
- Níveis baixos de hemoglobina (anemia)
- Contagens de plaquetas anormais (baixas ou altas)
- Níveis baixos de albumina
- Creatinina elevada
- Níveis aumentados de imunoglobulinas (hipergamaglobulinemia)
Características clínicas:
- Sintomas como os da gripe
- Aumento do fígado e / ou baço
- Acúmulo de fluido (edema, ascite, derrame pleural)
- Achados cutâneos, como hemangiomas cereja ou pápulas violáceas
- Pneumonite intersticial linfocítica
Doenças a serem excluídas
O diagnóstico requer a exclusão de doenças que podem se apresentar com achados clínicos semelhantes e aparência semelhante na análise microscópica de tecido de um linfonodo aumentado. As doenças que devem ser excluídas no diagnóstico de iMCD incluem doenças infecciosas, como MCD associado ao HHV-8 , mononucleose do vírus Epstein-Barr e linfadenopatia reativa ; doenças autoimunes, como lúpus eritematoso sistêmico e artrite reumatóide ; e cânceres, incluindo linfoma , mieloma múltiplo e plasmocitoma de linfonodo primário .
Tratamento
Devido à raridade do iMCD, os dados relativos ao tratamento são limitados e baseados em uma combinação de séries de casos observacionais, relatos de casos e um único ensaio clínico randomizado. Ao contrário do UCD, para o qual a cirurgia é o tratamento de escolha e curativo para a maioria dos pacientes, a cirurgia não é eficaz no iMCD. Em vez do tratamento cirúrgico, uma variedade de medicamentos é usada com base na gravidade da doença e na resposta do paciente aos tratamentos anteriores. Siltuximab , um anticorpo monoclonal direcionado à IL-6 , é o único medicamento aprovado pela Food and Drug Administration (FDA) dos Estados Unidos para o tratamento de iMCD; no entanto, o uso bem-sucedido de outros medicamentos foi relatado na literatura.
Em 2018, as primeiras diretrizes de tratamento de consenso baseadas em evidências para iMCD foram publicadas por um grupo internacional de especialistas na área. Além de criar um algoritmo de tratamento para iMCD, essas diretrizes de tratamento estabeleceram definições comuns para a gravidade da doença e a resposta ao tratamento.
Avaliação da gravidade do iMCD
Os pacientes com iMCD são classificados como portadores de doença grave ou não grave com base nos 5 critérios listados abaixo. Pacientes com 2 ou mais dos critérios abaixo são classificados como portadores de doença grave, enquanto pacientes com 0-1 dos critérios são classificados como portadores de doença não grave.
- Status de desempenho do Eastern Cooperative Oncology Group (ECOG) ≥ 2
- Taxa de filtração glomerular estimada (eGFR) <30 ou creatinina> 3,0 mg / dL
- Anasarca e / ou ascite e / ou derrame pleural e / ou derrame pericárdico
- Hemoglobina ≤ 8,0 g / dL
- Envolvimento pulmonar (por exemplo, pneumonite intersticial com dispneia)
Resposta ao tratamento
Os pacientes com iMCD são avaliados quanto à resposta ao tratamento com base nas alterações dos sintomas, tamanhos dos nódulos linfáticos envolvidos e testes laboratoriais. Cada categoria é classificada como uma resposta completa, resposta parcial, doença estável ou doença progressiva. A resposta geral ao tratamento é determinada pelo grau de categoria mais baixo. Por exemplo, um paciente com uma resposta laboratorial completa , uma resposta parcial dos sintomas e uma resposta completa do linfonodo receberia uma resposta geral ao tratamento de resposta parcial . Veja abaixo as descrições dos critérios e classificação das respostas.
Testando em laboratório "ou" Teste experimental
Os exames laboratoriais incluem todos os seguintes: proteína C reativa, hemoglobina, albumina e eGFR.
- Resposta completa - Todos os valores de laboratório dentro dos intervalos normais
- Resposta parcial -> 50% em todos os valores de laboratório
- Doença estável - Todos os valores de laboratório entre <50% de melhora e <25% de piora
- Doença progressiva - piora> 25% em qualquer valor de laboratório
Sintomas
Quatro sintomas são avaliados usando os Critérios de Terminologia Comum de Eventos Adversos do National Cancer Institute (versão 4): Fadiga, anorexia, febre e peso corporal
- Resposta completa - Normalização para linha de base pré-doença
- Resposta parcial - melhora em todos os 4 sintomas, mas não na linha de base pré-doença
- Doença estável - melhora em pelo menos 1 (mas não todos) sintomas
- Doença progressiva - Piora de pelo menos 1 sintoma em 2 ou mais avaliações
Linfonodo
A resposta ao tratamento para os linfonodos é avaliada usando imagens radiológicas e classificada como resposta completa, resposta parcial, doença estável e doença progressiva com base nos critérios de Cheson modificados.
Algoritmo de Tratamento
O algoritmo de tratamento para iMCD é baseado principalmente na gravidade da doença e na resposta ao tratamento. Devido à alta taxa de recidiva com a suspensão do tratamento, a maioria dos pacientes com iMCD é tratada com medicamentos indefinidamente.
Doença não grave
Siltuximab, um bloqueador de IL-6, é o tratamento recomendado para todos os pacientes com iMCD não grave, independentemente dos níveis medidos de IL-6. Tocilizumabe , um medicamento que também tem como alvo a via da IL-6, é comumente usado como alternativa ao siltuximabe quando o siltuximabe não está disponível. Os corticosteroides podem ser adicionados à terapia com anti-IL-6, dependendo da apresentação clínica. O rituximabe , um medicamento direcionado às células B, é recomendado principalmente como terapia de segunda linha para pacientes que não respondem ao siltuximabe ou ao tocilizumabe, mas pode ser usado como agente de primeira linha em pacientes apropriados.
Para pacientes com doença não grave que não respondem a siltuximabe, tocilizumabe e rituximabe, as recomendações de tratamento não estão bem definidas. Foi relatado que quimioterapias citotóxicas induzem a remissão em pacientes com iMCD não grave; no entanto, o uso de quimioterapias citotóxicas não é recomendado atualmente para iMCD não grave devido à alta probabilidade de recidiva e perfis de efeitos colaterais graves. Como alternativa, imunomoduladores como talidomida, ciclosporina A, sirolimus, bortezomibe e anakinra são recomendados devido às suas taxas de resposta semelhantes e perfis de efeitos colaterais de longo prazo mais favoráveis.
Doença grave
O tratamento inicial recomendado para todos os pacientes com iMCD grave são esteróides em altas doses combinados com um agente anti-IL-6, como siltuximabe ou tocilizumabe, independentemente dos níveis medidos de IL-6. Para pacientes que melhoram imediatamente com este regime, os esteróides podem ser reduzidos lentamente, mas o agente anti-IL-6 deve ser continuado indefinidamente devido à alta taxa de recidiva com a suspensão do tratamento. Devido ao alto risco de complicações associadas a iMCD grave, se os pacientes piorarem ou não melhorarem com esteróides em altas doses e terapias anti-IL-6, regimes de quimioterapia citotóxica são recomendados. Pacientes com doença com risco de vida, particularmente aqueles com síndrome TAFRO, podem requerer medidas avançadas, como suporte respiratório com ventilador mecânico ou tratamento com diálise para insuficiência renal.
Após a melhora no estado da doença, a terapia de manutenção com um agente anti-IL-6 ou um medicamento imunossupressor é normalmente continuada indefinidamente, pois a retirada de tais medicamentos pode levar à recaída.
Seguir
Pacientes com iMCD requerem avaliação de rotina da resposta ao tratamento e progressão da doença. Recomenda-se que as visitas de acompanhamento incluam avaliação dos sintomas, exame físico, exames laboratoriais e imagens radiológicas.
Prognóstico
A iMCD pode se apresentar como uma doença aguda com risco de vida em alguns pacientes ou uma doença crônica em outros. Alguns pacientes apresentam doença estável de longa data, enquanto outros sofrem surtos de doenças graves que podem melhorar com o tratamento. O tratamento bem-sucedido controla os sintomas e as disfunções orgânicas associadas à iMCD, melhora os sintomas e a disfunção orgânica durante as crises de doenças e evita as crises futuras.
A sobrevida observada em um estudo recente de pacientes com iMCD foi de 92% em 2 anos, 76% em 5 anos e 59% em 10 anos.
Epidemiologia
Existem aproximadamente 1500-1800 novos casos de iMCD diagnosticados por ano nos Estados Unidos. A iMCD pode ocorrer em qualquer idade, mas a idade média na apresentação é de aproximadamente 50 anos. Há um ligeiro aumento na incidência de iMCD em mulheres.
Não há estudos epidemiológicos publicados sobre a doença de Castleman fora dos Estados Unidos; no entanto, não há dados publicados que demonstrem aumento ou diminuição da incidência da doença de Castleman em regiões ou etnias específicas.
História
A doença de Castleman foi descrita pela primeira vez pelo Dr. Benjamin Castleman em 1956. O Dia Mundial da Doença de Castleman foi estabelecido em 2018 e é realizado todos os anos em 23 de julho.
Cultura
A Castleman Disease Collaborative Network foi fundada em 2012 e é a maior organização focada na doença de Castleman. É uma rede colaborativa global envolvida em pesquisa, conscientização e suporte ao paciente.
Referências
| Classificação |
|---|
