Gefitinib - Gefitinib
 | |
 | |
| Dados clínicos | |
|---|---|
| Pronúncia | / Do ɡ ɛ f ɪ t ɪ n ɪ b / |
| Nomes comerciais | Iressa, outros |
| Outros nomes | ZD1839 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a607002 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | 59% (oral) |
| Ligação proteica | 90% |
| Metabolismo | Fígado (principalmente CYP3A4 ) |
| Meia-vida de eliminação | 6–49 horas |
| Excreção | Fezes |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.171.043 |
| Dados químicos e físicos | |
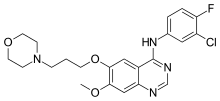
| Fórmula | C 22 H 24 Cl F N 4 O 3 |
| Massa molar | 446,91 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| (verificar) | |
Gefitinibe , vendido sob a marca Iressa , é um medicamento usado para certos tipos de câncer de mama, pulmão e outros . O gefitinibe é um inibidor do EGFR , como o erlotinibe , que interrompe a sinalização por meio do receptor do fator de crescimento epidérmico (EGFR) nas células-alvo. Portanto, só é eficaz em cânceres com EGFR mutado e hiperativo , mas podem surgir resistências ao gefitinibe por meio de outras mutações. É comercializado pela AstraZeneca e Teva .
Está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde .
Mecanismo de ação
Gefitinib é o primeiro inibidor seletivo do domínio da tirosina quinase do receptor do fator de crescimento epidérmico (EGFR) . Assim, o gefitinib é um inibidor de EGFR . A proteína alvo (EGFR) é um membro de uma família de receptores ( ErbB ) que inclui Her1 (EGFR), Her2 (erb-B2), Her3 (erb-B3) e Her4 (Erb-B4). O EGFR é superexpresso nas células de certos tipos de carcinomas humanos - por exemplo, nos cânceres de pulmão e de mama. Isso leva à ativação inadequada da cascata de sinalização Ras anti-apoptótica , levando eventualmente à proliferação celular descontrolada. Pesquisas sobre cânceres de pulmão de células não pequenas sensíveis ao gefitinibe mostraram que uma mutação no domínio da tirosina quinase EGFR é responsável por ativar as vias anti-apoptóticas. Essas mutações tendem a conferir maior sensibilidade aos inibidores da tirosina quinase, como gefitinibe e erlotinibe. Dos tipos de histologias de câncer de pulmão de células não pequenas, o adenocarcinoma é o tipo que mais frequentemente abriga essas mutações. Essas mutações são mais comumente vistas em asiáticos, mulheres e não fumantes (que também tendem a ter adenocarcinoma com mais frequência).
Gefitinib inibe a tirosina quinase EGFR ao se ligar ao local de ligação do trifosfato de adenosina (ATP) da enzima. Assim, a função da tirosina quinase EGFR na ativação da cascata de transdução de sinal Ras anti-apoptótica é inibida e as células malignas são inibidas.
Usos clínicos
O gefitinib é atualmente comercializado em mais de 64 países.
O Iressa foi aprovado e comercializado a partir de julho de 2002 no Japão, sendo o primeiro país a importar o medicamento.
O FDA aprovou o gefitinibe em maio de 2003 para câncer de pulmão de células não pequenas (NSCLC). Foi aprovado como monoterapia para o tratamento de pacientes com NSCLC localmente avançado ou metastático após falha das quimioterapias à base de platina e docetaxel. ou seja, como uma terapia de terceira linha.
Em junho de 2005, o FDA retirou a aprovação para uso em novos pacientes devido à falta de evidências de que prolongava a vida.
Na Europa, o gefitinibe é indicado desde 2009 no NSCLC avançado em todas as linhas de tratamento para pacientes portadores de mutações EGFR. Este rótulo foi concedido depois que o gefitinibe demonstrou ser um tratamento de primeira linha para melhorar significativamente a sobrevida livre de progressão em comparação com um regime de dupleto de platina em pacientes portadores de tais mutações. O IPASS foi o primeiro de quatro estudos de fase III a confirmar a superioridade do gefitinibe nesta população de pacientes.
Na maioria dos outros países onde o gefitinibe é atualmente comercializado, ele foi aprovado para pacientes com NSCLC avançado que receberam pelo menos um regime de quimioterapia anterior. No entanto, os pedidos de expansão de seu rótulo como tratamento de primeira linha em pacientes com mutações EGFR estão atualmente em andamento com base nas evidências científicas mais recentes. Em agosto de 2012, a Nova Zelândia aprovou o gefitinibe como tratamento de primeira linha para pacientes com mutação EGFR para NSCLC virgem localmente avançado ou metastático irressecável. Isso é financiado publicamente por um período inicial de 4 meses e renovação, se não houver progressão.
Em 13 de julho de 2015, o FDA aprovou o gefitinibe como tratamento de primeira linha para NSCLC.
Usos experimentais
Em agosto de 2013, a BBC relatou que pesquisadores em Edimburgo e Melbourne descobriram, em um ensaio em pequena escala com 12 pacientes, que a eficácia do Metotrexato no tratamento da gravidez ectópica melhorou quando o Gefitinibe também foi administrado.
Estudos
IPASS (IRESSA Pan-Asia Study) foi um estudo randomizado, em grande escala, duplo-cego, que comparou gefitinibe vs. carboplatina / paclitaxel como tratamento de primeira linha em NSCLC avançado. O IPASS estudou 1.217 pacientes com histologia de adenocarcinoma confirmada, ex-fumantes ou nunca fumantes. Uma análise de subgrupo pré-planejada mostrou que a sobrevida livre de progressão (PFS) foi significativamente maior para gefitinibe do que quimioterapia em pacientes com tumores positivos para mutação EGFR (HR 0,48, 95 por cento CI 0,36 a 0,64, p menor que 0,0001), e significativamente mais longo para quimioterapia do que gefitinibe em pacientes com tumores negativos para mutação EGFR (HR 2,85, 95 por cento CI 2,05 a 3,98, p menor que 0,0001). Esta foi, em 2009, a primeira vez que uma monoterapia direcionada demonstrou PFS significativamente mais longa do que a quimioterapia dupla.
Testes de diagnóstico EGFR
Roche Diagnostics, Genzyme, QIAGEN, Argenomics SA e outras empresas fazem testes para detectar mutações de EGFR , projetados para ajudar a prever quais pacientes com câncer de pulmão podem responder melhor a algumas terapias, incluindo gefitinibe e erlotinibe .
Os testes examinam a genética dos tumores removidos para biópsia em busca de mutações que os tornam suscetíveis ao tratamento.
O teste de mutação EGFR também pode ajudar a AstraZeneca a obter a aprovação regulatória para o uso de seus medicamentos como terapias iniciais. Atualmente, os inibidores de TK são aprovados para uso somente após a falha de outros medicamentos. No caso do gefitinibe, o medicamento funciona apenas em cerca de 10% dos pacientes com câncer avançado de pulmão de células não pequenas, o tipo mais comum de câncer de pulmão.
Efeitos adversos
Como o gefitinibe é um agente quimioterápico seletivo, seu perfil de tolerabilidade é melhor do que os agentes citotóxicos anteriores . As reações adversas a medicamentos (RAMs) são aceitáveis para uma doença potencialmente fatal.
Erupção cutânea semelhante à acne é relatada muito comumente. Outros efeitos adversos comuns (≥1% dos pacientes) incluem: diarreia , náuseas, vômitos , anorexia , estomatite , desidratação , reações cutâneas, paroníquia , elevações assintomáticas das enzimas hepáticas , astenia , conjuntivite , blefarite .
Os efeitos adversos infrequentes (0,1–1% dos pacientes) incluem: doença pulmonar intersticial , erosão da córnea , cílios aberrantes e crescimento de pelos.
Resistência
O gefitinibe e outros inibidores de EGFR de primeira geração se ligam reversivelmente à proteína receptora, competindo efetivamente pelo bolso de ligação de ATP. Podem surgir mutações secundárias que alteram o local de ligação, sendo a mutação mais comum T790M , onde uma treonina é substituída por uma metionina na posição de aminoácido 790, que está no domínio de ligação ao ligante que normalmente se liga ao ATP. Treonina 790 é o resíduo do gatekeeper, o que significa que é a chave para determinar a especificidade no bolso de ligação. Quando é transformado em uma metionina, os pesquisadores originalmente levantaram a hipótese de que causava a inibição da droga devido ao impedimento estérico da metionina mais volumosa selecionada para a ligação de ATP em vez de gefitinibe. A partir de 2008, o mecanismo hipotetizado atual é que a resistência ao gefitinibe é transmitida pelo aumento da afinidade do ATP do EGFR em um nível enzimático, o que significa que a proteína se liga preferencialmente ao ATP ao gefitinibe.
Para combater essa resistência adquirida ao gefitinibe e outros inibidores de primeira geração, os pesquisadores usaram inibidores irreversíveis do EGFR como o neratinibe ou dacomitinibe , chamados inibidores da tirosina quinase (TKIs). Esses novos fármacos se ligam covalentemente à bolsa de ligação do ATP, portanto, quando estão ligados ao EGFR, não podem ser deslocados pelo ATP. Mesmo que as versões mutadas do EGFR tenham uma afinidade maior para o ATP, elas eventualmente usarão os inibidores irreversíveis como ligantes, o que efetivamente interrompe sua atividade. Quando um número suficiente de ligantes irreversíveis se ligou ao EGFR, a proliferação será interrompida e a apoptose será desencadeada por várias vias; por exemplo, o Bim pode ser ativado depois de não ser mais inibido por ERK, uma das quinases na via de sinalização de EGFR. Mesmo com o gefitinibe interrompendo a progressão do NSCLC, o desenvolvimento do câncer progride após 9 a 13 meses devido a resistências adquiridas como a mutação T790M. Esses TKIs, como o dacomitinibe, aumentaram a sobrevida geral em quase um ano.
Veja também
- Erlotinibe , outro inibidor da tirosina quinase EGFR que tem um mecanismo de ação semelhante ao gefitinibe.
- Remédio personalizado
Referências
links externos
- "Gefitinib" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- "Gefitinib" . Instituto Nacional do Câncer .
