Beta-catenina - Beta-catenin
A catenina beta-1 , também conhecida como β-catenina , é uma proteína que em humanos é codificada pelo gene CTNNB1 .
A β-catenina é uma proteína de função dupla , envolvida na regulação e coordenação da adesão célula-célula e transcrição gênica . Em humanos, a proteína CTNNB1 é codificada pelo gene CTNNB1 . Na Drosophila , a proteína homóloga é chamada de tatu . A β-catenina é uma subunidade do complexo da proteína caderina e atua como um transdutor de sinal intracelular na via de sinalização Wnt . É um membro da família de proteínas cateninas e homóloga à γ-catenina , também conhecida como placoglobina . A beta-catenina é amplamente expressa em muitos tecidos. No músculo cardíaco , a beta-catenina se localiza nas junções aderentes em estruturas de disco intercaladas , que são críticas para o acoplamento elétrico e mecânico entre cardiomiócitos adjacentes .
Mutações e superexpressão de β-catenina estão associadas a muitos cânceres, incluindo carcinoma hepatocelular , carcinoma colorretal , câncer de pulmão , tumores malignos de mama , câncer de ovário e endometrial . Alterações nos níveis de localização e expressão de beta-catenina foram associadas a várias formas de doenças cardíacas , incluindo cardiomiopatia dilatada . A β-catenina é regulada e destruída pelo complexo de destruição da beta-catenina e, em particular, pela proteína adenomatous polyposis coli (APC), codificada pelo gene APC supressor de tumor . Portanto, a mutação genética do gene APC também está fortemente ligada a cânceres e, em particular, câncer colorretal resultante de polipose adenomatosa familiar (FAP).
Descoberta
A beta-catenina foi descoberta inicialmente no início dos anos 1990 como um componente de um complexo de adesão de células de mamíferos : uma proteína responsável pela ancoragem citoplasmática de caderinas . Mas logo percebeu-se que a proteína tatu Drosophila - implicada na mediação dos efeitos morfogênicos de Wingless / Wnt - é homóloga à β-catenina dos mamíferos, não apenas em estrutura, mas também em função. Assim, a beta-catenina tornou-se um dos primeiros exemplos de trabalho clandestino : uma proteína que desempenha mais de uma função celular radicalmente diferente.
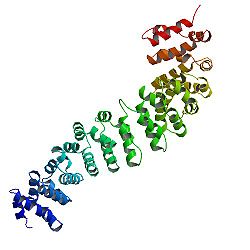
Estrutura
Estrutura da proteína
O núcleo da beta-catenina consiste em várias repetições muito características , cada uma com aproximadamente 40 aminoácidos de comprimento. Denominado tatu repete , todos esses elementos se dobram juntos em um único domínio de proteína rígida com uma forma alongada - chamado domínio de tatu (ARM). Uma repetição média de tatu é composta de três hélices alfa . A primeira repetição da β-catenina (perto do terminal N) é ligeiramente diferente das outras - pois tem uma hélice alongada com uma dobra, formada pela fusão das hélices 1 e 2. Devido à forma complexa das repetições individuais, todo o domínio ARM não é uma haste reta: possui uma ligeira curvatura, de modo que uma superfície externa (convexa) e uma interna (côncava) são formadas. Esta superfície interna serve como um local de ligação ao ligante para os vários parceiros de interação dos domínios ARM.
Os segmentos N-terminal e distante C-terminal para o domínio ARM não adotam nenhuma estrutura em solução por si próprios. No entanto, essas regiões intrinsecamente desordenadas desempenham um papel crucial na função da beta-catenina. A região desordenada do terminal N contém um motivo linear curto conservado responsável pela ligação de TrCP1 (também conhecido como β-TrCP) E3 ubiquitina ligase - mas apenas quando é fosforilado . A degradação da β-catenina é, portanto, mediada por este segmento N-terminal. A região C-terminal, por outro lado, é um forte transativador quando recrutada para o DNA . Este segmento não está totalmente desordenado: parte da extensão C-terminal forma uma hélice estável que se compacta contra o domínio ARM, mas também pode envolver parceiros de ligação separados. Este pequeno elemento estrutural (HelixC) cobre a extremidade C-terminal do domínio ARM, protegendo seus resíduos hidrofóbicos. HelixC não é necessário para que a beta-catenina funcione na adesão célula-célula. Por outro lado, é necessário para a sinalização Wnt: possivelmente para recrutar vários coativadores, como 14-3-3zeta. No entanto, seus parceiros exatos entre os complexos gerais de transcrição ainda não são completamente compreendidos e provavelmente envolvem atores específicos de tecidos. Notavelmente, o segmento C-terminal da β-catenina pode imitar os efeitos de toda a via Wnt se fundido artificialmente ao domínio de ligação ao DNA do fator de transcrição LEF1 .
A placoglobina (também chamada de gama-catenina) tem uma arquitetura muito semelhante à da beta-catenina. Não apenas seus domínios ARM se assemelham na arquitetura e na capacidade de ligação ao ligante, mas o motivo de ligação β-TrCP do terminal N também é conservado na placoglobina, implicando ancestralidade comum e regulação compartilhada com β-catenina. No entanto, a placoglobina é um transativador muito fraco quando ligado ao DNA - isso é provavelmente causado pela divergência de suas sequências C-terminais (a placoglobina parece não ter os motivos do transativador e, portanto, inibe os genes alvo da via Wnt em vez de ativá-los).
Parceiros vinculados ao domínio armadillo
Conforme esboçado acima, o domínio ARM da beta-catenina atua como uma plataforma à qual motivos lineares específicos podem se ligar. Localizados em parceiros estruturalmente diversos, os motivos de ligação de β-catenina são tipicamente desordenados por conta própria e, normalmente, adotam uma estrutura rígida após o envolvimento do domínio ARM - como visto para motivos lineares curtos . No entanto, os motivos que interagem com a β-catenina também têm uma série de características peculiares. Primeiro, eles podem atingir ou mesmo ultrapassar o comprimento de 30 aminoácidos de comprimento e entrar em contato com o domínio ARM em uma área de superfície excessivamente grande. Outra característica incomum desses motivos é seu freqüentemente alto grau de fosforilação . Tais eventos de fosforilação Ser / Thr aumentam muito a ligação de muitos motivos de associação de β-catenina ao domínio ARM.
A estrutura da beta-catenina em complexo com o domínio de ligação da catenina do parceiro de transativação transcricional TCF forneceu o roteiro estrutural inicial de quantos parceiros de ligação da beta-catenina podem formar interações. Esta estrutura demonstrou como o terminal N desordenado de TCF adaptou o que parecia ser uma conformação rígida, com o motivo de ligação abrangendo muitas repetições de beta-catenina. Foram definidos "pontos quentes" de interação carregada relativamente forte (previstos, e posteriormente verificados, a serem conservados para a interação beta-catenina / E-caderina), bem como regiões hidrofóbicas consideradas importantes no modo geral de ligação e como potencial terapêutico pequeno inibidores de moléculas alvos contra certas formas de câncer. Além disso, os estudos seguintes demonstraram outra característica peculiar, a plasticidade na ligação do terminal N do TCF à beta-catenina.
Da mesma forma, encontramos a conhecida E-caderina , cuja cauda citoplasmática contata o domínio ARM da mesma maneira canônica. A proteína-esqueleto axina (dois parálogos intimamente relacionados, axina 1 e axina 2 ) contém um motivo de interação semelhante em seu longo segmento médio desordenado. Embora uma molécula de axina contenha apenas um único motivo de recrutamento de β-catenina, seu parceiro, a proteína Adenomatous Polyposis Coli (APC), contém 11 desses motivos em arranjo em tandem por protômero, portanto, capaz de interagir com várias moléculas de β-catenina ao mesmo tempo. Uma vez que a superfície do domínio ARM pode acomodar tipicamente apenas um motivo peptídico em qualquer momento, todas essas proteínas competem pelo mesmo pool celular de moléculas de β-catenina. Essa competição é a chave para entender como funciona a via de sinalização Wnt .
No entanto, este sítio de ligação "principal" no domínio ARM β-catenina não é de forma alguma o único. As primeiras hélices do domínio ARM formam um bolso de interação proteína-proteína especial adicional: Isso pode acomodar um motivo linear de formação de hélice encontrado no coativador BCL9 (ou o BCL9L intimamente relacionado ) - uma proteína importante envolvida na sinalização Wnt . Embora os detalhes precisos sejam muito menos claros, parece que o mesmo local é usado pela alfa-catenina quando a beta-catenina está localizada nas junções aderentes. Como esta bolsa é distinta do local de ligação "principal" do domínio ARM, não há competição entre alfa-catenina e E-caderina ou entre TCF1 e BCL9, respectivamente. Por outro lado, BCL9 e BCL9L devem competir com α-catenina para acessar moléculas de β-catenina.
Função
Regulação da degradação por fosforilação
O nível celular de beta-catenina é controlado principalmente por sua ubiquitinação e degradação proteossômica . A ubiquitina ligase E3 TrCP1 (também conhecida como β-TrCP) pode reconhecer a β-catenina como seu substrato por meio de um motivo linear curto no terminal N desordenado . No entanto, este motivo (Asp-Ser-Gly-Ile-His-Ser) da β-catenina precisa ser fosforilado nas duas serinas para ser capaz de se ligar ao β-TrCP. A fosforilação do motivo é realizada por Glicogênio Sintase Quinase 3 alfa e beta (GSK3α e GSK3β). GSK3s são enzimas constitutivamente ativas implicadas em vários processos regulatórios importantes. Porém, há um requisito: os substratos de GSK3 precisam ser pré-fosforilados quatro aminoácidos a jusante (C-terminal) do local alvo real. Portanto, também requer uma "quinase de iniciação" para suas atividades. No caso da beta-catenina, a quinase de iniciação mais importante é a Caseína Quinase I (CKI). Uma vez que um substrato rico em serina-treonina tenha sido "preparado", GSK3 pode "andar" através dele da direção do terminal C para o terminal N, fosforilando cada quarto resíduo de serina ou treonina em uma fileira. Este processo resultará na fosforilação dupla do motivo de reconhecimento β-TrCP acima mencionado também.
O complexo de destruição da beta-catenina
Para que GSK3 seja uma quinase altamente eficaz em um substrato, a pré-fosforilação não é suficiente. Há um requisito adicional: semelhante às proteínas quinases ativadas por mitogênio (MAPKs), os substratos precisam se associar a essa enzima por meio de motivos de ancoragem de alta afinidade . A beta-catenina não contém tais motivos, mas uma proteína especial sim: a axina . Além disso, seu motivo de docking GSK3 é diretamente adjacente a um motivo de ligação de β-catenina. Dessa forma, a axina atua como uma verdadeira proteína-esqueleto , trazendo uma enzima (GSK3) junto com seu substrato (β-catenina) em estreita proximidade física.
Mas mesmo axin não age sozinho. Por meio de seu regulador N-terminal do domínio de sinalização da proteína G (RGS), ele recruta a proteína da polipose adenomatosa coli (APC). APC é como uma enorme "árvore de Natal": com uma infinidade de motivos de ligação de β-catenina (uma molécula de APC sozinha possui 11 desses motivos), ela pode coletar tantas moléculas de β-catenina quanto possível. APC pode interagir com várias moléculas de axina ao mesmo tempo, pois tem três motivos SAMP (Ser-Ala-Met-Pro) para ligar os domínios RGS encontrados na axina . Além disso, a axina também tem o potencial de oligomerizar por meio de seu domínio DIX C-terminal. O resultado é uma enorme montagem de proteína multimérica dedicada à fosforilação de β-catenina. Este complexo é geralmente chamado de complexo de destruição da beta-catenina , embora seja distinto da maquinaria do proteossoma realmente responsável pela degradação da β-catenina. Ele apenas marca as moléculas de β-catenina para destruição subsequente.
Sinalização Wnt e regulação da destruição
Em células em repouso, as moléculas de axina oligomerizam umas com as outras por meio de seus domínios DIX C-terminais, que têm duas interfaces de ligação. Assim, eles podem construir oligômeros lineares ou mesmo polímeros dentro do citoplasma das células. Os domínios DIX são únicos: as únicas outras proteínas conhecidas por terem um domínio DIX são Disheveled e DIXDC1 . (A única proteína Dsh de Drosophila corresponde a três genes parálogos, Dvl1 , Dvl2 e Dvl3 em mamíferos .) Dsh se associa às regiões citoplasmáticas de receptores Frizzled com seus domínios PDZ e DEP . Quando uma molécula Wnt se liga a Frizzled , induz uma cascata de eventos pouco conhecida, que resulta na exposição do domínio DIX desgrenhado e na criação de um local de ligação perfeito para a axina . Axin é então titulado longe de seus conjuntos oligoméricos - o complexo de destruição β-catenina - por Dsh . Uma vez ligada ao complexo receptor, a axina se tornará incompetente para a ligação da β-catenina e atividade GSK3. É importante ressaltar que os segmentos citoplasmáticos das proteínas LRP5 e LRP6 associadas a Frizzled contêm sequências de pseudo-substrato GSK3 (Pro-Pro-Pro-Ser-Pro-x-Ser), apropriadamente "iniciadas" (pré-fosforiladas) por CKI , como se era um verdadeiro substrato de GSK3. Estes falsos locais alvo inibem grandemente a atividade de GSK3 de uma maneira competitiva. Desta forma, a axina ligada ao receptor irá abolir a mediação da fosforilação da β-catenina. Como a beta-catenina não está mais marcada para destruição, mas continua a ser produzida, sua concentração aumentará. Quando os níveis de β-catenina aumentam o suficiente para saturar todos os locais de ligação no citoplasma, ela também se transloca para o núcleo. Ao envolver os fatores de transcrição LEF1 , TCF1 , TCF2 ou TCF3 , a β-catenina os força a se desprenderem de seus parceiros anteriores: proteínas de Groucho. Ao contrário de Groucho , que recrutam repressores transcricionais (por exemplo, histona-lisina metiltransferases ), a beta-catenina se liga a ativadores transcricionais , ativando genes-alvo.
Papel na adesão célula-célula
Os complexos de adesão célula-célula são essenciais para a formação de tecidos animais complexos. A β-catenina é parte de um complexo proteico que forma junções aderentes . Esses complexos de adesão célula-célula são necessários para a criação e manutenção de camadas e barreiras de células epiteliais . Como um componente do complexo, a β-catenina pode regular o crescimento celular e a adesão entre as células. Também pode ser responsável por transmitir o sinal de inibição de contato que faz com que as células parem de se dividir quando a camada epitelial estiver completa. O complexo E-caderina - β-catenina - α-catenina está fracamente associado aos filamentos de actina . As junções de Adherens requerem uma dinâmica significativa de proteínas para se ligarem ao citoesqueleto de actina, permitindo assim a mecanotransdução .
Um componente importante das junções aderentes são as proteínas caderinas . As caderinas formam as estruturas de junção célula-célula conhecidas como junções aderentes , bem como os desmossomos . As caderinas são capazes de interações homofílicas por meio de seus domínios de repetição extracelular de caderina , de maneira dependente de Ca2 +; isso pode manter as células epiteliais adjacentes juntas. Enquanto na junção dos aderentes , as caderinas recrutam moléculas de β-catenina em suas regiões intracelulares. A β-catenina, por sua vez, associa-se a outra proteína altamente dinâmica , a α-catenina , que se liga diretamente aos filamentos de actina . Isso é possível porque a α-catenina e as caderinas se ligam em locais distintos à β-catenina. O complexo β-catenina - α-catenina pode, portanto, formar fisicamente uma ponte entre as caderinas e o citoesqueleto de actina . A organização do complexo caderina-catenina é regulada adicionalmente por meio da fosforilação e endocitose de seus componentes.
Funções em desenvolvimento
A beta-catenina tem papel central no direcionamento de diversos processos de desenvolvimento, pois pode ligar-se diretamente a fatores de transcrição e ser regulada por uma substância extracelular difusível: Wnt . Ele atua sobre os embriões iniciais para induzir regiões inteiras do corpo, bem como células individuais em estágios posteriores de desenvolvimento. Também regula os processos de regeneração fisiológica.
Padronização embrionária inicial
A sinalização Wnt e a expressão do gene dependente da beta-catenina desempenham um papel crítico durante a formação de diferentes regiões do corpo no embrião inicial. Embriões modificados experimentalmente que não expressam esta proteína não conseguirão desenvolver mesoderme e iniciar a gastrulação . Durante os estágios de blástula e gástrula, as vias Wnt , bem como BMP e FGF irão induzir a formação do eixo ântero-posterior, regular a colocação precisa da linha primitiva (gastrulação e formação do mesoderma), bem como o processo de neurulação (desenvolvimento do sistema nervoso central )
Em oócitos de Xenopus , a β-catenina está inicialmente localizada igualmente em todas as regiões do ovo, mas é direcionada para ubiquitinação e degradação pelo complexo de destruição da β-catenina. Fertilização do ovo causa uma rotação das camadas corticais exteriores, movendo os aglomerados de Frizzled e Dsh proteínas mais perto da região equatorial. A β-catenina será enriquecida localmente sob a influência da via de sinalização Wnt nas células que herdam esta porção do citoplasma. Ele acabará por se translocar para o núcleo para se ligar a TCF3 , a fim de ativar vários genes que induzem as características das células dorsais. Essa sinalização resulta em uma região de células conhecida como crescente cinza, que é um organizador clássico do desenvolvimento embrionário. Se essa região for removida cirurgicamente do embrião, a gastrulação não ocorre. A β-catenina também desempenha um papel crucial na indução do lábio do blastóporo , que por sua vez inicia a gastrulação . A inibição da tradução de GSK-3 por injeção de mRNA antisense pode causar a formação de um segundo blastóporo e de um eixo corporal supérfluo. Um efeito semelhante pode resultar da superexpressão de β-catenina.
Divisão celular assimétrica
A beta-catenina também foi implicada na regulação do destino celular por meio da divisão celular assimétrica no organismo modelo C. elegans . Da mesma forma para os Xenopus oócitos, este é essencialmente o resultado de não distribuição igual de Dsh , Frizzled , axina e APC no citoplasma da célula mãe.
Renovação de células-tronco
Um dos resultados mais importantes da sinalização Wnt e do nível elevado de beta-catenina em certos tipos de células é a manutenção da pluripotência . Em outros tipos de células e estágios de desenvolvimento, a β-catenina pode promover a diferenciação , especialmente para linhagens de células mesodérmicas .
Transição epitelial para mesenquimal
A beta-catenina também atua como morfogênio em estágios posteriores do desenvolvimento embrionário. Juntamente com o TGF-β , um papel importante da β-catenina é induzir uma alteração morfogênica nas células epiteliais. Isso os induz a abandonar sua forte adesão e assumir um fenótipo mesenquimal mais móvel e vagamente associado . Durante esse processo, as células epiteliais perdem a expressão de proteínas como E-caderina , Zonula occludens 1 (ZO1) e citoqueratina . Ao mesmo tempo, eles ativam a expressão de vimentina , alfa actina de músculo liso (ACTA2) e proteína 1 específica de fibroblasto (FSP1). Eles também produzem componentes da matriz extracelular, como colágeno tipo I e fibronectina . A ativação aberrante da via Wnt tem sido implicada em processos patológicos como fibrose e câncer. No desenvolvimento do músculo cardíaco , a beta-catenina desempenha um papel bifásico. Inicialmente, a ativação de Wnt / beta-catenina é essencial para comprometer as células mesenquimais a uma linhagem cardíaca; no entanto, em estágios posteriores de desenvolvimento, a regulação negativa da beta-catenina é necessária.
Envolvimento na fisiologia cardíaca
No músculo cardíaco , a beta-catenina forma um complexo com a N-caderina nas junções aderentes dentro das estruturas discais intercaladas , que são responsáveis pelo acoplamento elétrico e mecânico das células cardíacas adjacentes. Estudos em um modelo de cardiomiócitos ventriculares de ratos adultos mostraram que o aparecimento e a distribuição da beta-catenina são regulados espaço-temporalmente durante a rediferenciação dessas células em cultura. Especificamente, a beta-catenina é parte de um complexo distinto com N-caderina e alfa-catenina , que é abundante nas junções aderentes em estágios iniciais após o isolamento de cardiomiócitos para a reforma de contatos célula-célula. Foi demonstrado que a beta-catenina forma um complexo com a emerina nos cardiomiócitos nas junções aderentes dentro dos discos intercalados ; e esta interação é dependente da presença de locais de fosforilação GSK 3-beta na beta-catenina. A eliminação da emerina alterou significativamente a localização da beta-catenina e a arquitetura geral do disco intercalado , que se assemelhava a um fenótipo de cardiomiopatia dilatada .
Em modelos animais de doença cardíaca , as funções da beta-catenina foram reveladas. Em um modelo de cobaia de estenose aórtica e hipertrofia ventricular esquerda , a beta-catenina mostrou alterar a localização subcelular de discos intercalados para o citosol , apesar de não haver alteração na abundância celular geral de beta-catenina. vinculina mostrou um perfil de mudança semelhante. A N-caderina não apresentou alteração e não houve supra-regulação compensatória da placoglobina em discos intercalados na ausência de beta-catenina. Em um modelo de hamster de cardiomiopatia e insuficiência cardíaca , as adesões célula-célula eram irregulares e desorganizadas, e os níveis de expressão de junção aderente / disco intercalado e pools nucleares de beta-catenina foram reduzidos. Esses dados sugerem que a perda de beta-catenina pode desempenhar um papel nos discos intercalados doentes que têm sido associados à hipertrofia do músculo cardíaco e à insuficiência cardíaca . Em um modelo de infarto do miocárdio em ratos , a transferência de genes adenovirais de beta-catenina não fosforilável e constitutivamente ativa diminuiu o tamanho do IM, ativou o ciclo celular e reduziu a quantidade de apoptose em cardiomiócitos e miofibroblastos cardíacos . Este achado foi coordenado com a expressão aumentada de proteínas pró-sobrevivência, survivina e Bcl-2 , e fator de crescimento endotelial vascular , promovendo a diferenciação de fibroblastos cardíacos em miofibroblastos . Esses achados sugerem que a beta-catenina pode promover o processo de regeneração e cura após o infarto do miocárdio . Em um modelo de rato com insuficiência cardíaca espontaneamente hipertensiva , os investigadores detectaram um deslocamento de beta-catenina do disco intercalado / sarcolema para o núcleo , evidenciado por uma redução da expressão de beta-catenina na fração de proteína de membrana e um aumento na fração nuclear. Além disso, eles encontraram um enfraquecimento na associação entre glicogênio sintase quinase-3β e beta-catenina, o que pode indicar estabilidade alterada da proteína. Em geral, os resultados sugerem que uma localização nuclear aumentada de beta-catenina pode ser importante na progressão da hipertrofia cardíaca .
Com relação ao papel mecanicista da beta-catenina na hipertrofia cardíaca , estudos com camundongos transgênicos mostraram resultados um tanto conflitantes quanto ao fato de a regulação positiva da beta-catenina ser benéfica ou prejudicial. Um estudo recente usando um camundongo nocaute condicional que não tinha beta-catenina ou expressava uma forma não degradável de beta-catenina em cardiomiócitos reconciliou uma razão potencial para essas discrepâncias. Parece haver controle estrito sobre a localização subcelular da beta-catenina no músculo cardíaco . Os camundongos sem beta-catenina não tinham fenótipo evidente no miocárdio ventricular esquerdo ; no entanto, os camundongos que abrigam uma forma estabilizada de beta-catenina desenvolveram cardiomiopatia dilatada , sugerindo que a regulação temporal da beta-catenina por mecanismos de degradação de proteínas é crítica para o funcionamento normal da beta-catenina em células cardíacas. Em um modelo de camundongo com nocaute de uma proteína desmossomal , a placoglobina , implicada na cardiomiopatia arritmogênica do ventrículo direito , a estabilização da beta-catenina também foi aumentada, presumivelmente para compensar a perda de seu homólogo de placoglobina. Essas mudanças foram coordenadas com a ativação de Akt e inibição da glicogênio sintase quinase 3β , sugerindo mais uma vez que a estabilização anormal da beta-catenina pode estar envolvida no desenvolvimento de cardiomiopatia . Outros estudos empregando um nocaute duplo de placoglobina e beta-catenina mostraram que o nocaute duplo desenvolveu cardiomiopatia , fibrose e arritmias resultando em morte cardíaca súbita . A arquitetura do disco intercalado foi severamente prejudicada e as junções comunicantes residentes na conexina 43 foram marcadamente reduzidas. As medições do eletrocardiograma capturaram arritmias ventriculares letais espontâneas nos animais transgênicos duplos, sugerindo que as duas cateninas - beta-catenina e placoglobina são críticas e idispensáveis para o acoplamento mecânico-elétrico em cardiomiócitos .
Significado clínico
Papel na depressão
Se o cérebro de um determinado indivíduo pode ou não lidar efetivamente com o estresse e, portanto, sua suscetibilidade à depressão, depende da beta-catenina no cérebro de cada pessoa, de acordo com um estudo realizado na Escola de Medicina Icahn no Monte Sinai e publicado em 12 de novembro. 2014 na revista Nature. A sinalização de beta-catenina mais alta aumenta a flexibilidade comportamental, enquanto a sinalização de beta-catenina defeituosa leva à depressão e redução do controle do estresse.
Papel na doença cardíaca
Perfis de expressão alterados em beta-catenina foram associados a cardiomiopatia dilatada em humanos. A sobrerregulação da expressão da beta-catenina foi geralmente observada em pacientes com cardiomiopatia dilatada. Em um estudo particular, os pacientes com cardiomiopatia dilatada em estágio terminal mostraram quase que o dobro do receptor de estrogênio alfa (ER-alfa) mRNA e níveis de proteína , e a interação ER-alfa / beta-catenina, presente em discos intercalados de controle, humano não doente corações foram perdidos, sugerindo que a perda dessa interação no disco intercalado pode desempenhar um papel na progressão da insuficiência cardíaca . Juntamente com BCL9 proteínas e PYGO, coordenadas beta-catenina diferentes aspectos do desenvolvimento ouvido, e mutações em Bcl9 ou Pygo em organismos modelo - tais como o rato e peixe-zebra, - causar fenótipos que são muito semelhantes aos humanos desordens cardíacas congénitas .
Envolvimento no câncer
A beta-catenina é um proto-oncogene . Mutações desse gene são comumente encontradas em uma variedade de cânceres: no carcinoma hepatocelular primário , câncer colorretal , carcinoma ovariano , câncer de mama , câncer de pulmão e glioblastoma . Estima-se que aproximadamente 10% de todas as amostras de tecido sequenciadas de todos os cânceres exibem mutações no gene CTNNB1. A maioria dessas mutações agrupa-se em uma área minúscula do segmento N-terminal da β-catenina: o motivo de ligação β-TrCP. Mutações de perda de função deste motivo tornam essencialmente a ubiquitinilação e degradação da β-catenina impossível. Isso fará com que a β-catenina se transloque para o núcleo sem qualquer estímulo externo e conduzirá continuamente a transcrição de seus genes-alvo. Níveis aumentados de β-catenina nuclear também foram observados no carcinoma basocelular (CBC), carcinoma de células escamosas de cabeça e pescoço (HNSCC), câncer de próstata (CaP), pilomatrixoma (PTR) e meduloblastoma (MDB). Essas observações podem ou não implicar uma mutação no gene da β-catenina: outros componentes da via Wnt também podem ser defeituosos.
Mutações semelhantes também são frequentemente vistas nos motivos de recrutamento de β-catenina de APC . Mutações hereditárias de perda de função de APC causam uma condição conhecida como Polipose Adenomatosa Familiar . Os indivíduos afetados desenvolvem centenas de pólipos no intestino grosso. A maioria desses pólipos é de natureza benigna, mas têm o potencial de se transformar em câncer mortal com o passar do tempo. Mutações somáticas de APC no câncer colorretal também não são incomuns. A beta-catenina e o APC estão entre os genes principais (juntamente com outros, como K-Ras e SMAD4 ) envolvidos no desenvolvimento do câncer colorretal. O potencial da β-catenina para alterar o fenótipo anteriormente epitelial das células afetadas em um tipo invasivo semelhante ao mesênquima contribui muito para a formação de metástases.
Como um alvo terapêutico
Devido ao seu envolvimento no desenvolvimento do câncer, a inibição da beta-catenina continua a receber atenção significativa. Mas mirar no sítio de ligação em seu domínio de tatu não é a tarefa mais simples, devido à sua superfície extensa e relativamente plana. No entanto, para uma inibição eficiente, a ligação a "pontos quentes" menores dessa superfície é suficiente. Desta forma, um peptídeo helicoidal "grampeado" derivado do motivo de ligação natural β-catenina encontrado em LEF1 foi suficiente para a inibição completa da transcrição dependente de β-catenina. Recentemente, vários compostos de moléculas pequenas também foram desenvolvidos para atingir a mesma área altamente carregada positivamente do domínio ARM (CGP049090, PKF118-310, PKF115-584 e ZTM000990). Além disso, os níveis de β-catenina também podem ser influenciados pelo direcionamento de componentes a montante da via Wnt, bem como do complexo de destruição de β-catenina. O bolso de ligação N-terminal adicional também é importante para a ativação do gene alvo Wnt (necessário para o recrutamento de BCL9). Este local do domínio ARM pode ser farmacologicamente direcionado pelo ácido carnósico , por exemplo. Esse sítio "auxiliar" é outro alvo atraente para o desenvolvimento de medicamentos. Apesar da intensa pesquisa pré-clínica, nenhum inibidor de β-catenina está disponível como agente terapêutico ainda. No entanto, sua função pode ser examinada posteriormente por silenciamento de siRNA com base em uma validação independente. Outra abordagem terapêutica para reduzir o acúmulo nuclear de β-catenina é por meio da inibição da galectina-3. O inibidor da galectina-3 GR-MD-02 está atualmente passando por testes clínicos em combinação com a dose aprovada pela FDA de ipilimumabe em pacientes com melanoma avançado. As proteínas BCL9 e BCL9L têm sido propostas como alvos terapêuticos para cânceres colorretais que apresentam sinalização Wnt hiperativada , pois sua deleção não perturba a homeostase normal, mas afeta fortemente o comportamento das metástases .
Papel na síndrome do álcool fetal
A desestabilização da β-catenina pelo etanol é uma das duas vias conhecidas pelas quais a exposição ao álcool induz a síndrome do álcool fetal (a outra é a deficiência de folato induzida pelo etanol). O etanol leva à desestabilização da β-catenina por meio de uma via dependente da proteína G, em que a Fosfolipase Cβ ativada hidrolisa o fosfatidilinositol- (4,5) -bisfosfato em diacilglicerol e inositol- (1,4,5) -trifosfato. O inositol- (1,4,5) -trifosfato solúvel ativa o cálcio a ser liberado do retículo endoplasmático. Este aumento repentino no cálcio citoplasmático ativa a proteína quinase dependente de Ca2 + / calmodulina (CaMKII). O CaMKII ativado desestabiliza a β-catenina por meio de um mecanismo mal caracterizado, mas que provavelmente envolve a fosforilação da β-catenina por CaMKII. O programa de transcrição da β-catenina (que é necessário para o desenvolvimento normal das células da crista neural) é, portanto, suprimido, resultando em apoptose prematura das células da crista neural (morte celular).
Interações
Foi demonstrado que a beta-catenina interage com:
- APC ,
- AXIN1 ,
- Receptor de andrógeno ,
- CBY1 ,
- CDH1 ,
- CDH2 ,
- CDH3 ,
- CDK5R1 ,
- CHUK ,
- CTNND1 ,
- CTNNA1 ,
- EGFR ,
- Emerin
- ESR1
- FHL2 ,
- GSK3B ,
- HER2 / neu ,
- HNF4A ,
- IKK2 ,
- LEF1 ,
- MAGI1 ,
- MUC1 ,
- NR5A1 ,
- PCAF ,
- PHF17 ,
- Placoglobina ,
- PTPN14 ,
- PTPRF ,
- PTPRK (PTPkappa),
- PTPRT (PTPrho),
- PTPRU (PCP-2),
- PSEN1 ,
- PTK7
- RuvB-like 1 ,
- SMAD7 ,
- SMARCA4
- SLC9A3R1 ,
- USP9X e
- VE-caderina .
- XIRP1
Veja também
Referências
Leitura adicional
- Kikuchi A (fevereiro de 2000). Regulação da sinalização de beta-catenina na via Wnt ". Comunicações de pesquisa bioquímica e biofísica . 268 (2): 243–8. doi : 10.1006 / bbrc.1999.1860 . PMID 10679188 .
- Wilson PD (abril de 2001). "Policistina: novos aspectos de estrutura, função e regulação" . Jornal da Sociedade Americana de Nefrologia . 12 (4): 834–45. doi : 10.1681 / ASN.V124834 . PMID 11274246 .
- Kalluri R, Neilson EG (dezembro de 2003). "Transição epitelial-mesenquimal e suas implicações para a fibrose" . The Journal of Clinical Investigation . 112 (12): 1776–84. doi : 10.1172 / JCI20530 . PMC 297008 . PMID 14679171 .
- De Ferrari GV, Moon RT (dezembro de 2006). "Os altos e baixos da sinalização Wnt em distúrbios neurológicos prevalentes" . Oncogene . 25 (57): 7545–53. doi : 10.1038 / sj.onc.1210064 . PMID 17143299 .
links externos
- beta + Catenin nos títulos de assuntos médicos da Biblioteca Nacional de Medicina dos EUA (MeSH)
- "Um conjunto diversificado de proteínas modula a via de sinalização canônica Wnt / β-catenina." em cancer.gov
- "O papel da β-catenina na transdução de sinal, determinação do destino celular e trans-diferenciação" em nih.gov
- "Pesquisadores oferecem a primeira prova direta de como a artrite destrói a cartilagem" em rochester.edu
- Localização do genoma humano CTNNB1 e página de detalhes do gene CTNNB1 no navegador do genoma UCSC .
Este artigo incorpora texto da Biblioteca Nacional de Medicina dos Estados Unidos , que é de domínio público .