Proteína Scaffold - Scaffold protein
Em biologia, as proteínas-esqueleto são reguladores cruciais de muitas vias de sinalização importantes . Embora os andaimes não sejam estritamente definidos em função, eles são conhecidos por interagir e / ou se ligar a vários membros de uma via de sinalização, amarrando-os em complexos . Nessas vias, eles regulam a transdução de sinal e ajudam a localizar os componentes da via (organizados em complexos) em áreas específicas da célula, como a membrana plasmática , o citoplasma , o núcleo , o Golgi , os endossomos e as mitocôndrias .
História
A primeira proteína esqueleto de sinalização descoberta foi a proteína Ste5 da levedura Saccharomyces cerevisiae . Três domínios distintos de Ste5 mostraram se associar com as proteínas quinases Ste11 , Ste7 e Fus3 para formar um complexo de multiquinase.
Função
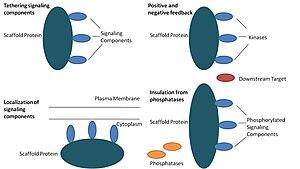
As proteínas de esqueleto atuam de pelo menos quatro maneiras: tethering de componentes de sinalização, localizando esses componentes em áreas específicas da célula, regulando a transdução de sinal coordenando os sinais de feedback positivo e negativo e isolando as proteínas de sinalização corretas das proteínas concorrentes.
Componentes de sinalização de tethering
Esta função particular é considerada a função mais básica de um andaime. Os andaimes reúnem os componentes de sinalização de uma cascata em complexos. Este conjunto pode ser capaz de aumentar a especificidade da sinalização, evitando interações desnecessárias entre as proteínas de sinalização e aumentar a eficiência da sinalização, aumentando a proximidade e a concentração eficaz de componentes no complexo de arcabouço. Um exemplo comum de como os andaimes aumentam a especificidade é um andaime que liga uma proteína quinase e seu substrato, garantindo assim a fosforilação da quinase específica. Além disso, algumas proteínas de sinalização requerem múltiplas interações para ativação e o tethering de andaime pode ser capaz de converter essas interações em uma interação que resulta em múltiplas modificações. Os andaimes também podem ser catalíticos, pois a interação com proteínas de sinalização pode resultar em alterações alostéricas desses componentes de sinalização. Tais mudanças podem aumentar ou inibir a ativação dessas proteínas sinalizadoras. Um exemplo é o andaime Ste5 na via da proteína quinase ativada por mitogênio ( MAPK ). Ste5 foi proposto para direcionar a sinalização de acasalamento através do Fus3 MAPK, desbloqueando cataliticamente esta quinase particular para ativação por seu MAPKK Ste7.
Localização de componentes de sinalização na célula
Os andaimes localizam a reação de sinalização em uma área específica da célula, um processo que pode ser importante para a produção local de intermediários de sinalização. Um exemplo particular deste processo é o andaime, proteínas âncora de A-quinase (AKAPs), que tem como alvo a proteína quinase dependente de AMP cíclico ( PKA ) para vários locais na célula. Esta localização é capaz de regular localmente a PKA e resulta na fosforilação local pela PKA de seus substratos.
Coordenando feedback positivo e negativo
Muitas hipóteses sobre como os scaffolds coordenam feedback positivo e negativo vêm de scaffolds projetados e modelagem matemática. Em cascatas de sinalização de três quinase, os andaimes ligam todas as três quinases, aumentando a especificidade da quinase e restringindo a amplificação do sinal ao limitar a fosforilação da quinase a apenas um alvo a jusante. Essas habilidades podem estar relacionadas à estabilidade da interação entre o andaime e as quinases, a atividade da fosfatase basal na célula, a localização do andaime e os níveis de expressão dos componentes de sinalização.
Isolando proteínas de sinalização corretas da inativação
As vias de sinalização são frequentemente inativadas por enzimas que revertem o estado de ativação e / ou induzem a degradação dos componentes de sinalização. Os andaimes têm sido propostos para proteger moléculas de sinalização ativadas da inativação e / ou degradação. A modelagem matemática mostrou que as quinases em uma cascata sem andaimes têm uma probabilidade maior de serem desfosforiladas por fosfatases antes mesmo de serem capazes de fosforilar alvos a jusante. Além disso, foi demonstrado que os andaimes isolam as quinases dos inibidores competitivos do substrato e do ATP.
Resumo de proteína de andaime
| Proteínas Scaffold | Caminho | Funções Potenciais | Descrição |
|---|---|---|---|
| KSR | MAPK | Montagem e localização da via RAS-ERK | Uma das vias de sinalização mais bem estudadas em biologia é a via RAS-ERK na qual a proteína G RAS ativa o MAPKKK RAF , que ativa a MAPKK MEK1 (MAPK / ERK quinase 1), que então ativa a MAPK ERK . Várias proteínas-esqueleto foram identificadas como estando envolvidas nesta via e em outras vias MAPK semelhantes. Uma dessas proteínas-esqueleto é KSR, que é o equivalente mais provável da proteína-esqueleto de MAPK de levedura bem estudada Ste5. É um regulador positivo da via e se liga a muitas proteínas da via, incluindo todas as três quinases da cascata. Foi demonstrado que o KSR está localizado na membrana plasmática durante a ativação celular, desempenhando assim um papel na montagem dos componentes da via ERK e na localização do ERK ativado na membrana plasmática. |
| MEKK1 | MAPK | Montagem e localização do sinalossomo do receptor de morte | Outras proteínas-esqueleto incluem linfoma de células B 10 ( BCL-10 ) e MEK quinase 1 ( MEKK1 ), que têm papéis na via da JUN N-terminal quinase ( JNK ). |
| BCL-10 | MAPK | Montagem e especificidade do JNK | |
| AKAP | Vias PKA | Coordenação da fosforilação por PKA em alvos a jusante | Esta família de proteínas está apenas estruturalmente relacionada em sua capacidade de se ligar à subunidade reguladora de PKA, mas pode se ligar a um conjunto muito diverso de enzimas e substratos |
| AHNAK-1 | Sinalização de cálcio | Montagem e localização de canais de cálcio | A sinalização do cálcio é essencial para o funcionamento adequado das células do sistema imunológico. Estudos recentes demonstraram que a proteína-esqueleto, AHNAK1, é importante para a sinalização de cálcio eficiente e ativação de NFAT em células T por meio de sua capacidade de localizar adequadamente os canais de cálcio na membrana plasmática [14]. Em células não imunes, AHNAK1 também demonstrou ligar canais de cálcio com fosfolipase Cγ ( PLC-γ ) e PKC . As proteínas de ligação ao cálcio freqüentemente extinguem grande parte do cálcio que entra, portanto, a ligação desses efetores de cálcio pode ser especialmente importante quando os sinais são induzidos por um influxo fraco de cálcio. |
| HOMER | Sinalização de cálcio | Inibição da ativação do NFAT | Outro exemplo de proteína-esqueleto que modula a sinalização de cálcio são as proteínas da família HOMER. Foi demonstrado que as proteínas HOMER competem com a calcineurina para se ligar ao terminal N de NFAT em células T ativadas. Por meio dessa competição, as proteínas HOMER são capazes de reduzir a ativação do NFAT, o que também reduz a produção da citocina IL-2 . Em contraste, as proteínas HOMER também mostraram regular positivamente a sinalização de cálcio nos neurônios, ligando o receptor de glutamato com receptores de trifosfato no retículo endoplasmático. |
| Pellino | Sinalização imunológica inata | Montagem do sinalossomo TLR | Existem evidências de que as proteínas Pellino funcionam como proteínas-esqueleto na importante via de sinalização imune inata, a via do receptor Toll-like ( TLR ). Grande parte da função Pellino é especulação; no entanto, as proteínas Pellino podem se associar com IRAK1, TRAF6 e TAK1 após a ativação de IL-1R, indicando que elas podem montar e localizar componentes da via de TLR perto de seu receptor. |
| PNL | Sinalização imunológica inata | Montagem do inflamassoma | A família NLR é uma família grande e altamente conservada de receptores envolvidos na imunidade inata. A família de receptores NLRP (família NLR, contendo domínio de pirina) funciona como arcabouço ao montar o inflamassoma, um complexo que leva à secreção de citocinas pró-inflamatórias, como IL-18 e IL-1β. |
| DLG1 | Sinalização de receptor de célula T | Montagem e localização de moléculas de sinalização de TCR, ativação de p38 | DLG1 é altamente conservado em células do sistema imunológico e é importante para a ativação de células T na periferia. É recrutado para a sinapse imunológica e liga a cadeia ζ do receptor de células T ( TCR ) a CBL, WASP, p38, LCK, VAV1 e ZAP70. Estes dados sugerem que DLG1 desempenha um papel na ligação da maquinaria de sinalização de TCR com reguladores do citoesqueleto e também sugere um papel na ativação alternativa da via p38. No entanto, não está claro se DLG1 regula positiva ou negativamente a ativação de células T. |
| Spinofilina | Sinalização de células dendríticas | Montagem de proteínas de sinapse imunológica DC | A espinofilina está envolvida na função das células dendríticas , especificamente na formação de sinapses imunológicas. A espinofilina é recrutada para a sinapse após o contato da célula dendrítica com uma célula T. Esse recrutamento parece ser importante porque, sem a espinofilina, as células dendríticas não podem ativar as células T in vitro ou in vivo . Como a espinofilina facilita a apresentação do antígeno, neste caso, ainda é desconhecido, embora seja possível que a espinofilina regule a duração do contato celular na sinapse ou regule a reciclagem de moléculas coestimulatórias na célula como as moléculas de MHC. |
| Proteína reguladora da FLU da planta | Coordenação do feedback negativo durante a biossíntese de protoclorofilida . | Montagem e localização da via que se transforma a síntese de altamente tóxico protochlorophyllide , um precursor de clorofila . | A síntese de protoclorofilida deve ser estritamente regulada, pois sua conversão em clorofila requer luz. A proteína reguladora da FLU está localizada na membrana do tilacóide e contém apenas vários locais de interação proteína-proteína sem atividade catalítica. Mutantes sem essa proteína superacumulam a protoclorofilida no escuro. Os parceiros de interação são desconhecidos. A proteína foi simplificada durante a evolução. |
Proteína Huntingtina
A proteína Huntingtin co-localiza-se com a proteína de reparo ATM em locais de dano ao DNA . A Huntingtina é uma proteína de arcabouço no complexo de resposta ao dano oxidativo ao DNA da ATM. Pacientes com doença de Huntington com proteína huntingtina aberrante são deficientes no reparo do dano oxidativo ao DNA . O dano oxidativo ao DNA parece ser a base da patogênese da doença de Huntington . A doença de Huntington é provavelmente causada pela disfunção da proteína esqueleto da huntingtina mutante no reparo do DNA, levando ao aumento do dano oxidativo ao DNA em células metabolicamente ativas.
Outro uso do termo Scaffold Protein
Em alguns outros casos em biologia (não necessariamente sobre sinalização celular), o termo "proteína de andaime" é usado em um sentido mais amplo, onde uma proteína mantém várias coisas juntas para qualquer propósito.
- No dobramento de cromossomos
- O arcabouço cromossômico tem um papel importante para manter a cromatina no cromossomo compacto . O esqueleto do cromossomo é feito de proteínas, incluindo condensina , topoisomerase IIα e membro da família da cinesina 4 (KIF4). As proteínas constituintes do esqueleto do cromossomo também são chamadas de proteína do esqueleto.
- Na reação enzimática
- Enzimas multifuncionais grandes que executam uma série ou cadeia de reações em uma via comum, às vezes chamadas de proteínas-esqueleto. como piruvato desidrogenase.
- Na formação da forma da molécula
- Enzima ou proteína estrutural que mantém várias moléculas juntas para mantê-las em um arranjo espacial adequado, como as proteínas-esqueleto do cluster de enxofre de ferro.
- Andaime estrutural
- No citoesqueleto e na ECM , as moléculas fornecem uma estrutura mecânica. Como o colágeno tipo 4