Fosfolipase C - Phospholipase C

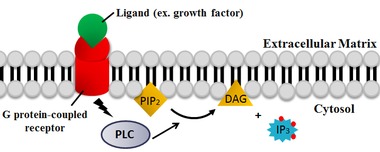
A fosfolipase C ( PLC ) é uma classe de enzimas associadas à membrana que clivam os fosfolipídios imediatamente antes do grupo fosfato (veja a figura). É mais comumente considerada como sinônimo das formas humanas dessa enzima, que desempenha um papel importante na fisiologia das células eucarióticas , em particular nas vias de transdução de sinal . O papel da fosfolipase C na transdução de sinal é a clivagem do fosfatidilinositol 4,5-bifosfato (PIP 2 ) em diacilglicerol (DAG) e inositol 1,4,5-trifosfato (IP 3 ), que servem como segundos mensageiros . Os ativadores de cada PLC variam, mas normalmente incluem subunidades heterotriméricas da proteína G , proteína tirosina quinases , pequenas proteínas G , Ca 2+ e fosfolipídios.
Existem treze tipos de fosfolipase C de mamífero que são classificados em seis isotipos (β, γ, δ, ε, ζ, η) de acordo com a estrutura. Cada PLC possui controles únicos e sobrepostos sobre a expressão e distribuição subcelular.
Variantes
Variantes de mamíferos
O extenso número de funções exercidas pela reação do PLC requer que seja estritamente regulado e capaz de responder a múltiplas entradas extra e intracelulares com cinética apropriada. Essa necessidade norteou a evolução de seis isotipos de PLC em animais, cada um com um modo distinto de regulação. O pré-mRNA de PLC também pode ser sujeito a splicing diferencial de modo que um mamífero possa ter até 30 enzimas de PLC.
- beta: PLCB1 , PLCB2 , PLCB3 , PLCB4
- gama: PLCG1 , PLCG2
- delta: PLCD1 , PLCD3 , PLCD4
- epsilon: PLCE1
- eta: PLCH1 , PLCH2
- zeta: PLCZ1
- fosfolipase C semelhante: PLCL1 , PLCL2
Variantes bacterianas
A maioria das variantes bacterianas da fosfolipase C são caracterizadas em um de quatro grupos de proteínas estruturalmente relacionadas. As fosfolipases C tóxicas são capazes de interagir com as membranas celulares eucarióticas e hidrolisar a fosfatidilcolina e a esfingomielina, levando à lise celular.
- Metalofosfolipases C de zinco: alfa-toxina de Clostridium perfringens , Bacillus cereus PLC (BC-PLC)
- Esfingomielinases: B. cereus , Staphylococcus aureus
- Enzimas de hidrólise de fosfatidilinositol: B. cereus , B. thuringiensis , L. monocytogenes (PLC-A)
- Pseudomonas Fosfolipases C: Pseudomonas aeruginosa (PLC-H e PLC-N)
Estrutura da enzima

Em mamíferos, os PLCs compartilham uma estrutura central conservada e diferem em outros domínios específicos para cada família. A enzima central inclui um barril de triosefosfato isomerase (TIM) dividido , domínio de homologia de pleckstrina (PH) , quatro domínios de mão EF em tandem e um domínio C2 . O cilindro TIM contém o sítio ativo, todos os resíduos catalíticos e um sítio de ligação de Ca 2+ . Ele tem uma inserção autoinibitória que interrompe sua atividade chamada de vinculador XY. Foi demonstrado que o linker XY oclui o sítio ativo e, com sua remoção, o PLC é ativado.
Os genes que codificam a alfa-toxina ( Clostridium perfringens ) , Bacillus cereus PLC (BC-PLC) e PLCs de Clostridium bifermentans e Listeria monocytogenes foram isolados e os nucleotídeos sequenciados. Existe homologia significativa das sequências, aproximadamente 250 resíduos, do terminal N. A alfa-toxina possui 120 resíduos adicionais no terminal C. O terminal C da alfa-toxina foi relatado como um domínio "semelhante a C2", referenciando o domínio C2 encontrado em eucariotos que estão envolvidos na transdução de sinal e presentes na fosfoinositídeo fosfolipase C de mamífero .
Mecanismo de enzima
A reação catalisada primária de PLC ocorre em um substrato insolúvel em uma interface lípido-água. Os resíduos no sítio ativo são conservados em todos os isotipos de PLC. Em animais, o PLC catalisa seletivamente a hidrólise do fosfolipídeo fosfatidilinositol 4,5-bifosfato (PIP 2 ) no lado do glicerol da ligação fosfodiéster. Ocorre a formação de um intermediário fracamente ligado à enzima, o inositol 1,2-fosfodiéster cíclico, e a liberação de diacilglicerol (DAG) . O intermediário é então hidrolisado em inositol 1,4,5-trisfosfato (IP 3 ) . Assim, os dois produtos finais são DAG e IP 3 . A catálise ácido / base requer dois resíduos de histidina conservados e um íon Ca 2+ é necessário para a hidrólise PIP 2 . Foi observado que o Ca 2+ do sítio ativo se coordena com quatro resíduos ácidos e se algum dos resíduos sofre mutação, então uma concentração maior de Ca 2+ é necessária para a catálise.
Regulamento
Ativação
Os receptores que ativam esta via são principalmente receptores acoplados à proteína G acoplados à subunidade G αq , incluindo:
- Receptores serotonérgicos 5-HT 2
- Receptores adrenérgicos α 1 (Alfa-1)
- Receptores de calcitonina
- Receptores de histamina H 1
- Receptores metabotrópicos de glutamato , Grupo I
- Receptores muscarínicos M 1 , M 3 e M 5
- Receptor de hormônio liberador da tireóide na glândula pituitária anterior
Outros ativadores menores que G αq são:
- MAP quinase . Os ativadores desta via incluem PDGF e FGF .
- βγ-complexo de proteínas G heterotriméricas , como numa via de menor importância de crescimento da hormona de libertação de hormona de crescimento de libertação da hormona .
- Receptores canabinóides
Inibição
- Molécula pequena U73122: aminoesteróide, suposto inibidor de PLC. No entanto, a especificidade do U73122 foi questionada. Foi relatado que o U73122 ativa a atividade da fosfolipase de PLCs purificados.
- Edelfosina : semelhante a lipídios, agente antineoplásico (ET-18-OCH3)
- Autoinibição do ligante XY em células de mamíferos: Propõe-se que o ligante XY consista em longos trechos de aminoácidos ácidos que formam áreas densas de carga negativa. Essas áreas podem ser repelidas pela membrana carregada negativamente após a ligação do PLC aos lipídios da membrana. A combinação de repulsão e restrições estéricas é pensada para remover o ligante XY de perto do local ativo e aliviar a auto-inibição.
- Os compostos contendo o esqueleto do ácido morfolinobenzóico pertencem a uma classe de inibidores de PLC específicos de fosfatidilcolina semelhantes a drogas
- o- fenantrolina: composto orgânico heterocíclico, conhecido por inibir metaloenzimas de zinco
- EDTA: molécula que quela os íons Zn 2+ e efetivamente inativa o PLC, conhecido por inibir metaloenzimas de zinco
Função biológica
PLC cliva o fosfolipídeo fosfatidilinositol 4,5-bifosfato (PIP 2 ) em diacilglicerol (DAG) e inositol 1,4,5-trisfosfato (IP 3 ). Assim, o PLC tem um impacto profundo na depleção de PIP 2 , que atua como uma âncora de membrana ou regulador alostérico e um agonista para muitos canais de íons controlados por lipídios . O PIP 2 também atua como substrato para a síntese do mais raro lipídio fosfatidilinositol 3,4,5-trifosfato (PIP 3 ) , responsável pela sinalização em múltiplas reações. Portanto, a depleção de PIP 2 pela reação de PLC é crítica para a regulação das concentrações locais de PIP 3 na membrana plasmática e na membrana nuclear.
Os dois produtos da reação catalisada por PLC, DAG e IP 3 , são segundos mensageiros importantes que controlam diversos processos celulares e são substratos para a síntese de outras moléculas importantes de sinalização. Quando o PIP 2 é clivado, o DAG permanece ligado à membrana e o IP 3 é liberado como uma estrutura solúvel no citosol . O IP 3 então se difunde através do citosol para se ligar aos receptores IP 3 , particularmente os canais de cálcio no retículo endoplasmático liso (RE). Isso faz com que a concentração citosólica de cálcio aumente, causando uma cascata de alterações e atividades intracelulares. Além disso, o cálcio e o DAG juntos atuam para ativar a proteína quinase C , que passa a fosforilar outras moléculas, levando à alteração da atividade celular. Os efeitos finais incluem sabor, promoção de tumor, bem como exocitose de vesícula, produção de superóxido a partir de NADPH oxidase e ativação de JNK .
Tanto o DAG quanto o IP 3 são substratos para a síntese de moléculas regulatórias. O DAG é o substrato para a síntese do ácido fosfatídico , uma molécula reguladora. IP 3 é o substrato limitante da taxa para a síntese de polifosfatos de inositol, que estimulam várias proteínas quinases, transcrição e processamento de mRNA. A regulação da atividade PLC é, portanto, vital para a coordenação e regulação de outras enzimas de vias que são centrais para o controle da fisiologia celular.
Além disso, a fosfolipase C desempenha um papel importante na via da inflamação. A ligação de agonistas, como trombina , epinefrina ou colágeno , aos receptores de superfície das plaquetas pode desencadear a ativação da fosfolipase C para catalisar a liberação de ácido araquidônico de dois principais fosfolipídios de membrana, fosfatidilinositol e fosfatidilcolina . O ácido araquidônico pode então seguir para a via da ciclooxigenase (produzindo prostoglandinas (PGE1, PGE2, PGF2), prostaciclinas (PGI2) ou tromboxanos (TXA2)) e a via da lipoxigenase (produção de leucotrienos (LTB4, LTC4, LTD4, LTE4)) .
A variante bacteriana Clostridium perfringens tipo A produz alfa-toxina. A toxina tem atividade de fosfolipase C e causa hemólise , letalidade e dermonecrose. Em altas concentrações, a alfa-toxina induz degradação maciça de fosfatidilcolina e esfingomielina , produzindo diacilglicerol e ceramida , respectivamente. Essas moléculas então participam das vias de transdução de sinal. Foi relatado que a toxina ativa a cascata do ácido araquidônico em aorta isolada de ratos. A contração induzida pela toxina foi relacionada à geração de tromboxano A 2 a partir do ácido araquidônico. Assim, é provável que o PLC bacteriano imite as ações do PLC endógeno nas membranas das células eucarióticas.
Veja também
- Glicosilfosfatidilinositol diacilglicerol-liase EC 4.6.1.14 Enzima tripanossomal.
- Fosfatidilinositol diacilglicerol-liase EC 4.6.1.13 Outra enzima bacteriana relacionada
- Fosfoinositídeo fosfolipase C EC 3.1.4.11 Principal forma encontrada em eucariotos, especialmente mamíferos.
- Família da fosfolipase C dependente de zinco de enzimas bacterianas EC 3.1.4.3 que inclui as toxinas alfa de C. perfringens (também conhecido como lecitinase ), P. aeruginosa e S. aureus .