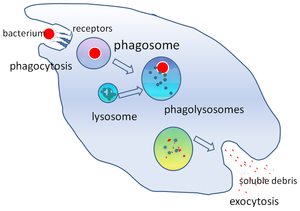
Fagossomo - Phagosome
Em biologia celular , um fagossomo é uma vesícula formada em torno de uma partícula engolfada por um fagócito via fagocitose . Os fagócitos profissionais incluem macrófagos , neutrófilos e células dendríticas (DCs). Um fagossoma é formado pela fusão da membrana celular em torno de um microrganismo , uma célula senescente ou uma célula apoptótica . Os fagossomos têm proteínas ligadas à membrana para recrutar e fundir-se com os lisossomos para formar fagolisossomos maduros . Os lisossomos contêmenzimas hidrolíticas e espécies reativas de oxigênio (ROS) que matam e digerem os patógenos . Os fagossomos também podem se formar em fagócitos não profissionais, mas podem envolver apenas uma gama menor de partículas e não contêm ROS. Os materiais úteis (por exemplo, aminoácidos ) das partículas digeridas são movidos para o citosol e os resíduos são removidos por exocitose . A formação de fagossoma é crucial para a homeostase do tecido e para a defesa inata e adaptativa do hospedeiro contra patógenos.
No entanto, algumas bactérias podem explorar a fagocitose como estratégia de invasão. Eles se reproduzem dentro do fagolisossomo (por exemplo, Coxiella spp.) Ou escapam para o citoplasma antes que o fagossomo se funda com o lisossoma (por exemplo, Rickettsia spp.). Muitas micobactérias, incluindo Mycobacterium tuberculosis e Mycobacterium avium paratuberculosis , podem manipular o macrófago hospedeiro para evitar que os lisossomos se fundam com os fagossomas e criem fagolisossomos maduros. Essa maturação incompleta do fagossomo mantém um ambiente favorável aos patógenos dentro dele.
Formação
Os fagossomas são grandes o suficiente para degradar bactérias inteiras ou células apoptóticas e senescentes, que geralmente têm> 0,5 µm de diâmetro. Isso significa que um fagossoma é várias ordens de magnitude maior do que um endossomo , que é medido em nanômetros .
Os fagossomos são formados quando os patógenos ou opsoninas se ligam a um receptor transmembrana, que é distribuído aleatoriamente na superfície da célula do fagócito. Após a ligação, a sinalização "de fora para dentro" desencadeia a polimerização de actina e a formação de pseudópodes , que envolve e se funde atrás do microorganismo. Proteína quinase C , fosfoinositídeo 3-quinase e fosfolipase C (PLC) são todos necessários para sinalizar e controlar a internalização de partículas. Mais receptores de superfície celular podem se ligar à partícula em um mecanismo semelhante a um zíper conforme o patógeno é circundado, aumentando a avidez de ligação . O receptor Fc (FcR), os receptores do complemento (CR), o receptor de manose e a Dectina-1 são receptores fagocíticos, o que significa que podem induzir a fagocitose se forem expressos em células não fagocíticas, como os fibroblastos . Outras proteínas, como os receptores Toll-like, estão envolvidas no reconhecimento do padrão do patógeno e são frequentemente recrutadas para os fagossomos, mas não ativam especificamente a fagocitose em células não fagocíticas, portanto, não são consideradas receptores fagocíticos.
Oponização
Opsoninas são marcadores moleculares, como anticorpos e complementos que se ligam a patógenos e regulam positivamente a fagocitose. A imunoglobulina G (IgG) é o principal tipo de anticorpo presente no soro . Faz parte do sistema imunológico adaptativo , mas se liga à resposta inata ao recrutar macrófagos para fagocitar os patógenos. O anticorpo se liga a micróbios com o domínio Fab variável , e o domínio Fc se liga aos receptores Fc (FcR) para induzir a fagocitose.
A internalização mediada pelo complemento tem saliências de membrana muito menos significativas, mas a sinalização a jusante de ambas as vias converge para ativar as Rho GTPases . Eles controlam a polimerização da actina, que é necessária para o fagossoma se fundir com endossomos e lisossomas.
Células não fagocíticas
Outros fagócitos não profissionais têm algum grau de atividade fagocítica, como células epiteliais da tireoide e da bexiga que podem envolver eritrócitos e células epiteliais retinais que internalizam os bastonetes retinais. No entanto, os fagócitos não profissionais não expressam receptores fagocíticos específicos, como FcR, e têm uma taxa de internalização muito mais baixa.
Algumas bactérias invasivas também podem induzir a fagocitose em células não fagocíticas para mediar a captação pelo hospedeiro. Por exemplo, Shigella pode secretar toxinas que alteram o citoesqueleto do hospedeiro e entram no lado basolateral dos enterócitos .
Estrutura
Como a membrana do fagossomo é formada pela fusão da membrana plasmática, a composição básica da bicamada fosfolipídica é a mesma. Endossomos e lisossomos então se fundem com o fagossomo para contribuir para a membrana, especialmente quando a partícula envolvida é muito grande, como um parasita . Eles também entregam várias proteínas de membrana ao fagossoma e modificam a estrutura da organela.
Os fagossomas podem envolver grânulos de látex de baixa densidade artificiais e então purificados ao longo de um gradiente de concentração de sacarose , permitindo que a estrutura e a composição sejam estudadas. Ao purificar os fagossomas em diferentes pontos de tempo, o processo de maturação também pode ser caracterizado. Os fagossomas iniciais são caracterizados por Rab5, que faz a transição para Rab7 conforme a vesícula amadurece em fagossomas tardios.
Processo de maturação
O fagossoma nascente não é inerentemente bactericida. À medida que amadurece, torna-se mais ácido de pH 6,5 a pH 4 e ganha marcadores de proteína e enzimas hidrolíticas características. As diferentes enzimas funcionam em vários pHs ideais, formando uma faixa para que cada uma trabalhe em estágios estreitos do processo de maturação. A atividade da enzima pode ser ajustada modificando o nível de pH, permitindo maior flexibilidade. O fagossoma se move ao longo dos microtúbulos do citoesqueleto , fundindo-se com os endossomos e lisossomos sequencialmente de uma maneira dinâmica de "beijo e corrida" . Este transporte intracelular depende do tamanho dos fagossomas. Organelas maiores (com um diâmetro de cerca de 3 μm) são transportadas muito persistentemente da periferia da célula em direção à região perinuclear, enquanto organelas menores (com um diâmetro de cerca de 1 μm) são transportadas mais bidirecionalmente para frente e para trás entre o centro celular e a periferia celular. Bombas de prótons vacuolares (v-ATPase) são entregues ao fagossoma para acidificar o compartimento da organela, criando um ambiente mais hostil para patógenos e facilitando a degradação de proteínas. As proteínas bacterianas são desnaturadas em pH baixo e tornam-se mais acessíveis às proteases, que não são afetadas pelo ambiente ácido. As enzimas são posteriormente recicladas do fagolisossomo antes da egestão, para que não sejam desperdiçadas. A composição da membrana fosfolipídica também muda à medida que o fagossomo amadurece.
A fusão pode levar de minutos a horas, dependendo do conteúdo do fagossomo; A fusão mediada por FcR ou receptor de manose dura menos de 30 minutos, mas os fagossomas contendo grânulos de látex podem levar várias horas para se fundir com os lisossomas. É sugerido que a composição da membrana do fagossomo afeta a taxa de maturação. O Mycobacterium tuberculosis tem uma parede celular muito hidrofóbica , que se supõe prevenir a reciclagem da membrana e o recrutamento de fatores de fusão, de modo que o fagossomo não se funde com os lisossomos e a bactéria evita a degradação.
Moléculas menores do lúmen são transferidas por fusão mais rápido do que moléculas maiores, o que sugere que um pequeno canal aquoso se forma entre o fagossomo e outras vesículas durante o "beijo e corrida", através do qual apenas uma troca limitada é permitida.
Regulamento de fusão
Logo após a internalização, a F-actina despolimeriza do fagossomo recém-formado, tornando-se acessível aos endossomos para fusão e liberação de proteínas. O processo de maturação é dividido em estágios iniciais e finais dependendo de marcadores protéicos característicos, regulados por pequenas Rab GTPases. Rab5 está presente em fagossomas iniciais e controla a transição para fagossomas tardios marcados por Rab7.
Rab5 recruta PI-3 quinase e outras proteínas de amarração, como Vps34, para a membrana do fagossoma, de modo que os endossomos podem entregar proteínas ao fagossomo. Rab5 está parcialmente envolvido na transição para Rab7, por meio do complexo CORVET e do complexo HOPS na levedura. A via de maturação exata em mamíferos não é bem compreendida, mas sugere-se que HOPS pode ligar Rab7 e deslocar o inibidor de dissociação de nucleotídeo de guanosina (GDI). Rab11 está envolvido na reciclagem de membrana.
Fagolisossomo
O fagossomo se funde com os lisossomas para formar um fagolisossomo, que possui várias propriedades bactericidas. O fagolisossomo contém espécies reativas de oxigênio e nitrogênio (ROS e RNS) e enzimas hidrolíticas. O compartimento também é ácido devido às bombas de prótons (v-ATPases) que transportam H + através da membrana, usadas para desnaturar as proteínas bacterianas.
As propriedades exatas dos fagolisossomos variam dependendo do tipo de fagócito. Aqueles em células dendríticas têm propriedades bactericidas mais fracas do que aqueles em macrófagos e neutrófilos. Além disso, os macrófagos são divididos em pró-inflamatórios "matadores" M1 e "reparadores" M2. Os fagolisossomos de M1 podem metabolizar arginina em óxido nítrico altamente reativo , enquanto M2 usa arginina para produzir ornitina para promover a proliferação celular e o reparo de tecidos.
Função
Degradação de patógenos
Macrófagos e neutrófilos são fagócitos profissionais responsáveis pela maior parte da degradação do patógeno, mas possuem métodos bactericidas diferentes. Os neutrófilos possuem grânulos que se fundem com o fagossoma. Os grânulos contêm NADPH oxidase e mieloperoxidase , que produzem derivados tóxicos de oxigênio e cloro para matar os patógenos em uma explosão oxidativa . Proteases e peptídeos antimicrobianos também são liberados no fagolisossomo. Os macrófagos não têm grânulos e dependem mais da acidificação dos fagolisossomos, das glicosidases e das proteases para digerir os micróbios. Os fagossomas em células dendríticas são menos ácidos e têm atividade hidrolítica muito mais fraca, devido à menor concentração de proteases lisossomais e até mesmo à presença de inibidores de protease.
Inflamação
A formação de fagossoma está ligada à inflamação por meio de moléculas de sinalização comuns. A PI-3 quinase e o PLC estão envolvidos no mecanismo de internalização e no desencadeamento da inflamação. As duas proteínas, juntamente com as Rho GTPases, são componentes importantes da resposta imune inata, induzindo a produção de citocinas e ativando a cascata de sinalização da MAP quinase . Citocinas pró-inflamatórias, incluindo IL-1β , IL-6 , TNFα e IL-12, são todas produzidas.
O processo é rigidamente regulado e a resposta inflamatória varia dependendo do tipo de partícula dentro do fagossomo. As células apoptóticas infectadas por patógenos desencadeiam a inflamação, mas as células danificadas que são degradadas como parte da renovação do tecido normal não. A resposta também difere de acordo com a fagocitose mediada por opsonina. As reações mediadas pelo receptor de manose e FcR produzem espécies reativas pró-inflamatórias de oxigênio e moléculas de ácido araquidônico , mas as reações mediadas por CR não resultam nesses produtos.
Apresentação de antígeno
As células dendríticas imaturas (DCs) podem fagocitar, mas as DCs maduras não podem devido a alterações nas Rho GTPases envolvidas na remodelação do citoesqueleto. Os fagossomas das DCs são menos hidrolíticos e ácidos do que os dos macrófagos e neutrófilos, pois as DCs estão principalmente envolvidas na apresentação do antígeno, e não na degradação do patógeno. Eles precisam reter fragmentos de proteínas de um tamanho adequado para o reconhecimento bacteriano específico, de modo que os peptídeos sejam apenas parcialmente degradados. Os peptídeos da bactéria são transportados para o Complexo Principal de Histocompatibilidade (MHC). Os antígenos peptídicos são apresentados aos linfócitos , onde se ligam aos receptores das células T e ativam as células T , preenchendo a lacuna entre a imunidade inata e a adaptativa. Isso é específico para mamíferos , pássaros e peixes com mandíbula, pois os insetos não têm imunidade adaptativa.
Nutriente
Antigos organismos unicelulares, como a ameba, usam a fagocitose como forma de adquirir nutrientes, em vez de uma estratégia imunológica. Eles engolfam outros micróbios menores e os digerem dentro do fagossomo de cerca de uma bactéria por minuto, o que é muito mais rápido do que os fagócitos profissionais. Para a ameba do solo Dictyostelium discoideum , sua principal fonte de alimento é a bactéria Legionella pneumophila , que causa a doença do legionário em humanos. A maturação do fagossomo na ameba é muito semelhante à dos macrófagos, então eles são usados como um organismo modelo para estudar o processo.
Limpeza de tecido
Os fagossomas degradam as células senescentes e as células apoptóticas para manter a homeostase do tecido. Os eritrócitos têm uma das maiores taxas de renovação do corpo e são fagocitados por macrófagos no fígado e no baço . No embrião , o processo de remoção das células mortas não é bem caracterizado, mas não é realizado por macrófagos ou outras células derivadas de células-tronco hematopoiéticas . É apenas no adulto que as células apoptóticas são fagocitadas por fagócitos profissionais. A inflamação é desencadeada apenas por certos padrões moleculares associados a patógenos ou danos (PAMPs ou DAMPs), a remoção de células senescentes não é inflamatória.
Autofagossomo
Os autofagossomos são diferentes dos fagossomas porque são usados principalmente para degradar seletivamente organelas citosólicas danificadas, como as mitocôndrias ( mitofagia ). No entanto, quando a célula está faminta ou estressada, os autofagossomos também podem degradar organelas de forma não seletiva para fornecer aminoácidos e outros nutrientes à célula. A autofagia não se limita aos fagócitos profissionais; ela foi descoberta pela primeira vez em hepatócitos de ratos pelo biólogo celular Christian de Duve . Os autofagossomos têm uma membrana dupla, a interna da organela envolvida, e a membrana externa é especulada para ser formada a partir do retículo endoplasmático ou do compartimento intermediário ER-Golgi (ERGIC). O autofagossomo também se funde com os lisossomas para degradar seu conteúdo. Quando o M. tuberculosis inibe a acidificação do fagossomo, o Interferon gama pode induzir a autofagia e resgatar o processo de maturação.
Evasão e manipulação bacteriana
Muitas bactérias evoluíram para escapar das propriedades bactericidas dos fagossomas ou mesmo explorar a fagocitose como estratégia de invasão.
- O Mycobacterium tuberculosis tem como alvo os macrófagos M2 nas partes inferiores da via respiratória, que não produzem ROS. O M. tuberculosis também pode manipular as vias de sinalização pela secreção de fosfatases, como PtpA e SapM, que interrompem o recrutamento de proteínas e bloqueiam a acidificação do fagossoma.
- Legionella pneumophila pode remodelar a membrana do fagossomo para imitar vesículas em outras partes da via secretora, de modo que os lisossomos não reconhecem o fagossomo e não se fundem com ele. A bactéria secreta toxinas que interferem no tráfico de hospedeiros, então o vacúolo contendo Legionella recruta proteínas de membrana geralmente encontradas no retículo endoplasmático ou no ERGIC. Isso redireciona as vesículas secretoras para o fagossoma modificado e fornece nutrientes para a bactéria.
- A Listeria monocytogenes secreta uma proteína formadora de poros, listeriolisina O, para que a bactéria possa escapar do fagossoma para o citosol. A listeriolisina é ativada pelo ambiente ácido do fagossoma. Além disso, a Listeria secreta duas enzimas fosfolipase C que facilitam o escape do fagossoma.
Veja também
Referências