Triamtereno - Triamterene
 | |
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Dyrenium, outros |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a682337 |
Categoria de gravidez |
|
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | 30-70% |
| Ligação proteica | 67% |
| Metabolismo | hidroxilação em para-hidroxitriamtereno |
| Meia-vida de eliminação | 1-2 horas, metabólito ativo 3 horas |
| Excreção | renal <50%, 21% inalterado |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100,006,278 |
| Dados químicos e físicos | |
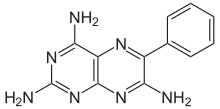
| Fórmula | C 12 H 11 N 7 |
| Massa molar | 253,269 g · mol −1 |
| |
|
| |
O triamtereno (nome comercial Dyrenium, entre outros) é um diurético poupador de potássio frequentemente usado em combinação com diuréticos tiazídicos para o tratamento de hipertensão ou inchaço . A combinação com a hidroclorotiazida , é conhecida como hidroclorotiazida / triamtereno .
Efeitos colaterais
Os efeitos colaterais comuns podem incluir depleção de sódio , ácido fólico e cálcio , náuseas, vômitos, diarreia, dor de cabeça, tontura, fadiga e boca seca. Os efeitos colaterais graves podem incluir palpitações cardíacas, formigamento / dormência, febre, calafrios, dor de garganta, erupção na pele e dor nas costas. O triamtereno também pode causar cálculos renais por meio da cristalização direta ou da semeadura de cálculos de oxalato de cálcio . O triamtereno deve ser evitado em pacientes com doença renal crônica devido à possibilidade de hipercalemia . Pessoas que usam esta droga devem usar o substituto do sal com cautela.
O triamtereno pode transmitir uma cor fluorescente azul à urina.
Cuidado com certos estados de doença
Diabetes : utilizar com cuidado em pessoas com pré-diabetes ou diabetes mellitus, pois pode haver uma alteração no controle da glicose.
Insuficiência hepática : utilizar com cuidado em pessoas com disfunção hepática grave; na cirrose , evite desequilíbrios eletrolíticos e ácido / básico que possam causar encefalopatia hepática .
Insuficiência renal : a terapia combinada com triamtereno e indometacina causou lesão renal aguda reversível em algumas pessoas.
Pedras nos rins : use com cuidado em pessoas com pedras nos rins.
O uso deve ser evitado se a depuração da creatinina for inferior a 10 ml / minuto.
Mecanismo de ação
O triamtereno bloqueia diretamente o canal de sódio epitelial (ENaC) no lado do lúmen do túbulo coletor do rim . Outros diuréticos causam uma diminuição na concentração de sódio da urina em formação devido à entrada de sódio na célula via ENaC e a saída concomitante de potássio da célula principal para a urina em formação. Bloquear ENaC impede que isso aconteça. Amiloride funciona da mesma maneira. Os bloqueadores dos canais de sódio inibem diretamente a entrada de sódio nos canais de sódio.
Com hidroclorotiazida
O triamtereno é comumente preparado em combinação com hidroclorotiazida para o tratamento da hipertensão (pressão alta) e edema (retenção de água). Essa combinação está em uma classe de medicamentos chamados diuréticos ou “pílulas de água” e faz com que os rins se livrem da água desnecessária e do sódio do corpo pela urina .
História
O sistema de anel triamtereno é encontrado em muitos compostos naturais, como o ácido fólico e a riboflavina. A observação de que o composto de ocorrência natural xanthopterin tinha efeitos renais levou cientistas da Smith Kline e do Laboratório Francês na Filadélfia a iniciar uma campanha de química medicinal para descobrir drogas potenciais, como parte de um programa para descobrir diuréticos poupadores de potássio. Os primeiros estudos clínicos foram publicados em 1961 e os primeiros ensaios combinando-o com a hidroclorotiazida foram publicados no ano seguinte.
Smith Kline & French o lançou como um agente único sob a marca Dyrenium em 1964. O medicamento combinado com hidroclorotiazida, Dyazide, foi aprovado pela primeira vez nos Estados Unidos em 1965 e o primeiro genérico, trazido pela Bolar Pharmaceutical Co., foi aprovado em 1987. Em 1986, o Dyazide era o medicamento mais prescrito nos Estados Unidos e tinha US $ 325 milhões em vendas, tornando-o o segundo maior vendedor da SmithKline Beckman, atrás apenas do Tagamet .
As patentes da Dyazide haviam expirado em 1980, mas surgiram complicações com a introdução dos genéricos, porque a formulação da Dyazide resultou em lotes variáveis que impossibilitaram os fabricantes de genéricos de mostrar que suas versões eram bioequivalentes.
A Bolar Pharmaceutical estava concorrendo para ser a primeira a trazer um genérico, mas sua aplicação foi atrasada por essas preocupações sobre se sua formulação fornecia a mesma quantidade de cada medicamento; isso foi complicado por acusações de que Bolar havia substituído fraudulentamente o Dyazide por sua própria versão para conduzir estudos que foram submetidos ao FDA. Pouco depois de o genérico de Bolar ser aprovado, outras preocupações foram levantadas com relação às aplicações de Bolar para comercializar genéricos de maneira mais geral; essas descobertas, entre outras, levantaram uma preocupação generalizada entre os médicos e o público sobre se os genéricos eram realmente iguais aos medicamentos de marca. Bolar acabou recordando sua forma genérica de Dyazide e retirou o produto em 1990. Em 1991, o Departamento de Justiça dos Estados Unidos, em nome do FDA, entrou com 20 acusações criminais contra Bolar por sua fraude e, no início do ano seguinte, Bolar se declarou culpado e concordou em pagar uma Multa de $ 10 milhões. A preocupação pública com a segurança dos medicamentos genéricos foi exacerbada ainda mais por uma investigação do Congresso sobre suborno no FDA por empresas de genéricos que encontraram corrupção generalizada; a investigação foi estimulada pela empresa de genéricos Mylan , que contratou investigadores particulares com base em suas crenças de que os concorrentes estavam obtendo vantagens injustas ao obter a aprovação de seus genéricos.
A própria Mylan desenvolveu uma versão de um medicamento combinado triamtereno / hidroclorotiazida após a expiração da patente da Dyazida e usou uma formulação diferente e mais estável, bem como diferentes dosagens de cada ingrediente ativo (50 mg de hidroclorotiazida e 75 mg de triamtereno, em comparação com 25 mg de hidroclorotiazida da Diazida e 50 mg de triamtereno), portanto, teve que obter aprovação como um novo medicamento, em oposição a um genérico; seu produto se chamava Maxzide e foi aprovado em 1984. A dose mais alta permitida uma vez por dia, que Mylan e seu parceiro de marketing, Lederle, acreditavam que a ajudaria a competir com a Dyazide, que tinha US $ 210 milhões em vendas em 1983.
As patentes de Mylan sobre o medicamento foram declaradas inválidas no tribunal e sua exclusividade de marketing expirou em 1987, gerando uma onda de competição e litígio de genéricos por duas delas, American Therapeutics Inc. e Vitarine Pharmaceuticals, com o FDA. A Vitarine, junto com a Par Pharmaceutical , eram duas das empresas que Mylan tinha como alvo em sua investigação sobre corrupção e descobriu-se que a Par e a Vitarine usaram o Maxzide de Mylan para obter seus dados de bioequivalência, levando ambas as empresas a retirar seu concorrente genérico do Mylan. produtos. Os genéricos finalmente entraram no mercado.
Pesquisar
Embora haja uma falta de ensaios clínicos randomizados que avaliem o uso de triamtereno no tratamento da doença de Ménière , o tratamento típico é 37,5 mg de triamtereno com 25 mg de hidroclorotiazida 1-2 cápsulas por dia. Esta recomendação recebeu um grau C. de Taxonomia de Força de Recomendação (SORT).
