Cloreto de oxalila - Oxalyl chloride
|
|||
|
|
|||

|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Dicloreto de oxalila |
|||
|
Nome IUPAC sistemático
Dicloreto de etanodioila |
|||
| Outros nomes
Cloreto de ácido
oxálico Dicloreto de ácido oxálico Dicloreto oxálico Cloreto de oxaloílo |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100,001,092 |
||
| Número EC | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
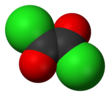
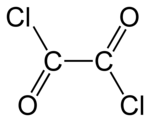
| C 2 O 2 Cl 2 | |||
| Massa molar | 126,93 g / mol | ||
| Aparência | Líquido incolor | ||
| Densidade | 1,4785 g / mL | ||
| Ponto de fusão | -16 ° C (3 ° F; 257 K) | ||
| Ponto de ebulição | 63 a 64 ° C (145 a 147 ° F; 336 a 337 K) a 1,017 bar | ||
| Reage | |||
|
Índice de refração ( n D )
|
1.429 | ||
| Perigos | |||
| Riscos principais | Tóxico, corrosivo, lacrimogêneo | ||
| Ficha de dados de segurança | MSDS externo | ||
| Pictogramas GHS |
 
|
||
| Palavra-sinal GHS | Perigo | ||
| H314 , H331 | |||
| P261 , P280 , P305 + 351 + 338 , P310 | |||
| NFPA 704 (diamante de fogo) | |||
| Compostos relacionados | |||
|
Cloretos de acila relacionados
|
Cloreto de malonila Cloreto de succinila fosgênio |
||
|
Compostos relacionados
|
Dieta oxalato de ácido oxálico Oxamida Oxalil hidrazida Cuprizon 1 |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O cloreto de oxalila é um composto químico com a fórmula (COCl) 2 . Este líquido incolor e de cheiro forte, o cloreto de diacila do ácido oxálico , é um reagente útil em síntese orgânica .
Preparação
O cloreto de oxalila foi preparado pela primeira vez em 1892 pelo químico francês Adrien Fauconnier, que reagiu o oxalato de dietila com pentacloreto de fósforo. Também pode ser preparado tratando o ácido oxálico com pentacloreto de fósforo .
O cloreto de oxalila é produzido comercialmente a partir de carbonato de etileno . A fotocloração dá o tetracloreto, que é posteriormente degradado:
- C 2 H 4 O 2 CO + 4 Cl 2 → C 2 Cl 4 O 2 CO + 4 HCl
- C 2 Cl 4 O 2 CO → C 2 O 2 Cl 2 + COCl 2
Reações
O cloreto de oxalila reage com a água liberando apenas produtos gasosos: cloreto de hidrogênio (HCl), dióxido de carbono (CO 2 ) e monóxido de carbono (CO).
- (COCl)
2 + H
2O → 2 HCl + CO
2 + CO
Nisto, é bastante diferente de outros cloretos de acila que se hidrolisam com a formação de cloreto de hidrogênio e do ácido carboxílico original .
Aplicações em síntese orgânica
Oxidação de álcoois
A solução compreendendo DMSO e cloreto de oxalila, seguida de extinção com trietilamina, converte os álcoois nos aldeídos e cetonas correspondentes por meio do processo conhecido como oxidação de Swern .
Síntese de cloretos de acila
O cloreto de oxalila é usado principalmente junto com um catalisador N , N- dimetilformamida em síntese orgânica para a preparação de cloretos de acila a partir dos ácidos carboxílicos correspondentes . Como o cloreto de tionila , o reagente se degrada em produtos colaterais voláteis nesta aplicação, o que simplifica o processamento. Um dos subprodutos menores da reação catalisada por N , N- dimetilformamida é um potente carcinógeno, decorrente da decomposição de N , N- dimetilformamida. Em relação ao cloreto de tionila, o cloreto de oxalila tende a ser um reagente mais suave e seletivo . Também é mais caro do que o cloreto de tionila, por isso tende a ser usado em menor escala.
Esta reação envolve a conversão de DMF no derivado de cloreto de imidoíla (Me 2 N = CHCl + ), semelhante ao primeiro estágio da reação de Vilsmeier-Haack . O cloreto de imidoíla é o agente de cloração ativo.
Formilação de arenos
O cloreto de oxalila reage com compostos aromáticos na presença de cloreto de alumínio para dar o cloreto de acila correspondente em um processo conhecido como acilação de Friedel-Crafts . O cloreto de acila resultante pode ser hidrolisado para formar o ácido carboxílico correspondente .
Preparação de diésteres de oxalato
Como outros cloretos de acila, o cloreto de oxalila reage com álcoois para dar ésteres:
- 2 RCH
2OH + (COCl)
2 → RCH
2OC (O) C (O) OCH
2R + 2 HCl
Normalmente, essas reações são conduzidas na presença de uma base como a piridina . O diéster derivado do fenol , éster fenil oxalato , é Cyalume, o ingrediente ativo dos bastões luminosos .
Outro
O cloreto de oxalila foi supostamente usado na primeira síntese de dioxano tetra-cetona (C 4 O 6 ), um óxido de carbono .
Precauções
Em março de 2000, um Airbus A330 -300 da Malaysia Airlines foi danificado além do reparo depois que uma carga de cloreto de oxalila proibido (falsamente declarado como hidroxiquinolina) vazou no compartimento de carga. É tóxico por inalação, embora seja em uma ordem de magnitude menos agudamente tóxico do que o composto relacionado fosgênio.