Plasticidade não sináptica - Nonsynaptic plasticity
A plasticidade não sináptica é uma forma de neuroplasticidade que envolve a modificação da função do canal iônico no axônio , dendritos e corpo celular que resulta em mudanças específicas na integração dos potenciais pós-sinápticos excitatórios e potenciais pós-sinápticos inibitórios . A plasticidade não sináptica é uma modificação da excitabilidade intrínseca do neurônio. Ele interage com a plasticidade sináptica , mas é considerado uma entidade separada da plasticidade sináptica. A modificação intrínseca das propriedades elétricas dos neurônios desempenha um papel em muitos aspectos da plasticidade, desde a plasticidade homeostática até o aprendizado e a própria memória . A plasticidade não sináptica afeta a integração sináptica , a propagação subliminar , a geração de picos e outros mecanismos fundamentais dos neurônios no nível celular. Essas alterações neuronais individuais podem resultar em mudanças nas funções cerebrais superiores , especialmente no aprendizado e na memória. No entanto, como um campo emergente da neurociência , muito do conhecimento sobre a plasticidade não sináptica é incerto e ainda requer mais investigação para definir melhor seu papel na função e no comportamento do cérebro.
Vs. Plasticidade sináptica
Neuroplasticidade é a capacidade de uma determinada parte ou região de um neurônio mudar de força ao longo do tempo. Existem duas categorias amplamente reconhecidas de plasticidade: sináptica e não sináptica. A plasticidade sináptica lida diretamente com a força da conexão entre dois neurônios, incluindo a quantidade de neurotransmissor liberado do neurônio pré-sináptico e a resposta gerada no neurônio pós-sináptico . A plasticidade não sináptica envolve a modificação da excitabilidade neuronal no axônio , dendritos e soma de um neurônio individual, distante da sinapse.
Plasticidade sináptica
A plasticidade sináptica é a capacidade de uma sinapse entre dois neurônios de mudar de força ao longo do tempo. A plasticidade sináptica é causada por mudanças no uso da via sináptica, a saber, a frequência dos potenciais sinápticos e os receptores usados para retransmitir os sinais químicos. A plasticidade sináptica desempenha um grande papel na aprendizagem e na memória do cérebro. A plasticidade sináptica pode ocorrer por meio de mecanismos intrínsecos, nos quais as mudanças na força da sinapse ocorrem por causa de sua própria atividade, ou por meio de mecanismos extrínsecos, nos quais as mudanças na força da sinapse ocorrem por meio de outras vias neurais. A plasticidade sináptica inibitória de curto prazo geralmente ocorre devido ao fornecimento limitado de neurotransmissores na sinapse, e a inibição de longo prazo pode ocorrer por meio da diminuição da expressão do receptor na célula pós - sináptica . A plasticidade sináptica complementar de curto prazo frequentemente ocorre por causa do fluxo iônico residual ou aumentado tanto no terminal pré-sináptico quanto no pós-sináptico, enquanto a plasticidade sináptica de longo prazo pode ocorrer por meio da produção aumentada de receptores de glutamato AMPA e NMDA , entre outros, na célula pós-sináptica.
Plasticidade não sináptica
Em comparação, a plasticidade não sináptica é um campo de pesquisa menos conhecido e um tanto novo e contínuo em neurociência. Ela se manifesta por meio de mudanças nas características das estruturas não sinápticas, como o soma (biologia) , o axônio ou os dendritos. A plasticidade não sináptica pode ter efeitos de curto ou longo prazo. Uma das maneiras pelas quais essas mudanças ocorrem é por meio da modificação dos canais dependentes de voltagem nos dendritos e no axônio, o que altera a interpretação dos potenciais excitatórios ou inibitórios propagados para a célula. Por exemplo, a plasticidade axonal não sináptica pode ser observada quando um potencial de ação falha em atingir o terminal pré-sináptico devido à baixa condução ou acúmulo de íons.
Efeitos sinérgicos
Efeitos excitatórios gerais
Demonstrou-se que a plasticidade não sináptica e sináptica funcionam simultaneamente de várias maneiras para produzir efeitos estimulantes no neurônio. Isso inclui geração de pico, um produto da regulação não sináptica de potássio e outros canais de íons pré-sinápticos, que aumentam a resposta do potencial pós-sináptico excitatório por meio da liberação de neurotransmissores e aumento do potencial de ação. A plasticidade dendrítica não sináptica também aumenta os efeitos da plasticidade sináptica por meio do alargamento do potencial de ação. Como será discutido mais adiante, o fator neurotrófico derivado do cérebro (BNDF) é produzido pelos neurônios para coordenar a plasticidade não sináptica e sináptica. Mudanças não sinápticas no corpo somático, axônio ou dendritos do neurônio estão inextricavelmente ligadas à força sináptica.
Integração na memória e aprendizagem
Embora muito mais se saiba sobre o papel da plasticidade sináptica na memória e no aprendizado, tanto a plasticidade sináptica quanto a não sináptica são essenciais para a memória e o aprendizado no cérebro. Há muitas evidências de que os dois mecanismos funcionam para alcançar os efeitos observados de forma sinérgica. Um exemplo chave disso é a formação da memória na sinapse, na qual a modificação dos mecanismos de liberação pré-sináptica e dos receptores pós-sinápticos afeta a potenciação ou a depressão a longo prazo. A despolarização somática contínua , por outro lado, tem sido proposta como um método para o comportamento aprendido e a memória por plasticidade não sináptica. A plasticidade não sináptica também aumenta a eficácia da formação da memória sináptica pela regulação dos canais iônicos dependentes de voltagem . A plasticidade não sináptica é o mecanismo responsável pelas modificações desses canais no axônio, levando a uma mudança na força do potencial de ação neuronal, invariavelmente afetando a força dos mecanismos sinápticos e, portanto, a profundidade e o comprimento da codificação da memória.
Regulação da plasticidade sináptica
A plasticidade não sináptica também tem a capacidade de regular os efeitos da plasticidade sináptica por meio de mecanismos de feedback negativo . A mudança no número e nas propriedades dos canais iônicos no axônio ou nos dendritos tem a capacidade de diminuir os efeitos de uma sinapse hiperestimulada. No caso de superexcitação extrema desses canais iônicos, ocorrerá um fluxo reverso de íons para dentro da célula, levando à excitotoxicidade e morte celular por apoptose ou necrose .
Mecanismos intrínsecos
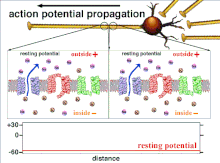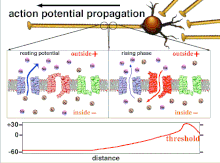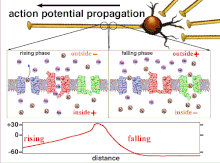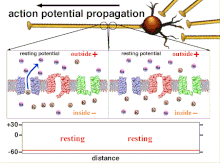
As áreas neuronais não sinápticas, como o axônio, também têm qualidades inerentes que afetam a sinapse. Esses mecanismos essenciais incluem o atraso na despolarização que o potencial de ação sofre enquanto viaja pelo axônio. Essa qualidade intrínseca retarda a propagação dos potenciais de ação e se deve ao movimento da corrente despolarizante no citoplasma e à colocação intermitente de canais de sódio nos Nodos de Ranvier . Esses mecanismos sempre existem, mas podem mudar dependendo das condições da célula soma, axônio e dendritos no momento. Portanto, a latência, ou atraso na propagação dos potenciais de ação ou potenciais pós-sinápticos excitatórios, pode ser variável. Todo potencial pós-sináptico excitatório que é propagado para uma célula pós-sináptica é primeiro transmitido através do potencial de ação ao longo do axônio na célula pré-sináptica e, portanto, a plasticidade não-sináptica afeta inerentemente a plasticidade sináptica.
Tipos
Excitabilidade intrínseca de um neurônio
A excitabilidade de um neurônio em qualquer ponto depende das condições internas e externas da célula no momento da estimulação. Uma vez que um neurônio normalmente recebe vários sinais de entrada ao mesmo tempo, a propagação de um potencial de ação depende da integração de todos os potenciais pós-sinápticos excitatórios e inibitórios que chegam ao outeiro do axônio . Se a soma de todos os sinais excitatórios e inibitórios despolariza a membrana celular para a voltagem limite, um potencial de ação é disparado. Mudar a excitabilidade intrínseca de um neurônio mudará a função desse neurônio.
Geração Spike
A plasticidade não sináptica tem um efeito excitatório na geração de picos . O aumento na geração do pico foi correlacionado com uma diminuição no limiar do pico , uma resposta da plasticidade não sináptica. Essa resposta pode resultar da modulação de certas correntes pré-sinápticas de K + (íon potássio) (I A , I K, Ca e I Ks ), que funcionam para aumentar a excitabilidade dos neurônios sensoriais, ampliar o potencial de ação e melhorar o neurotransmissor liberar. Essas modulações das condutâncias do K + servem como mecanismos comuns para regular a excitabilidade e a força sináptica .
Regulação da plasticidade sináptica
A plasticidade não sináptica foi associada à plasticidade sináptica, por meio de mecanismos sinérgicos e regulatórios. O grau de modificação sináptica determina a polaridade das mudanças não sinápticas , afetando a mudança na excitabilidade celular. Níveis moderados de plasticidade sináptica produzem mudanças não sinápticas que agirão sinergicamente com os mecanismos sinápticos para fortalecer uma resposta. Por outro lado, níveis mais robustos de plasticidade sináptica produzirão respostas não sinápticas que agirão como um mecanismo de feedback negativo . Os mecanismos de feedback negativo funcionam para proteger contra a saturação ou supressão da atividade do circuito como um todo.
Modulação axonal
A modulação axonal é um tipo de plasticidade na qual o número, atividade ou localização dos canais iônicos no axônio muda. Isso faz com que o neurônio se comporte de maneira diferente quando estimulado. A modulação dos canais iônicos é uma resposta a uma mudança nas frequências de estimulação de um neurônio.
Plasticidade de propagação
Porque é a soma dos potenciais de ação que eventualmente resulta na polarização do limiar sendo cruzada, a relação temporal de diferentes sinais de entrada é muito importante para determinar se e quando um neurônio pós-sináptico irá disparar. Com o tempo, o tempo que um potencial de ação leva para se propagar ao longo do comprimento de um determinado axônio pode mudar. Em um experimento, arranjos multieletrodos foram usados para medir o tempo que os potenciais de ação levavam para viajar de um eletrodo para outro, denominado latência. Os neurônios foram então estimulados e o valor da latência foi registrado ao longo do tempo. Os valores de latência mudaram ao longo do tempo, sugerindo que a plasticidade axonal influenciou a propagação dos potenciais de ação.
Shunting
Shunting é um processo no qual os canais de íons axonais se abrem durante o fluxo passivo (não exigindo uma bomba de íons ) de uma despolarização subliminar para baixo do axônio. Geralmente ocorrendo em pontos de ramificação axonal, o tempo de abertura desses canais quando o sinal subliminar chega à área causa uma hiperpolarização a ser introduzida na despolarização de fluxo passivo. Portanto, a célula é capaz de controlar por quais ramos do axônio a corrente de despolarização subliminar flui, resultando em alguns ramos do axônio sendo mais hiperpolarizados do que outros. Esses potenciais de membrana diferentes fazem com que certas áreas do neurônio sejam mais excitáveis do que outras, com base na localização específica e na ocorrência de shunt.
Estimulação de alta frequência
Efeitos de curto prazo: A estimulação de alta frequência de um neurônio por um curto período de tempo aumenta a excitabilidade do neurônio, reduzindo a quantidade de voltagem necessária para disparar um potencial de ação. A estimulação de alta frequência leva a um aumento na concentração intracelular de íons de sódio e cálcio devido à abertura repetida dos canais de sódio e cálcio dependentes de voltagem no axônio e no terminal. À medida que a frequência dos estímulos aumenta, há menos tempo entre cada estímulo para a célula se repolarizar e retornar ao potencial normal de repouso . Portanto, o potencial de repouso se torna mais despolarizado, o que significa que uma corrente despolarizante menor é necessária para disparar um potencial de ação.
No entanto, essa modulação costuma durar muito pouco. Se a estimulação cessar, o neurônio reverterá ao seu potencial de repouso original, pois os canais iônicos e as bombas têm tempo suficiente para se recuperar do último estímulo.
Efeitos de longo prazo: a estimulação de alta frequência de um neurônio por um longo período de tempo causa duas alterações neuronais resultantes. Inicialmente, o neurônio responde como faria durante a estimulação de curto prazo, com um aumento na excitabilidade. Continuar a estimulação de alta frequência após esse ponto resulta em uma mudança drástica e irreversível na excitabilidade. Quando as concentrações de sódio atingem um nível alto o suficiente no axônio, as bombas de sódio / cálcio invertem sua direção de fluxo, fazendo com que o cálcio seja importado para a célula à medida que o sódio é exportado. O aumento da concentração de cálcio (e subsequente despolarização da membrana) inativa os canais de sódio e os direciona para endocitose e hidrólise lisossomal . Isso resulta em uma grande diminuição nos canais de sódio axonais, que são necessários para a propagação do potencial de ação. Se a estimulação continuar, eventualmente o neurônio irá parar de transmitir potenciais de ação e morrerá. A morte neuronal devido à superestimulação é chamada de excitotoxicidade .
Estimulação de baixa frequência
Efeitos de curto prazo: Todos os neurônios vivos têm uma taxa basal de propagação do potencial de ação e liberação sináptica. Assim, a estimulação de baixa frequência de um neurônio em curto prazo é semelhante à atividade de um neurônio em repouso no cérebro. Nenhuma mudança significativa ocorre na excitabilidade intrínseca do neurônio.
Efeitos de longo prazo: a estimulação de baixa frequência de um neurônio por um longo período de tempo diminui a excitabilidade do neurônio ao ativar fosfatases dependentes de cálcio que marcam os receptores AMPA para internalização. A estimulação de baixa frequência leva a baixos níveis de cálcio na célula. Quando as concentrações de cálcio são baixas, as fosfatases dependentes de cálcio ativas dominam as quinases dependentes de cálcio. À medida que mais fosfatases são ativadas, elas marcam mais receptores AMPA para internalização por endocitose. Como os receptores AMPA são um dos principais receptores excitatórios nos neurônios, removê-los da membrana celular deprime efetivamente a célula (se a célula não pode reagir aos sinais excitatórios, não pode gerar um potencial de ação próprio). Desta forma, a estimulação de baixa frequência pode realmente reverter os efeitos da potenciação de longo prazo , no entanto, esses conceitos são geralmente considerados tipos de plasticidade sináptica.
Plasticidade homeostática e hebbiana
Os neurônios do sistema nervoso central (SNC) integram sinais de muitos neurônios. No curto prazo, é importante que haja mudanças na atividade do neurônio, pois é assim que a informação é veiculada no sistema nervoso ( plasticidade Hebbiana ). No entanto, para a sustentabilidade de longo prazo, o desvio para a excitabilidade ou inexcitabilidade perturbará a capacidade do circuito de transmitir informações ( plasticidade homeostática ). A potenciação de longo prazo (LTP) induz uma taxa de disparo mais alta em neurônios pós-sinápticos. Foi hipotetizado que as propriedades intrínsecas de um neurônio deveriam ser organizadas para aproveitar ao máximo a faixa dinâmica, agindo como um mecanismo homeostático. No entanto, foi mostrado que a excitabilidade intrínseca segue uma distribuição lognormal que requer o aprendizado Hebbian ativo para ser mantido. Estudos in vitro descobriram que, quando a atividade espontânea de culturas neuronais é inibida, os neurônios se tornam hiperexcitáveis e que, quando um aumento na atividade é induzido por longos períodos, as taxas de disparo da cultura diminuem. Em contraste, há uma abundância de evidências de que a forma oposta de regulação, aprendizagem Hebbian ou LTP-IE / LTD-IE, também ocorre e argumentos teóricos mostram que a plasticidade Hebbian deve ser a forma dominante de plasticidade para excitabilidade intrínseca também. Uma vez que a plasticidade homeostática também ocorre entre as sinapses individuais, uma visão anterior sugerindo que a plasticidade homeostática e a plasticidade intrínseca estão ligadas mostrou ser inconsistente com as evidências.
Mecanismo
Um mecanismo para preservar a faixa dinâmica de um neurônio é o escalonamento sináptico , uma forma homeostática de plasticidade que restaura a atividade neuronal aos seus níveis normais de "linha de base", alterando a resposta pós-sináptica das sinapses de um neurônio em função da atividade. A modulação homeostática da excitabilidade intrínseca de um neurônio é outra forma de manter a estabilidade. A regulação das condutâncias iônicas pode ser alcançada de várias maneiras, principalmente por meio da liberação de neuromoduladores como dopamina , serotonina etc. Outra maneira é por meio da liberação controlada de fator neurotrófico derivado do cérebro (BDNF). O BDNF também mostrou influenciar o escalonamento sináptico, sugerindo que esse fator neurotrófico pode ser responsável pela coordenação dos mecanismos sinápticos e não sinápticos na plasticidade homeostática.
Excitabilidade dendrítica
Os dendritos são as regiões responsáveis pela integração das entradas de outros neurônios . Uma maneira que os neurônios manipulam as propriedades de integração dos dendritos é alterando o número e as propriedades dos canais iônicos dependentes de voltagem. A indução da potenciação de longo prazo (LTP) em uma sinapse particular , resulta em um aumento na excitabilidade dos ramos dendríticos específicos para aquela sinapse. A excitabilidade dendrítica é importante para a propagação e integração dos sinais sinápticos. Acredita-se que a excitabilidade dendrítica contribua para a potenciação ES, ou um aumento na probabilidade de que uma dada entrada resulte no disparo de um potencial de ação.
Sabe-se que mudanças na excitabilidade dendrítica afetam a retropropagação do potencial de ação. Os potenciais de ação começam perto do outeirinho do axônio e se propagam por todo o comprimento do axônio, mas também se propagam para trás, através do soma, para a árvore dendrítica. A retropropagação ativa depende dos canais de íons e a alteração das densidades ou propriedades desses canais pode influenciar o grau em que o sinal é atenuado . A plasticidade da retropropagação nos dendritos ocorre em menos de um minuto e dura mais de 25 minutos. A propagação reversa é um método de sinalizar para as sinapses que um potencial de ação foi disparado. Isso é importante para a plasticidade dependente do tempo de pico .
Plasticidade intrínseca
A plasticidade intrínseca é uma forma de plasticidade dependente da atividade distinta da plasticidade sináptica , que envolve mudanças na sinapse entre dois neurônios, em vez de mudanças nas propriedades elétricas dentro de um único neurônio. Existem alguns fenômenos intimamente relacionados que podem afetar a excitabilidade de um neurônio - como neuromodulação , plasticidade estrutural, plasticidade de curto prazo devido à cinética do canal e desenvolvimento neural . Não há consenso sobre a quantidade que regula a plasticidade intrínseca, por exemplo, a taxa de disparo de um neurônio, seu ganho ou sua concentração interna de cálcio. Funcionalmente, a plasticidade intrínseca pode permitir que os neurônios aprendam a intensidade dos estímulos e representem essas estatísticas de intensidade em suas excitabilidades. A plasticidade intrínseca contribui para a codificação da memória e complementa outras formas de plasticidade dependente da atividade, incluindo a plasticidade sináptica .
Função cerebral superior
Memória associativa de longo prazo
Evidência experimental
O experimento de Kemenes et al . demonstraram que em um neurônio modulador extrínseco , a plasticidade não sináptica influencia a expressão da memória associativa de longo prazo. A relação entre plasticidade não sináptica e memória foi avaliada usando células cerebrais gigantes (CGCs). A despolarização de estímulos condicionados aumentou a resposta da rede neuronal. Essa despolarização durou tanto quanto a memória de longo prazo . A despolarização persistente e a expressão da memória comportamental ocorreram mais de 24 horas após o treinamento, indicando efeitos de longo prazo. Neste experimento, a expressão eletrofisiológica do traço de memória de longo prazo foi uma resposta de alimentação induzida por estímulo condicionado. CGCs foram significativamente mais despolarizados nos organismos treinados do que no grupo de controle, indicando associação com alterações de aprendizagem e excitabilidade. Quando os CGCs foram despolarizados, eles mostraram uma resposta aumentada aos estímulos condicionais e uma resposta de alimentação fictícia mais forte. Isso demonstrou que a despolarização é suficiente para produzir uma resposta alimentar significativa aos estímulos condicionados. Além disso, não foi observada diferença significativa nas taxas de alimentação entre organismos condicionados e despolarizados artificialmente, reafirmando que a despolarização é suficiente para gerar o comportamento associado à memória de longo prazo.
Armazenamento de memória
A atividade não sináptica na célula é geralmente expressa como alterações na excitabilidade neuronal. Isso ocorre por meio da modulação dos componentes da membrana, como canais em repouso e dependentes de voltagem e bombas de íons . Acredita-se que os processos não sinápticos estejam envolvidos no armazenamento da memória. Um possível mecanismo dessa ação envolve a marcação de um neurônio que esteve recentemente ativo com alterações na excitabilidade. Isso ajudaria a vincular estímulos separados temporalmente. Outro mecanismo potencial vem de um modelo computacional que indica que a plasticidade não sináptica pode preparar circuitos para modificação na aprendizagem porque as mudanças de excitabilidade podem regular o limiar para a plasticidade sináptica.
A capacidade de armazenamento de sistemas de armazenamento de memória baseados em sinápticos é muito grande, tornando-se um mecanismo atraente para estudar. Existem aproximadamente 10 4 sinapses por neurônio e 10 11 neurônios no cérebro humano. A plasticidade não sináptica é freqüentemente esquecida simplesmente porque sua capacidade de armazenamento não é tão alta. Regular a densidade dos canais iônicos no axônio e soma de um neurônio mudaria a taxa de transferência e afetaria todas as sinapses. Portanto, sua capacidade de armazenamento seria significativamente menor do que a da plasticidade sináptica.
Embora sua capacidade de armazenamento seja muito baixa para torná-lo o único mecanismo de armazenamento, a plasticidade não sináptica pode contribuir para os métodos de armazenamento sináptico. Foi demonstrado que a modulação dos canais iônicos pode ocorrer em regiões tão pequenas quanto dendritos específicos. Essa especificidade torna a capacidade de armazenamento da plasticidade não sináptica maior do que se fosse considerada a modulação de todo o neurônio. As memórias procedurais são um bom ajuste para este tipo de sistema de armazenamento porque não requerem a alta especificidade que as memórias declarativas exigem. A generalização de tarefas motoras e estímulos condicionados pode ser uma forma eficiente de armazenar essas informações.
Aprendendo
Mudanças na excitabilidade da aprendizagem que agem como parte do traço da memória o fazem como primers para iniciar outras mudanças nos neurônios ou por um mecanismo de armazenamento de curto prazo para a memória de curto prazo. A plasticidade não sináptica pode surgir durante a aprendizagem como resultado de processos celulares, embora o tempo, a persistência e a relação entre a plasticidade não sináptica e a saída sináptica sejam mal compreendidos. Estudos têm mostrado que a plasticidade não sináptica desempenha um papel indireto, mas importante na formação das memórias. A plasticidade não sináptica induzida pela aprendizagem está associada à despolarização do soma.
Condicionamento clássico
Experimentos revelaram que mudanças não sinápticas ocorrem durante o aprendizado condicional . Woody et al . demonstraram que o acondicionamento do piscar de olhos (EBC), uma forma de condicionamento clássico para estudar estruturas e mecanismos neurais subjacentes ao aprendizado e à memória, em um gato está associado ao aumento da excitabilidade e input nos neurônios em áreas corticais sensório-motoras e no núcleo facial . Foi observado que o aumento da excitabilidade do condicionamento clássico continuou depois que a resposta parou. Isso sugere que o aumento da excitabilidade pode funcionar como um mecanismo de armazenamento da memória.
No condicionamento do piscar de olhos em coelhos, alterações não sinápticas ocorreram em todo o hipocampo dorsal . Isso indica que, embora as mudanças de excitabilidade por si só não sejam suficientes para explicar os processos de armazenamento da memória, a plasticidade não sináptica pode ser um mecanismo de armazenamento para fases da memória limitadas pelo tempo. Mudanças não sinápticas influenciam outros tipos de plasticidade envolvidos com a memória. Por exemplo, uma mudança não sináptica , como a despolarização do potencial de membrana em repouso resultante da aprendizagem condicional, pode causar plasticidade sináptica na aprendizagem futura.
Aprendizagem e economia de regras
A capacidade de aprender regras depende da plasticidade não sináptica. Um estudo procurou ensinar ratos a discriminar entre vários odores, e levou vários dias para ensiná-los a distinguir entre um primeiro par de cheiros. No entanto, depois de aprender isso, o rato foi capaz de aprender a distinguir entre diferentes odores com muito mais rapidez. Mudanças na excitabilidade dos neurônios piramidais nesses ratos foram observadas por três dias após o treinamento. Essas mudanças eventualmente desapareceram, sugerindo que os neurônios estavam envolvidos no aprendizado das regras, não no armazenamento da memória. Daoudal e Debanne tentaram determinar se as mesmas regras de aprendizagem e mecanismos de indução definidos para a plasticidade sináptica também se aplicavam à plasticidade não sináptica que afetava os canais iônicos. Eles determinaram que a plasticidade não sináptica e sináptica compartilham regras de aprendizagem e vias de indução comuns, por exemplo, potenciação de longo prazo dependente do receptor NMDA (LTP) e depressão de longo prazo (LTD). Eles também mostraram que a plasticidade não sináptica e sináptica sinergicamente formam um engrama coerente para armazenar traços de memória.
Poupança é a capacidade de reaprender informações esquecidas muito mais rápido do que foi aprendido originalmente. A plasticidade não sináptica é um mecanismo possível para esse efeito de economia. Durante os procedimentos de treinamento, muitos neurônios experimentam um aumento na excitabilidade intrínseca. Esse aumento na excitabilidade persiste mesmo depois que a memória se desvanece.
Dependência de substâncias
As drogas de abuso geralmente afetam o sistema mesolímbico ou, mais especificamente, a via de recompensa do sistema nervoso. Entre as drogas de abuso comuns, a nicotina é um dos agonistas mais fortes na sinapse colinérgica nicotínica. A nicotina, competindo com a acetilcolina (ACh), atua por meio do receptor não sináptico, pré-terminal e nicotínico da acetilcolina (nAChRs) para iniciar uma alteração do potencial de membrana e propagar um sinal de Ca 2+ intracelular , estimulando a liberação de neurotransmissores. O papel específico e característico da atividade nAChR mediada pela corrente de cálcio tem uma dependência de voltagem diferente de outros canais iônicos permeáveis ao Ca 2+ , bem como distribuição temporal e espacial diferente e, como resultado, a atividade nAChR não sináptica aumenta a indução da potenciação sináptica, promover a aprendizagem da dependência de substâncias.
Aplicações a doenças
Após o dano
A plasticidade não sináptica pode funcionar para aliviar os efeitos do dano cerebral . Quando um dos nervos vestibulares é danificado, a disparidade nas taxas de disparo dos neurônios nos núcleos vestibulares causa reflexos vestibulares desnecessários. Os sintomas desse dano desaparecem com o tempo. Isso provavelmente se deve a modificações da excitabilidade intrínseca nos neurônios do núcleo vestibular.
Atividade de apreensão
A plasticidade não sináptica também desempenha um papel fundamental na atividade convulsiva . Convulsões febris, convulsões devido à febre no início da vida, podem levar ao aumento da excitabilidade dos neurônios do hipocampo. Esses neurônios tornam-se altamente sensibilizados a agentes convulsivos. Foi demonstrado que as crises no início da vida podem predispor uma pessoa a mais crises por meio de mecanismos não sinápticos.
Trauma, incluindo acidente vascular cerebral que resulta em lesão cortical , geralmente resulta em epilepsia . O aumento da excitabilidade e das condutâncias NMDA resultam em atividade epiléptica, sugerindo que a plasticidade não sináptica pode ser o mecanismo pelo qual a epilepsia é induzida após o trauma.
Autismo
O ácido valpróico (VPA) é um tratamento para epilepsia , enxaqueca e transtorno bipolar que tem sido associado a muitas condições, incluindo autismo . Existe um modelo animal de autismo no qual ratas grávidas recebem VPA. A prole tem características semelhantes às dos humanos com autismo. Logo após o nascimento, esses animais apresentam excitabilidade diminuída e correntes aumentadas de NMDA . Esses efeitos são corrigidos em fases posteriores da vida. As mudanças na excitabilidade intrínseca nesses animais ajudaram a compensar os efeitos do aumento das correntes NMDA na atividade da rede, uma forma de plasticidade homeostática. Acredita-se que isso ajude a mediar os efeitos prejudiciais que as correntes aumentadas de NMDA teriam.
Pesquisas atuais e futuras
Pesquisas adicionais são necessárias para obter uma compreensão mais ampla da plasticidade não sináptica. Os tópicos que devem ser mais explorados a partir de janeiro de 2010 incluem:
- Mudanças de excitabilidade local versus global em redes neuronais e manutenção do traço de memória
- Especificidade de indução de mudanças de excitabilidade dependentes de aprendizagem
- Manipulação de mudanças de excitabilidade dependentes de aprendizagem por produtos farmacêuticos ou mutações genéticas e seus efeitos no traço de memória
- Semelhanças entre os mecanismos moleculares de plasticidade sináptica e não sináptica
- Comparação de padrões in vivo de plasticidade não sináptica com resultados in vitro
- Alterações na expressão gênica produzida pela atividade neural