Célula-tronco mesenquimal - Mesenchymal stem cell
| Célula-tronco mesenquimal | |
|---|---|

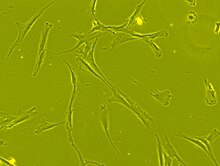
Micrografia eletrônica de transmissão de uma célula-tronco mesenquimal exibindo características ultraestruturais típicas .
| |
| Detalhes | |
| Identificadores | |
| Latina | Cellula mesenchymatica praecursoria |
| Malha | D059630 |
| º | H2.00.01.0.00008 |
|
Termos anatômicos da microanatomia | |
As células-tronco mesenquimais ( MSCs ) também conhecidas como células do estroma mesenquimal ou células de sinalização medicinal são células estromais multipotentes que podem se diferenciar em uma variedade de tipos de células, incluindo osteoblastos (células ósseas), condrócitos (células da cartilagem), miócitos (células musculares) e adipócitos (células de gordura que dão origem ao tecido adiposo da medula ).
Estrutura
Definição
Embora os termos célula-tronco mesenquimal (MSC) e célula do estroma da medula tenham sido usados indistintamente por muitos anos, nenhum dos termos é suficientemente descritivo:
- O mesênquima é o tecido conjuntivo embrionário derivado do mesoderma e que se diferencia em tecido hematopoiético e conjuntivo, enquanto as CTMs não se diferenciam em células hematopoiéticas.
- As células do estroma são células do tecido conjuntivo que formam a estrutura de suporte na qual residem as células funcionais do tecido. Embora esta seja uma descrição precisa para uma função das MSCs, o termo falha em transmitir os papéis recentemente descobertos das MSCs no reparo do tecido.
- O termo engloba células multipotentes derivadas de outros não- medula tecidos, tais como placenta , cordão umbilical sangue, tecido adiposo , adulto muscular , estroma da córnea ou da polpa dentária de folha caduca dentes (bebé). As células não têm capacidade para reconstituir um órgão inteiro.
Morfologia

As células-tronco mesenquimais são caracterizadas morfologicamente por um pequeno corpo celular com alguns processos celulares que são longos e finos. O corpo celular contém um grande núcleo redondo com nucléolo proeminente , que é rodeado por partículas de cromatina finamente dispersas , dando ao núcleo uma aparência clara. O restante do corpo celular contém uma pequena quantidade de aparelho de Golgi , retículo endoplasmático rugoso , mitocôndrias e polirribossomos . As células, que são longas e finas, estão amplamente dispersas e a matriz extracelular adjacente é povoada por algumas fibrilas reticulares, mas é desprovida de outros tipos de fibrilas de colágeno . Essas características morfológicas distintas das células-tronco mesenquimais podem ser visualizadas sem rótulos usando imagens de células vivas.
Localização
Medula óssea
A medula óssea foi a fonte original de MSCs e ainda é a mais utilizada. Essas células-tronco da medula óssea não contribuem para a formação de células sanguíneas e, portanto, não expressam o marcador de células-tronco hematopoiéticas CD34 . Às vezes, são chamadas de células-tronco do estroma da medula óssea .
Células do cordão
As CTMs mais jovens e primitivas podem ser obtidas do tecido do cordão umbilical, ou seja, da geléia de Wharton e do sangue do cordão umbilical . No entanto, as MSCs são encontradas em concentrações muito mais altas na geléia de Wharton em comparação com o sangue do cordão umbilical, que é uma fonte rica em células-tronco hematopoéticas . O cordão umbilical está disponível após o nascimento. Normalmente é descartado e não oferece risco para a coleta. Essas MSCs podem provar ser uma fonte útil de MSCs para aplicações clínicas devido às suas propriedades primitivas e taxa de crescimento rápida.
e estes têm várias vantagens em relação às CTM derivadas da medula óssea. As CTMs derivadas do tecido adiposo (AdMSCs), além de serem mais fáceis e seguras de isolar do que as CTMs derivadas da medula óssea, podem ser obtidas em quantidades maiores.
Células molares
O broto dentário em desenvolvimento do terceiro molar inferior é uma fonte rica em MSCs. Embora sejam descritos como multipotentes, é possível que sejam pluripotentes. Eles eventualmente formam esmalte, dentina, vasos sanguíneos, polpa dentária e tecidos nervosos. Essas células-tronco são capazes de se diferenciar em condrócitos , cardiomiócitos , melanócitos e células semelhantes a hepatócitos in vitro .
Flúido amniótico
As células-tronco estão presentes no líquido amniótico . Até 1 em 100 células coletadas durante a amniocentese são células-tronco mesenquimais pluripotentes.
Função
Capacidade de diferenciação
Os MSCs têm grande capacidade de auto-renovação, mantendo sua multipotência. Trabalhos recentes sugerem que a β-catenina, via regulação do EZH2, é uma molécula central na manutenção da "stemness" das MSC. O teste padrão para confirmar a multipotência é a diferenciação das células em osteoblastos, adipócitos e condrócitos, bem como miócitos.
Observou-se que as MSCs até mesmo se diferenciam em células semelhantes a neurônios, mas permanece a dúvida sobre se os neurônios derivados das MSC são funcionais. O grau de diferenciação da cultura varia entre os indivíduos e como a diferenciação é induzida, por exemplo, química versus mecânica; e não está claro se essa variação se deve a uma quantidade diferente de células progenitoras "verdadeiras" na cultura ou às capacidades de diferenciação variáveis dos progenitores dos indivíduos. Sabe-se que a capacidade de proliferação e diferenciação das células diminui com a idade do doador, bem como com o tempo de cultura. Da mesma forma, não se sabe se isso se deve a uma diminuição no número de MSCs ou a uma mudança nos MSCs existentes.
Efeitos imunomoduladores
As CTMs têm efeito sobre as células imunes inatas e específicas. MSCs produzem muitas moléculas imunomoduladoras, incluindo prostaglandina E2 (PGE2), óxido nítrico , indoleamina 2,3-dioxigenase (IDO), interleucina 6 (IL-6) e outros marcadores de superfície, como FasL , PD-L1 e PD-L2 .
As CTMs têm efeito sobre macrófagos, neutrófilos, células NK, mastócitos e células dendríticas na imunidade inata. As CTMs são capazes de migrar para o local da lesão, onde se polarizam através de macrófagos PGE2 no fenótipo M2, que é caracterizado por um efeito antiinflamatório. Além disso, a PGE2 inibe a capacidade dos mastócitos de desgranular e produzir TNF-α. A proliferação e a atividade citotóxica das células NK são inibidas por PGE2 e IDO. As MSCs também reduzem a expressão dos receptores das células NK - NKG2D, NKp44 e NKp30. As CTMs inibem o surto respiratório e a apoptose de neutrófilos pela produção de citocinas IL-6 e IL-8. A diferenciação e expressão de marcadores de superfície de células dendríticas são inibidas por IL-6 e PGE2 de MSCs. Os efeitos imunossupressores das MSC também dependem da IL-10, mas não é certo se elas a produzem sozinhas ou apenas estimulam outras células a produzi-la.
O MSC expressa as moléculas de adesão VCAM-1 e ICAM-1, que permitem que os linfócitos T adiram à sua superfície. Então, o MSC pode afetá-los por moléculas que têm meia-vida curta e seu efeito ocorre na vizinhança imediata da célula. Estes incluem óxido nítrico, PGE2, HGF e ativação do receptor PD-1. As MSCs reduzem a proliferação de células T entre as fases do ciclo celular G0 e G1 e diminuem a expressão de IFNγ de células Th1 enquanto aumentam a expressão de IL-4 de células Th2. As CTMs também inibem a proliferação de linfócitos B entre as fases do ciclo celular G0 e G1.
Propriedades antimicrobianas
As MSCs produzem vários peptídeos antimicrobianos (AMPs), incluindo catelicidina humana LL-37 , β-defensinas , lipocalina 2 e hepcidina . Esses peptídeos, juntamente com a enzima indoleamina 2,3-dioxigenase (IDO), são responsáveis pela atividade antibacteriana de amplo espectro das CTMs.
Significado clínico
As células-tronco mesenquimais podem ser ativadas e mobilizadas se necessário, mas sua eficiência, no caso de reparo muscular por exemplo, é atualmente muito baixa. Novos estudos sobre os mecanismos de ação das MSC podem fornecer caminhos para aumentar sua capacidade de reparo tecidual.
Doença auto-imune
Os estudos clínicos que investigam a eficácia das células-tronco mesenquimais no tratamento de doenças estão em desenvolvimento preliminar, particularmente para a compreensão de doenças autoimunes , doença do enxerto contra hospedeiro , doença de Crohn , esclerose múltipla , lúpus eritematoso sistêmico e esclerose sistêmica . Em 2014, nenhuma pesquisa clínica de alta qualidade fornece evidências de eficácia e existem inúmeras inconsistências e problemas nos métodos de pesquisa.
Outras doenças
Muitos dos primeiros sucessos clínicos usando o transplante intravenoso vieram em doenças sistêmicas, como doença do enxerto contra hospedeiro e sepse . A injeção direta ou a colocação de células em um local com necessidade de reparo pode ser o método de tratamento preferido, uma vez que a distribuição vascular sofre de um " efeito de primeira passagem pulmonar ", em que as células injetadas por via intravenosa são sequestradas nos pulmões.
Detecção
A Sociedade Internacional de Terapia Celular (ISCT) propôs um conjunto de padrões para definir as MSCs. Uma célula pode ser classificada como MSC se apresentar propriedades aderentes ao plástico em condições normais de cultura e apresentar morfologia semelhante à de fibroblastos. Na verdade, alguns argumentam que as MSCs e os fibroblastos são funcionalmente idênticos. Além disso, as CTMs podem sofrer diferenciação osteogênica, adipogênica e condrogênica ex vivo . As MSCs cultivadas também expressam em sua superfície CD73 , CD90 e CD105 , embora não tenham a expressão de marcadores de superfície CD11b , CD14 , CD19 , CD34 , CD45 , CD79a e HLA-DR .
Pesquisar
A maioria das técnicas de cultura modernas ainda usa uma abordagem de fibroblastos formadores de colônia (CFU-F), onde medula óssea não purificada ou células mononucleares da medula óssea purificadas por ficoll são semeadas diretamente em placas ou frascos de cultura de células . As células-tronco mesenquimais, mas não os glóbulos vermelhos ou progenitores hematopoéticos, aderem ao plástico de cultura de tecidos em 24 a 48 horas. No entanto, pelo menos uma publicação identificou uma população de MSCs não aderentes que não são obtidas pela técnica de plaqueamento direto.
Outros métodos baseados na citometria de fluxo permitem a classificação das células da medula óssea para marcadores de superfície específicos, como o STRO-1 . As células STRO-1 + são geralmente mais homogêneas e têm maiores taxas de aderência e maiores taxas de proliferação, mas as diferenças exatas entre as células STRO-1 + e MSCs não são claras.
Métodos de imunodepleção usando técnicas como MACS também têm sido usados na seleção negativa de MSCs.
A suplementação do meio basal com soro fetal bovino ou lisado de plaquetas humano é comum na cultura de CTM. Antes do uso de lisados de plaquetas para cultura de MSC, o processo de inativação do patógeno é recomendado para prevenir a transmissão do patógeno.
Nova pesquisa intitulada Transplante de esferóides de células-tronco mesenquimais derivadas de ESC humanas melhora a osteoartrite espontânea em macacos rhesus. Vários produtos químicos e métodos, incluindo irradiação a laser de baixa intensidade, têm sido usados para aumentar a proliferação de células-tronco.
História
Em 1924, o morfologista russo Alexander A. Maximov ( russo : Александр Александрович Максимов ); usaram extensos achados histológicos para identificar um tipo singular de célula precursora dentro do mesênquima que se desenvolve em diferentes tipos de células sanguíneas.
Os cientistas Ernest A. McCulloch e James E. Till revelaram pela primeira vez a natureza clonal das células da medula óssea na década de 1960. Um ensaio ex vivo para examinar o potencial clonogênico de células multipotentes da medula foi relatado posteriormente na década de 1970 por Friedenstein e colegas. Neste sistema de ensaio, as células do estroma foram referidas como fibroblastos de unidade formadora de colônias (CFU-f).
Os primeiros ensaios clínicos de MSCs foram concluídos em 1995, quando um grupo de 15 pacientes foi injetado com cultura de MSCs para testar a segurança do tratamento. Desde então, mais de 200 ensaios clínicos foram iniciados. No entanto, a maioria ainda está no estágio de segurança de testes.
Experimentos subsequentes revelaram a plasticidade das células da medula e como seu destino é determinado por pistas ambientais. A cultura de células estromais da medula na presença de estímulos osteogênicos, como ácido ascórbico , fosfato inorgânico e dexametasona, pode promover sua diferenciação em osteoblastos . Em contraste, a adição de fator transformador de crescimento beta (TGF-b) poderia induzir marcadores condrogênicos .
Controvérsias
Mais recentemente, tem havido algum debate sobre o uso do termo "células-tronco mesenquimais" e o que constitui o significado mais cientificamente correto para a sigla MSC. A maioria das células mesenquimais ou preparações "MSC" contêm apenas uma fração minoritária de verdadeiras células-tronco multipotentes, enquanto a maioria das células são de natureza estromal. Um dos pioneiros no campo das MSC, Dr. Arnold Caplan, propôs renomear as MSCs para significar "células sinalizadoras medicinais". No campo das células-tronco, as MSC passaram a se referir mais comumente a "células-tronco / estromais mesenquimais" devido à natureza heterogênea das preparações celulares.
Também há uma preocupação crescente com a comercialização e injeção de MSCs e células-tronco mesenquimais em pacientes por clínicas com fins lucrativos que não possuem dados rigorosos para sustentar esses usos clínicos.
Veja também
- Medula óssea
- Fibroblasto
- Ossificação intramembranosa
- Mesênquima
- Multipotência
- Forro do cabo
- Tecido Adiposo da Medula (MAT)
- Lista de tipos de células humanas derivadas das camadas germinativas
Referências
Leitura adicional
- Murphy MB, Moncivais K, Caplan AI (novembro de 2013). "Células-tronco mesenquimais: terapêutica ambientalmente responsiva para medicina regenerativa" . Experimental & Molecular Medicine . 45 (11): e54. doi : 10.1038 / emm.2013.94 . PMC 3849579 . PMID 24232253 .
links externos
- "Ficha informativa sobre células-tronco mesenquimais" . Euro Stem Cell . Junho de 2012. Arquivado do original em 27 de novembro de 2016 . Página visitada em 25 de junho de 2012 . revisado por cientistas e não muito técnico
- "Pesquisa de células-tronco mesenquimais" . Universidade Johns Hopkins . Arquivado do original em 15 de outubro de 2017 . Página visitada em 26 de junho de 2012 .