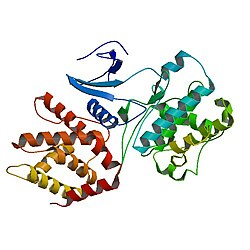
Quinase dependente de ciclina 5 - Cyclin-dependent kinase 5
A quinase 5 dependente de ciclina é uma proteína, e mais especificamente uma enzima, que é codificada pelo gene Cdk5. Foi descoberto há 15 anos e é expressado de forma saliente nos neurônios do sistema nervoso central (SNC) pós-mitóticos.
A molécula pertence à família da quinase dependente da ciclina . As quinases são enzimas que catalisam reações de fosforilação, processo que permite ao substrato ganhar um grupo fosfato doado por um composto orgânico conhecido como ATP. As fosforilações são de vital importância durante a glicólise , tornando as quinases uma parte essencial da célula devido ao seu papel no metabolismo, sinalização celular e muitos outros processos.
Estrutura
Cdk5 é uma serina / treonina quinase dirigida por prolina, que foi identificada pela primeira vez como um membro da família CDK devido à sua estrutura semelhante a CDC2 / CDK1 em humanos, uma proteína que desempenha um papel crucial na regulação do ciclo celular.
O gene Cdk5 contém 12 exons em uma região que contém cerca de 5.000 nucleotídeos (5kb), conforme foi determinado por Ohshima após clonar o gene Cdk5 que pertencia a um camundongo.
O Cdk5 possui 292 aminoácidos e apresenta estruturas em hélice α e fita β.
Embora Cdk5 tenha uma estrutura semelhante a outras quinases dependentes de ciclina, seus ativadores são altamente específicos ( CDK5R1 e CDK5R2 ).
Algumas investigações relataram que os estados ativos das proteínas quinases diferem estruturalmente uns dos outros a fim de preservar a geometria de sua maquinaria, de modo que a saída catalítica funcione adequadamente. A cinase Cdk5 também tem um design original.
Cdk5 pertence às proteínas quinases eucarióticas (ePKs). Uma estrutura cristalina do domínio catalítico da proteína quinase dependente de cAMP mostrou que ela possui 2 lóbulos; por um lado, possui o pequeno lóbulo, um N-terminal disposto como uma estrutura de folha β antiparalela, além disso, contém motivos de nucleotídeos como forma de orientar o nucleotídeo para a fosfo-transferência. Por outro lado, o grande lóbulo, um C-terminal, de formato helicoidal, que ajuda a identificar o substrato e inclui resíduos cruciais para a fosfotransferência.
Papel fisiológico
Dor
Recentemente, o Cdk5 emergiu como uma quinase essencial nas vias sensoriais. Relatórios recentes de Pareek et al. sugerem sua necessidade na sinalização de dor. Na verdade, o CDK5 é necessário para o desenvolvimento adequado do cérebro e, para ser ativado, deve se associar ao CDK5R1 ou ao CDK5R2 . Ao contrário de outras quinases dependentes de ciclina, CDK5 também não requer fosforilação na alça T, portanto, a ligação com o ativador é suficiente para ativar a quinase.
Neurônios
O Cdk5 é abundante e expresso principalmente em neurônios onde fosforila polímeros de proteínas de alto peso molecular chamados neurofilamentos, e tau de proteína associada a microtúbulos, abundantes no SNC (Sistema Nervoso Central). A enzima está envolvida em muitos aspectos do desenvolvimento e funções neuronais.
O principal papel do Cdk5 quando se trata de neurônios é garantir a migração neuronal adequada. Os neurônios enviarão dendritos e axônios para formar conexões com outros neurônios a fim de transmitir informações e o Cdk5 regula esse processo. Para funcionar, Cdk5 precisa ser ativado por p35 (estes 3 aminoácidos, Asp-259, Asn-266 e Ser-270, estão envolvidos na formação de ligações de hidrogênio com Cdk5) ou p39 (a isoforma de p35), que são duas de suas subunidades regulatórias específicas do neurônio. Isso significa que o nível de expressão de p35 e p39 vai estar relacionado à atividade da enzima: se houver uma alta atividade de Cdk5 durante o desenvolvimento do cérebro, haverá uma alta expressão de seus ativadores. Na verdade, quando os estudos foram conduzidos em camundongos sem p35 e p39, os resultados foram iguais aos observados em camundongos sem Cdk5: havia rompimentos evidentes das estruturas laminares no córtex cerebral, o bulbo olfatório, o hipocampo e o cerebelo. O desenvolvimento adequado e a funcionalidade dessas áreas dependem totalmente do Cdk5, que depende da expressão correta de p35 e p39. Além disso, o Cdk5 colabora com a sinalização de Reelin para garantir a migração neuronal adequada no cérebro em desenvolvimento.
Cdk5 não está apenas implicado na migração neuronal, a enzima também ajudará a controlar a extensão de neurites, formação de sinapses e transmissão sináptica. É importante notar também que o Cdk5 também regula o processo de apoptose, necessário para garantir que as conexões neurais formadas estejam corretas. Além disso, pelo fato de o Cdk5 também intervir na regulação da plasticidade sináptica, está implicado nos processos de aprendizagem e formação da memória, bem como na criação de dependência de drogas.
Além disso, Cdk5 modula a dinâmica da actina-citoesqueleto por fosporilação de Pak1 e filamina 1, e regula os microtúbulos por também fosforilação de tau, MAP1B, duplecortina, Nudel e CRMPs, que são todas proteínas associadas aos microtúbulos. Uma expressão inadequada de Cdk5 irá gerar defeitos nesses substratos que podem levar a várias doenças. Por exemplo, um defeito na filamina 1 em humanos provoca heterotopia periventricular; e um defeito em Lis1 e duplecortinas causará lissencefalia tipo 1. Na verdade, quatro membros de uma família muçulmana israelense consanguínea que sofria de lissencefalia-7 com hipoplasia cerebelar, tinham uma mutação no local de splice no gene Cdk5.
Abuso de drogas
Foi comprovado que o Cdk5 está diretamente relacionado ao uso de drogas. Sabemos que as drogas atuam no sistema de recompensa, alcançando sua ação perturbando as vias de transdução de sinais intracelulares. O Cdk5 está envolvido nesses neurossinais. O vício em drogas é uma consequência clara de uma experiência neuronal dependente e de plasticidade comportamental . Quando o consumo de drogas se torna um hábito repetitivo, ele modifica vários componentes da sinalização da dopamina, mudanças na expressão gênica e mudanças no circuito neuronal dos neurônios dopaminoceptivos.
Tomando o exemplo da cocaína, os efeitos dela são causados por CREB (cAMP Response Element Binding), que leva a uma explosão transitória na expressão gênica precoce imediata no corpo estriado, e também de ΔFosB (que se acumula e persiste nos neurônios estriados quando o o consumo do medicamento é regular). Muitos estudos revelaram que a superexpressão de ΔFosB devido ao abuso de drogas é a causa de uma suprarregulação de Cdk5 (porque está a jusante de ΔFosB no estriado, incluindo o núcleo accumbens).
Vamos agora ver o papel do Cdk5 em tudo isso. Foi descoberto que com a exposição a drogas como a cocaína e com a presença excessiva de ΔFosB, a quantidade de Cdk5 aumenta. Isso se deve a esses 2 fatores que regulam positivamente o p35, que ativa a produção da proteína Cdk5.
Também foi demonstrado que essa enzima tem um lugar importante na regulação da neurotransmissão da dopamina. De fato, o Cdk5 é capaz de modificar o sistema dopaminérgico fosforilando o DARPP-32. Sabemos que o nucleus accumbens está relacionado à dependência de drogas. Como consequência da quantidade crescente de Cdk5, há também um aumento no número de pontos de ramificação dendrítica e espinhos, tanto os neurônios espinhosos médios no núcleo accumbens quanto os neurônios piramidais no córtex pré-frontal medial . Daí a sua relação com o consumo de drogas e mais especificamente com o sistema de recompensa, que é desencadeado pelo consumo de drogas.
Analisando mais detalhadamente a relação entre a proporção de Cdk5 e os efeitos da droga, foi demonstrado que existem diferenças significativas dependendo da dose e da frequência de consumo da droga. Por exemplo, se a frequência da dose de cocaína for realmente espalhada no tempo ou concentrada em um único e longo período de tempo, os efeitos da cocaína estarão presentes ainda que a produção de Cdk5 no nucleus accumbens, na região tegmental ventral e pré-frontal o córtex não aumentará. No entanto, quando se trata de doses frequentes significativamente próximas no tempo, os efeitos da cocaína não são exibidos, apesar da proporção aumentada de Cdk5. Essas diferenças podem ser explicadas pelo fato de que o Cdk5 é um estado de transição para a superexposição a drogas como a cocaína.
Todas essas informações devem agora ser focadas em encontrar um uso terapêutico para o Cdk5, o que pode reduzir a sensação de recompensa quando usamos drogas regularmente. Em primeiro lugar, foi comprovado que o antagonista do Cdk5, após um longo tempo de uso, atua como um inibidor do crescimento de dendritos espinhosos nos neurônios do núcleo accumbens. Dessa forma, poderíamos tratar vícios. Em segundo lugar, pode ser usado como forma de diagnosticar o abuso de drogas, se decidirmos monitorar a quantidade de Cdk5 no paciente. Isso é possível porque o Cdk5 é produzido apenas como uma recompensa pelo uso de drogas, mas não como um mediador ou recompensa natural.
Pâncreas
Embora o papel principal do Cdk5 esteja relacionado à migração neuronal, seu impacto no corpo humano não se limita ao sistema nervoso. Na verdade, o Cdk5 desempenha um papel importante no controle da secreção de insulina no pâncreas.
Na verdade, esta enzima foi encontrada em células β pancreáticas e demonstrou reduzir a exocitose da insulina por fosforilação de L-VDCC ( canal de Ca 2+ dependente de voltagem do tipo L ).
Sistema imunológico
Durante a ativação das células T , o Cdk5 fosforila a coronina 1a, uma proteína que contribui para o processo de fagocitose e regula a polarização da actina . Portanto, essa quinase promove a sobrevivência e a motilidade das células T.
O Cdk5 também participa da produção de interleucina 2 (IL-2), uma citocina envolvida na sinalização celular , pelas células T. Para fazer isso, ele interrompe a repressão da transcrição da interleucina 2 pela histona desacetilase 1 (HDAC1) por meio da fosforilação da proteína mSin3a. Isso reduz a capacidade do complexo HDAC1 / mSin3a de se ligar ao promotor IL-2, o que leva a um aumento da produção de interleucina 2.
Regulação da exocitose
A exocitose da vesícula sináptica também é regulada pelo CdK5, com a fosforilação da proteína munc-18-a, indispensável para a secreção, pois possui grande afinidade com um derivado do receptor SNAP (proteína SNARE). Essa fosforilação foi demonstrada com a simulação da secreção de células neuroendócrinas, uma vez que a atividade do Cdk5 aumentou. Quando o Cdk5 foi removido, a secreção de norepinefrina diminuiu.
Memória
Graças a um experimento com ratos, foi demonstrada uma relação entre a memória e o Cdk5. Por um lado, os ratos não mostraram medo integrado por uma atividade anterior quando o Cdk5 foi inativado. Por outro lado, quando a atividade enzimática foi aumentada no hipocampo - onde as memórias são armazenadas - o medo reapareceu.
Remodelação do citoesqueleto de actina no cérebro
Durante a embriogênese , o Cdk5 é essencial para o desenvolvimento do cérebro, pois é crucial para a regulação do citoesqueleto que, por sua vez, é importante para a remodelação cerebral. Vários processos neuronais: a sinalização da dor, a drogadição, as mudanças de comportamento, a formação de memórias e o aprendizado, relacionados ao desenvolvimento do cérebro, derivam de rápidas modificações no citoesqueleto. Uma remodelação negativa do citoesqueleto neuronal estará associada a uma perda de sinapses e neurodegeneração em doenças cerebrais, onde a atividade do Cdk5 é desregulada. Portanto, a maior parte dos substratos Cdk5 estão relacionados ao esqueleto de actina; ambos, os fisiológicos e os patológicos. Alguns deles foram identificados nas últimas décadas: ephexin1, p27, Mst3, CaMKv, kalirin-7, RasGRF2, Pak1, WAVE1, neurabin-1, TrkB, 5-HT6R, talina, drebrina, sinapsina I, sinapsina III, CRMP1 , GKAP, SPAR, PSD-95 e LRRK2.
Regulagem do relógio circadiano
O relógio circadiano dos mamíferos é controlado por Cdk5 com a fosforilação de PER2. Em laboratório, o Cdk5 foi bloqueado no SCN (núcleos supraquiasmáticos, um oscilador mestre do sistema circadiano), conseqüentemente o período de free-running em camundongos foi reduzido. Durante o período diurno, o PER2 (no resíduo de serina 394) foi fosforilado pelo Cdk5, assim, o Criptocromo 1 (CRY1) poderia interagir facilmente com ele e o complexo PER2-CRY1 foi para o núcleo. O ciclo e o período circadiano molecular são devidamente estabelecidos graças à tarefa do Cdk5 como condutor nuclear dessas proteínas.
Regulador de apoptose celular e sobrevivência celular
Além de todas as funções mencionadas anteriormente, o Cdk5 está envolvido em várias funções celulares, como sobrevivência da mobilidade celular, apoptose e regulação gênica.
A membrana plasmática, o citosol e a região perinuclear são os locais onde os ativadores Cdk5 / p35 são encontrados. No entanto, o Cdk5 também pode ser ativado pela ciclina I , esse regulador causa um aumento na expressão de proteínas da família BCl-2, que estão associadas a funções antiapoptóticas.
Papel na doença
A explicação química de uma ampla variedade de distúrbios neurológicos leva ao Cdk5; a fosforilação anormal da tau é uma ação patológica realizada por essa quinase e os emaranhados neurofibrilares são as consequências.
Doenças neurodegenerativas
O Cdk5 desempenha um papel essencial no sistema nervoso central. Durante o processo de embriogênese, essa quinase é necessária para o desenvolvimento do cérebro; e em cérebros adultos, o Cdk5 é necessário para muitos processos neuronais; por exemplo, aprendizagem e formação de memórias. No entanto, se a atividade do Cdk5 for desregulada, pode levar a doenças neurológicas realmente graves, incluindo Alzheimer, Parkinson, esclerose múltipla e doença de Huntington.
- A doença de Alzheimer (DA) é responsável por 50-70% de todos os casos de demência. Alguns estudos mostraram que um excesso na atividade de Cdk5, uma proteína quinase dirigida por prolina, leva à hiperfosforilação de tau , um processo que é observado em muitos pacientes com DA. Os ativadores Cdk5, p35 e p39 (ambos são proteínas miristoiladas ancoradas às membranas celulares), podem ser clivados pela calpaína ativada por cálcio em p25 e p29. Isso resultará em uma migração das proteínas da membrana celular para as regiões nuclear e perinuclear e em uma desregulação da atividade de Cdk5. p25 e p29 têm meias-vidas que são 5 a 10 vezes mais longas do que as que têm p35 e p39. Isso é incrivelmente problemático devido ao fato de que pode levar ao acúmulo de ativadores Cdk5 e um excesso de atividade de Cdk5, o que causa hiperfosforilação de tau. Além disso, um aumento nos níveis de Aβ também pode levar à hiperfosforilação de tau, estimulando a produção de p25. Portanto, o Cdk5 poderia ser um alvo potencial para o tratamento de pacientes com DA, pois sua inibição poderia reduzir a hiperfosforilação de tau e, consequentemente, reduzir a formação de NFTs (emaranhados neurofibrilares) e retardar o processo de neurodegeneração.
- A doença de Huntington (DH) é outra doença neurodegenerativa que está de alguma forma ligada à atividade do Cdk5. A proteína 1 relacionada à dinamina ( Drp1 ) é um elemento essencial na fissão mitocondrial. Cdk5 pode alterar a distribuição subcelular de Drp1 e sua atividade. De fato, foi observado que a inibição da quinase excessivamente ativa permite que o Drp1 funcione adequadamente na fragmentação mitocondrial para evitar a neurotoxicidade no cérebro. Além disso, o Cdk5 pode ter influência na alteração da morfologia mitocondrial ou de seu potencial transmembrana, podendo levar à morte celular e neurodegeneração. Isso significa que o Cdk5 é um possível alvo terapêutico para tratar a disfunção mitocondrial que leva ao desenvolvimento da DH.
- Doença de Parkinson (DP): Cdk5 é considerado fortemente envolvido na doença de Parkinson. Essa doença neurodegenerativa é causada pela perda progressiva de células nervosas na parte do cérebro chamada substância negra , entre outras. Cdk5 é capaz de formar um complexo com p25 (peptídeo de clivagem de p35): Cdk5 / p25. P25 levará à hiperatividade de Cdk5. O resultado da formação desse complexo é a apoptose das células nervosas e a neuroinflamação. Esta descoberta pode ser usada para tratar a doença de Parkinson. Para inibir o complexo Cdk5 / p25, poderíamos usar um antagonista de Cdk5: CIP. Os resultados desse tratamento foram surpreendentemente positivos. De fato, podemos notar não apenas que os sintomas de Parkinson foram apaziguados, mas também que o CIP acabou protegendo a perda de neurônios dopaminérgicos na substância negra.
- Esclerose múltipla (EM): é uma das doenças em que a falha da remielinização pode provocar dano axonal duradouro e perda irreversível da função. A quinase 5 dependente de ciclina está envolvida no processo, pois regula os oligodendrócitos (desenvolvimento de OL9 e mielinização no SNC). Os inibidores de Cdk5 impedem a remielinização e interrompem a atividade das células neurais. A baixa expressão de MBP e proteína proteolipídica e a diminuição do número de axônios mielinizados indicam a falta de reparo da mielina.
Câncer
O Cdk5 está envolvido em cânceres invasivos, aparentemente por reduzir a atividade da proteína reguladora da actina caldesmon .
Embora Cdk5 não seja mutado em tecidos cancerosos, sua atividade e expressão são desreguladas. A quinase fosforila supressores tumorais e fatores de transcrição , que estão envolvidos na progressão do ciclo celular. O Cdk5 está envolvido na proliferação tumoral, migração, angiogênese e também na resistência à quimioterapia e imunidade antitumoral. Também participa das vias de sinalização que levam à metástase e regula o citoesqueleto e as aderências focais .
| Possíveis mecanismos de angiogênese mediados por Cdk5 | |
|---|---|
| O Cdk5 promove a expressão do fator de crescimento endotelial vascular (VEGF), uma proteína que regula a vasculogênese e a angiogênese, de acordo com um estudo sobre adenomas hipofisários. O VEGF estimula a divisão e migração das células endoteliais, bem como a permeabilidade vascular. | |
| O Cdk5 promove a angiogênese por meio da remodelação do citoesqueleto de actina via Rac1, uma GTPase de sinalização. Também pode regular a formação de lamelipódios, que são protrusões de membrana envolvidas na migração celular. | |
| A fosforilação do Cdk5 e a ativação da presenilina estimulam o NICD (domínio intracelular Notch). Como consequência, a sinalização dependente de Notch, uma via chave de promoção da angiogênese, é ativada. |
Um possível tratamento do câncer poderia consistir em direcionar o Cdk5 e evitar sua ligação aos seus ativadores e substratos.
Em estudos recentes, sobre a radioterapia em pacientes com câncer de pulmão de grandes células, verificou-se que a depleção de CDK5 diminui o desenvolvimento de câncer de pulmão e a resistência à radiação in vitro e in vivo. Foi demonstrado que uma diminuição no Cdk5 reduziu a expressão de TAZ, um componente da via do hipotálamo . Como resultado, essa perda atenua a ativação do sinal do hipotálamo. Consequentemente, o Cdk5 pode ser tratado como um alvo para combater o câncer de pulmão.
História
CDK5 foi originalmente denominado NCLK (Neuronal CDC2-Like Kinase) devido ao seu motivo de fosforilação semelhante. O CDK5 em combinação com um ativador também foi referido como Tau Protein Kinase II. Além disso, foi relatado que Cdk5 está envolvido na ativação de células T e desempenha um papel importante no desenvolvimento de doenças autoimunes, como a esclerose múltipla .
Mapa de caminho interativo
Clique nos genes, proteínas e metabólitos abaixo para acessar os respectivos artigos.
Interações
Foi demonstrado que a quinase 5 dependente de ciclina interage com diferentes moléculas e substratos:
- Ele interage com LMTK2 , NDEL1 , CDK5R1 , Nestin e PAK1 .
- O gene CABLES1 codifica uma proteína de ligação à quinase dependente de ciclina, cujo nome completo é Cdk5 e substrato 1 da enzima Abl . Esta proteína de ligação liga Cdk5 e c-Abl , uma tirosina quinase. O c-Abl ativo fosforila CDK5 na tirosina 15, um processo aprimorado pela proteína CABLES1. Como resultado, a atividade de Cdk5 / p35 em neurônios em desenvolvimento aumenta. CABOS1 e a fosforilação mencionada podem desempenhar um papel importante na regulação do crescimento do axônio .
- O gene denominado CABLES2 codifica outra proteína de ligação, o substrato 2 da enzima Cdk5 e Abl . Embora sua função seja desconhecida, pode estar envolvida na transição do ciclo celular G1-S , um estágio entre o crescimento celular e a replicação do DNA.
- Além disso, o Cdk5 fosforila a tirosina quinase associada à apoptose (AATK). Essa proteína provavelmente induz a parada do crescimento e apoptose das células precursoras mieloides , além de ativar o CdkR1.
- A enzima glutationa S-transferase P , codificada pelo gene GSTP1, causa uma regulação negativa ou redução da atividade de Cdk5. Isto é conseguido através da translocação de p25 / p35, a fim de prevenir a neurodegeneração .
- O Cdk5 liga-se à proteína Histona desacetilase 1 (HDAC1). Quando Cdk5 / p25 desregula HDAC1, a atividade anormal do ciclo celular aparece e o DNA de fita dupla se quebra, causando neurotoxicidade .
- A distribuição citoplasmática de Cdk5 é determinada pelos ativadores p35 e p39. Ambos os ativadores possuem motivos de localização, que levam à presença de Cdk5 na membrana plasmática e na região perinuclear . A miristoilação de p35 e p39 permite que Cdk5 se associe a membranas.
- Cdk5 também interage com a endonuclease APEX1 . A quinase fosforila Thr-233, causando um acúmulo de danos ao DNA e, eventualmente, a morte neuronal.
- Cdk5 fosforila e regula a proteína supressora de tumor p53 . Em células apoptóticas PC12 há um aumento simultâneo nos níveis de Cdk5 e p53, então acredita-se que o mecanismo pelo qual Cdk5 induz a apoptose poderia ser causado por fosforilação e ativação de p53.
- Uma vez que o Cdk5 é fosforilado por uma proteína chamada receptor EPH A4 , ele fosforila os fatores de troca de nucleotídeos da Guanina (NGEF) que regulam a RhoA e a morfogênese da coluna dendrítica.
- Cdk5 também fosforila a cinase de adesão focal (FAK). Isso pode estimular a translocação nuclear, que desempenha um papel importante na migração neuronal, regulando uma estrutura de microtúbulo associada ao centrossoma .
- O receptor 6 de 5-hidroxitriptamina (HTR6), que se acredita controlar a transmissão neuronal colinérgica no cérebro, gerencia a migração de neurônios piramidais durante a corticogênese . Para fazer isso, HTR6 regula a atividade de Cdk5.
- Cdk5 interage com CTNNB1 e CTNND2 também.
Referências
Leitura adicional
- Morishima-Kawashima M, Hasegawa M, Takio K, Suzuki M, Yoshida H, Watanabe A, Titani K, Ihara Y (1995). "Hiperfosforilação de tau em PHF". Neurobiologia do Envelhecimento . 16 (3): 365-71, discussão 371-80. doi : 10.1016 / 0197-4580 (95) 00027-C . PMID 7566346 . S2CID 22471158 .
- Peruzzi F, Gordon J, Darbinian N, Amini S (dezembro de 2002). "Desregulação induzida por Tat da diferenciação neuronal e sobrevivência pela via do fator de crescimento do nervo". Journal of Neurovirology . 8 Suplemento 2 (2): 91–6. doi : 10.1080 / 13550280290167885 . PMID 12491158 .
links externos
- Cyclin-Dependent + Kinase + 5 no US National Library of Medicine Medical Subject Headings (MeSH)
- Localização do gene humano CDK5 no navegador do genoma UCSC .
- Detalhes do gene humano CDK5 no navegador do genoma UCSC .