Proteorodopsina - Proteorhodopsin
| Proteorodopsina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Visualização de desenhos animados de proteorodopsina por ELViture
| |||||||||
| Identificadores | |||||||||
| Símbolo | Bac_rhodopsin | ||||||||
| Pfam | PF01036 | ||||||||
| InterPro | TCDB | ||||||||
| PRÓSITO | PDOC00291 | ||||||||
| SCOP2 | 2brd / SCOPe / SUPFAM | ||||||||
| TCDB | 3.E.1 | ||||||||
| Superfamília OPM | 6 | ||||||||
| Proteína OPM | 4hyj | ||||||||
| |||||||||
Proteorodopsina (também conhecida como rodopsina ) é uma família de mais de 50 proteínas retinilideno fotoativas , uma família maior de proteínas transmembrana que usam retinal como um cromóforo para funcionalidade mediada por luz, neste caso, uma bomba de prótons . Alguns homólogos existem como pentâmeros ou hexâmeros. A rodopsina é encontrada em bactérias planctônicas marinhas , arqueas e eucariotos ( protae ), mas foi descoberta pela primeira vez em bactérias.
Seu nome é derivado de proteobactérias que recebem o nome do grego antigo Πρωτεύς ( Proteus ), um antigo deus do mar mencionado por Homero como " Velho do Mar ", Ῥόδος (rhódon) para " rosa ", devido à sua cor rosada, e ὄψις ( opsis ) para "visão". Alguns membros da família, pigmentos homólogos semelhantes à rodopsina , ou seja, bacteriorodopsina (da qual existem mais de 800 tipos) têm funções sensoriais como opsinas , integrantes da fototransdução visual . Muitas dessas funções sensoriais são desconhecidas - por exemplo, a função da Neuropsina na retina humana. Os membros são conhecidos por terem diferentes espectros de absorção, incluindo luz visível verde e azul .
Descoberta
A proteorodopsina (PR ou rodopsina) foi descoberta pela primeira vez em 2000 em um cromossomo bacteriano artificial de γ-proteobactéria marinha previamente não cultivada , ainda referida apenas por seus dados metagenômicos de ribótipo, SAR86. A pesquisa foi um esforço cooperativo entre quatro partes: Oded Beja , Marcelino T. Suzuki e Edward F. DeLong no Monterey Bay Aquarium Research Institute (Mosslanding, CA), L. Aravind e Eugene V Koonin no National Center for Biotechnology Information ( Bethesda, MD), Andrew Hadd, Linh P. Nguyen, Stevan B. Jovanovich, Christian M. Gates e Rober A Feldman na Molecular Dynamics (Sunnyvale, CA) e, finalmente, John e Elena Spudich no Departamento de Microbiologia e Genética Molecular no Centro de Ciências da Saúde da Universidade do Texas em Houston . Mais espécies de γ-proteobactérias, tanto Gram positivas quanto negativas, foram encontradas para expressar a proteína.
Distribuição
Amostras de bactérias que expressam proteorrodopsina foram obtidas no Oceano Pacífico Oriental , Oceano Pacífico Central Norte e Oceano Antártico , Antártica . Posteriormente, genes de variantes da proteorodopsina foram identificados em amostras do Mediterrâneo , Mar Vermelho , Mar dos Sargaços , Mar do Japão e Mar do Norte .
As variantes da proteorodopsina não são espalhadas aleatoriamente, mas se dispersam ao longo de gradientes de profundidade com base na sintonia de absorção máxima da sequência de holoproteína particular ; isso se deve principalmente à absorção eletromagnética pela água, que cria gradientes de comprimento de onda em relação à profundidade. Oxyrrhis marina é um protista de dinoflagelado com proteorrodopsina de absorção de verde (um resultado do Grupo L109) que existe principalmente em poças de maré rasas e margens, onde a luz verde ainda está disponível. Karlodinium micrum, outro dinolagelato, expressa uma proteorrodopsina sintonizada em azul (E109) que pode estar relacionada às suas migrações verticais em águas profundas . O.Marina foi originalmente considerado um heterotrófico , no entanto, a proteorodopsina pode muito bem participar de uma maneira funcionalmente significativa, pois foi o gene nuclear mais abundantemente expresso e, além disso, está disperso de forma desigual no organismo, sugerindo alguma função da membrana da organela . Anteriormente, as únicas proteínas eucarióticas de transdução de energia solar eram o fotossistema I e o fotossistema II . Foi levantada a hipótese de que a transferência lateral de genes é o método pelo qual a proteorodopsina entrou em vários filos. Bactérias, archea e eukarya colonizam a zona fótica onde vêm à luz; A proteorrodopsina foi capaz de se disseminar por esta zona, mas não para outras partes da coluna d'água.
Taxonomia
A proteorrodopsina pertence a uma família de proteínas retinilideno semelhantes, mais semelhantes aos seus homólogos arqueados halorhodopsina e bacteriorodopsina. A rodopsina sensorial foi descoberta por Franz Christian Boll em 1876. A bacteriorodopsina foi descoberta em 1971 e nomeada em 1973 e atualmente só se sabe que existe no domínio arquea, não nas bactérias. Halorhodopsin foi descoberto e nomeado pela primeira vez em 1977. Bacteriorhodopsin e Halorhodopsin só existem no domínio Archea enquanto proteorhodopsin abrange bactérias, arquéias e eucariotos. A proteorodopsina compartilha sete hélices α transmembrana retinais covalentemente ligadas por um mecanismo de base de Schiff a um resíduo de lisina na sétima hélice (hélice G). A bacteriorodopsina, como a proteorodopsina, é uma bomba de prótons acionada pela luz. A rodopsina sensorial é uma proteína acoplada a G envolvida na visão.
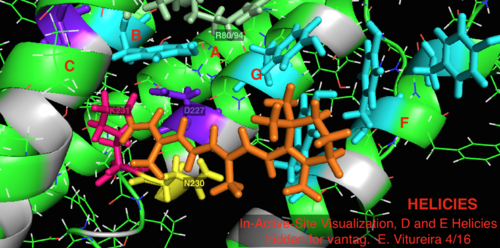
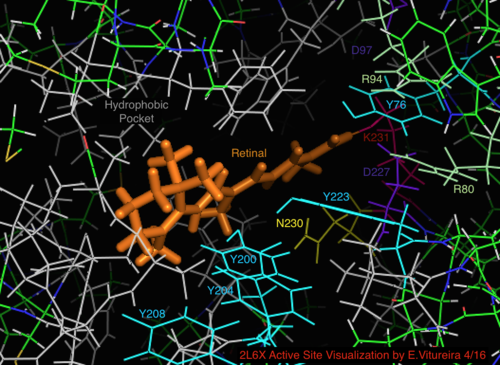
Site ativo
Em comparação com sua bacteriorodopsina homóloga arquea mais conhecida, a maioria dos resíduos do sítio ativo de importância conhecida para o mecanismo da bacterio-rodopsina são conservados na proteorodopsina. A similaridade de sequência não é significativamente conservada, no entanto, tanto da halo quanto da bacteriotopsina. Os homólogos dos resíduos do sítio ativo Arg 82, Asp 85 (o aceitador de prótons primário ), Asp 212 e Lys 216 (o sítio de ligação da base de Schiff retinal ) na bacteriorodopsina são conservados como Arg94, Asp97, Asp227 e Lys231 em proteorodopsina. No entanto, na proteorodopsina, não há resíduos de ácido carboxílico diretamente homólogos a Glu 194 ou Glu204 de bacteriorodopsina (ou Glu 108 e 204, dependendo da variante de bacRodopsina), que se pensa estarem envolvidos na via de liberação de prótons na superfície extracelular. No entanto, Asp97 e Arg94 podem substituir esta funcionalidade sem a proximidade de resíduo próximo como na bacteriorodopsina. O departamento de química da Syracuse University mostrou de forma decisiva que o Asp97 não pode ser o grupo de liberação de prótons, já que a liberação aconteceu em condições forçantes sob as quais o grupo do ácido aspártico permaneceu protonado.
Ligando
As partes rodopsina haloprotein da família do ligando da retina, Vitamina A aldeído, um dos muitos tipos de vitamina A. A retina é um conjugado poli- insaturado cromóforo ( polieno ), obtidos a partir de carnívoros dieta ou pela via caroteno ( β-caroteno 15,15 '-monoxigenase ).
Função
A proteorrodopsina funciona em todos os oceanos da Terra como uma bomba H + movida pela luz, por um mecanismo semelhante ao da bacteriorodopsina. Como na bacteriorodopsina, o cromóforo retinal da proteorodopsina está covalentemente ligado à apoproteína por meio de uma base de Schiff protonada em Lys231. A configuração do cromóforo retinal na proteorodopsina não fotolisada é predominantemente trans, e isomeriza para 13-cis após iluminação com luz. Vários modelos do fotociclo proteorhodopsin completa têm sido propostos, com base em FTIR e UV-visível espectroscopia ; eles se assemelham a modelos de fotociclo estabelecidos para bacteriorodopsina. Fotossistemas completos baseados em proteorodopsina foram descobertos e expressos em E. coli, dando-lhes capacidade adicional de gradiente de energia mediada por luz para geração de ATP sem necessidade externa de retina ou precursores; com o PR, o gene cinco outras proteínas codificam a via biossintética do fotopigmento.
Engenharia genética
Se o gene da proteorodopsina for inserido em E. coli e a retinal for dada a essas bactérias modificadas , elas irão incorporar o pigmento em sua membrana celular e bombear H + na presença de luz. Um roxo profundo é representativo de colônias claramente transformadas, devido à absorção de luz. Gradientes de prótons podem ser usados para alimentar outras estruturas de proteínas de membrana ou para acidificar uma organela do tipo vesícula. Foi ainda demonstrado que o gradiente de prótons gerado pela proteorodopsina poderia ser usado para gerar ATP.