Colina acetiltransferase - Choline acetyltransferase
| Colina acetiltransferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| EC nº | 2.3.1.6 | ||||||||
| CAS no. | 9012-78-6 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
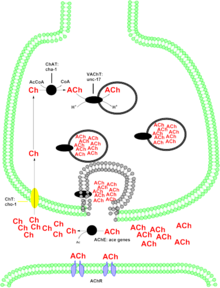
A colina acetiltransferase (comumente abreviada como ChAT , mas às vezes CAT ) é uma enzima transferase responsável pela síntese do neurotransmissor acetilcolina . O ChAT catalisa a transferência de um grupo acetil da coenzima acetil-CoA para a colina , produzindo acetilcolina (ACh). A ChAT é encontrada em alta concentração nos neurônios colinérgicos , tanto no sistema nervoso central (SNC) quanto no sistema nervoso periférico (SNP). Como ocorre com a maioria das proteínas terminais nervosas, a ChAT é produzida no corpo do neurônio e transportada para a terminação nervosa , onde sua concentração é mais alta. A presença de ChAT em uma célula nervosa classifica essa célula como um neurônio "colinérgico". Em humanos, a enzima colina acetiltransferase é codificada pelo gene CHAT .
História
A colina acetiltransferase foi descrita pela primeira vez por David Nachmansohn e AL Machado em 1943. Um bioquímico alemão, Nachmansohn estava estudando o processo de condução do impulso nervoso e a utilização de reações químicas produtoras de energia nas células, expandindo os trabalhos dos ganhadores do Nobel Otto Warburg e Otto Meyerhof sobre fermentação , glicólise e contração muscular . Com base em pesquisas anteriores mostrando que "as ações da acetilcolina nas proteínas estruturais" eram responsáveis pelos impulsos nervosos, Nachmansohn e Machado investigaram a origem da acetilcolina.
Uma enzima foi extraída do cérebro e do tecido nervoso que forma a acetilcolina. A formação ocorre apenas na presença de adenosinetrifosfato (ATP) . A enzima é chamada colina acetilase.
- Nachmanson & Machado, 1943
O modo de ação da acetil transferase era desconhecido na época desta descoberta, no entanto Nachmansohn levantou a hipótese da possibilidade de acetilfosfato ou fosforilcolina trocar o fosfato (de ATP ) por colina ou íon acetato. Foi só em 1945 que a Coenzima A (CoA) foi descoberta simultânea e independentemente por três laboratórios, sendo o de Nachmansohn um deles. Posteriormente, o acetil-CoA, na época chamado de “acetato ativo”, foi descoberto em 1951. A estrutura 3D do ChAT derivado de rato não foi resolvido até quase 60 anos depois, em 2004.
Estrutura
A estrutura 3D de ChAT foi resolvida por cristalografia de raios X PDB : 2FY2 . A colina é ligada ao sítio ativo de ChAT por interações não covalentes entre a amina carregada positivamente da colina e o grupo hidroxila de Tyr552, além de uma ligação de hidrogênio entre o grupo hidroxila da colina e um resíduo de histidina , His324.
O substrato de colina se encaixa em um bolso no interior do ChAT, enquanto o acetil-CoA se encaixa em um bolso na superfície da proteína. A estrutura de cristal 3D mostra que o grupo acetil do acetil-CoA confina com a bolsa de ligação da colina - minimizando a distância entre o doador e o receptor do grupo acetil.
Homologia
O ChAT é muito conservado em todo o genoma animal. Entre os mamíferos, em particular, há uma similaridade de sequência muito alta. ChAT humano e de gato ( Felis catus ), por exemplo, têm 89% de identidade de sequência. A identidade da sequência com Drosophila é de cerca de 30%.
Formas de ChAT
Existem duas formas de ChAT: forma solúvel e forma ligada à membrana. A forma solúvel é responsável por 80-90% da atividade enzimática total, enquanto a forma ligada à membrana é responsável pelo restante da atividade de 10-20%. No entanto, há muito se discute como a última forma de ChAT é ligada à membrana. A forma de ChAT ligada à membrana está associada a vesículas sinápticas.
Isoformas comuns e periféricas de ChAT
Existem duas isoformas de ChAT, ambas codificadas pela mesma sequência. O tipo comum de ChAT (cChAT) está presente tanto no SNC quanto no SNP. O tipo periférico ChAT (pChAT) é expresso preferencialmente no SNP em humanos e surge do salto de exon (exon 6-9) durante a modificação pós-transcricional . Portanto, a sequência de aminoácidos é muito semelhante, no entanto, o pChAT não contém partes da sequência presente no cChAT. A isoforma pChAT foi descoberta em 2000 com base em observações de que os anticorpos ChAT derivados do cérebro não conseguiram corar os neurônios colinérgicos periféricos como fazem com os encontrados no cérebro. Este mecanismo de splicing de genes que leva a diferenças de cChAT e pChAT foi observado em várias espécies, incluindo mamíferos vertebrados e moluscos invertebrados, sugerindo que esse mecanismo leva a alguma vantagem evolutiva ainda não identificada.
Função
Os sistemas colinérgicos estão implicados em várias funções neurológicas. A alteração em alguns neurônios colinérgicos pode ser responsável pelos distúrbios da doença de Alzheimer . A proteína codificada por este gene sintetiza o neurotransmissor acetilcolina . A acetilcolina atua em duas classes de receptores no sistema nervoso central - muscarínico e nicotínico - que estão cada um implicado em diferentes respostas fisiológicas. O papel da acetilcolina no receptor nicotínico ainda está sob investigação. Provavelmente está implicado nas vias de recompensa / reforço, conforme indicado pela natureza aditiva da nicotina , que também se liga ao receptor nicotínico. A ação muscarínica da acetilcolina no SNC está implicada na aprendizagem e na memória. A perda da inervação colinérgica no neocórtex tem sido associada à perda de memória, como é evidenciado em casos avançados de doença de Alzheimer. No sistema nervoso periférico , os neurônios colinérgicos estão implicados no controle das funções viscerais, tais como, mas não se limitando a, contração do músculo cardíaco e função do trato gastrointestinal.
É frequentemente usado como um marcador imuno-histoquímico para neurônios motores (motoneurônios).
Mutações
Mutantes de ChAT foram isolados em várias espécies, incluindo C. elegans , Drosophila e humanos. A maioria dos mutantes não letais que têm um fenótipo de tipo não selvagem exibe alguma atividade, mas significativamente menos do que o tipo selvagem.
Em C. elegans , várias mutações em ChAT foram rastreadas até o gene cha-1. Todas as mutações resultam em uma queda significativa na atividade de ChAT. A perda percentual de atividade pode ser maior que 98% em alguns casos. Os efeitos fenotípicos incluem crescimento lento, tamanho reduzido, comportamento descoordenado e falta de sensibilidade aos inibidores da colinesterase . Mutantes sensíveis à temperatura isolados em Drosophila foram todos letais. Antes da morte, as moscas afetadas mostram uma mudança no comportamento, incluindo movimentos descontrolados e uma mudança na atividade do eletrorretinograma .
O gene humano responsável pela codificação de ChAT é CHAT. Mutações no CHAT têm sido associadas à síndrome miastênica congênita , uma doença que leva à deficiência e fraqueza geral da função motora. Outros sintomas incluem apnéia fatal . De dez mutantes isolados, 1 demonstrou não ter atividade completamente, 8 demonstrou ter atividade significativamente diminuída e 1 tem uma função desconhecida.
Significado clínico
doença de Alzheimer
A doença de Alzheimer (DA) envolve dificuldade de memória e cognição. As concentrações de acetilcolina e ChAT são notavelmente reduzidas no neocórtex cerebral e no hipocampo. Embora a perda celular e a disfunção dos neurônios colinérgicos sejam consideradas contribuintes para a doença de Alzheimer, geralmente não são consideradas um fator primário no desenvolvimento dessa doença. É proposto que a agregação e deposição da proteína beta amilóide interfere no metabolismo dos neurônios e danifica ainda mais os axônios colinérgicos no córtex e os neurônios colinérgicos no prosencéfalo basal.
Esclerose lateral amiotrófica
A esclerose lateral amiotrófica (ELA) é uma das doenças mais comuns do neurônio motor. Uma perda significativa de imunorreatividade de ChAT é encontrada em ALS. A hipótese é que a função colinérgica esteja envolvida em um aumento descontrolado da concentração de cálcio intracelular cuja razão ainda permanece obscura.
Drogas
Metilsulfato de neostigmina, um agente anticolinesterásico, tem sido usado para direcionar a ChAT. Em particular, o uso de metilsulfato de neostigmina demonstrou ter efeitos positivos contra a síndrome miastênica congênita.
A exposição ao estradiol demonstrou aumentar a ChAT em ratas.
Veja também
Referências
Leitura adicional
- Oda Y (2000). "Colina acetiltransferase: a estrutura, distribuição e alterações patológicas no sistema nervoso central". Pathol. Int . 49 (11): 921–37. doi : 10.1046 / j.1440-1827.1999.00977.x . PMID 10594838 . S2CID 23621617 .
- Wang J, Fu X, Zhang D, Yu L, Li N, Lu Z, Gao Y, Wang M, Liu X, Zhou C, Han W, Yan B, Wang J (2017). "Neurônios ChAT-positivos participam da neurogênese da zona subventricular após a oclusão da artéria cerebral média em camundongos" . Behav. Brain Res . 316 : 145–151. doi : 10.1016 / j.bbr.2016.09.007 . PMC 5048585 . PMID 27609645 .
- Oda Y, Nakanishi I, Deguchi T (1993). "Um DNA complementar para a colina acetiltransferase humana induz duas formas de enzima com pesos moleculares diferentes em células em cultura". Brain Res. Mol. Brain Res . 16 (3–4): 287–94. doi : 10.1016 / 0169-328X (92) 90237-6 . PMID 1337937 .
- Wang J, Lu Z, Fu X, Zhang D, Yu L, Li N, Gao Y, Liu X, Yin C, Ke J, Li L, Zhai M, Wu S, Fan J, Lv L, Liu J, Chen X , Yang Q, Wang J (2017). "A via de sinalização do receptor nicotínico alfa-7 participa da neurogênese induzida por neurônios positivos para ChAT na zona subventricular" . Transl Stroke Res . 8 (5): 484–493. doi : 10.1007 / s12975-017-0541-7 . PMC 5704989 . PMID 28551702 .
- Toussaint JL, Geoffroy V, Schmitt M, Werner A, Garnier JM, Simoni P, Kempf J (1992). "Human colina acetiltransferase (CHAT): sequência parcial do gene e regiões de controle potencial". Genômica . 12 (2): 412–6. doi : 10.1016 / 0888-7543 (92) 90395-9 . PMID 1339386 .
- Lorenzi MV, Trinidad AC, Zhang R, Strauss WL (1992). "Dois mRNAs são transcritos do gene humano para colina acetiltransferase". DNA Cell Biol . 11 (8): 593–603. doi : 10.1089 / dna.1992.11.593 . PMID 1388731 .
- Misawa H., Ishii K., Deguchi T (1992). "Gene expression of mouse choline acetyltransferase. Alternative splicing e identificação de uma região promotora altamente ativa" . J. Biol. Chem . 267 (28): 20392–9. doi : 10.1016 / S0021-9258 (19) 88714-8 . PMID 1400357 .
- Cervini R, Rocchi M, DiDonato S, Finocchiaro G (1992). "Isolamento e localização sub-cromossômica de um fragmento de DNA do gene da colina acetiltransferase humana". Neurosci. Lett . 132 (2): 191–4. doi : 10.1016 / 0304-3940 (91) 90299-9 . PMID 1784419 . S2CID 23030200 .
- Strauss WL, Kemper RR, Jayakar P, Kong CF, Hersh LB, Hilt DC, Rabin M (1991). "Mapas do gene da colina acetiltransferase humana para a região 10q11-q22.2 por hibridização in situ". Genômica . 9 (2): 396–8. doi : 10.1016 / 0888-7543 (91) 90273-H . PMID 1840566 .
- Viegas-Péquignot E, Berrard S, Brice A, Apiou F, Mallet J (1991). "Localização de um fragmento de 900 pb de comprimento do gene da colina acetiltransferase humana para 10q11.2 por hibridização in situ não radioativa". Genômica . 9 (1): 210–2. doi : 10.1016 / 0888-7543 (91) 90242-7 . PMID 2004764 .
- Itoh N, Slemmon JR, Hawke DH, Williamson R, Morita E, Itakura K., Roberts E, Shively JE, Crawford GD, Salvaterra PM (1986). "Cloning of Drosophila choline acetyltransferase cDNA" . Proc. Natl. Acad. Sci. EUA . 83 (11): 4081–5. Bibcode : 1986PNAS ... 83.4081I . doi : 10.1073 / pnas.83.11.4081 . PMC 323670 . PMID 3086876 .
- Hersh LB, Takane K., Gylys K., Moomaw C., Slaughter C (1988). "Conservação das sequências de aminoácidos entre a colina acetiltransferase humana e suína". J. Neurochem . 51 (6): 1843–5. doi : 10.1111 / j.1471-4159.1988.tb01166.x . PMID 3183663 . S2CID 24613238 .
- Berrard S, Brice A, Lottspeich F, Braun A, Barde YA, Mallet J (1988). "Clonagem de cDNA e sequência completa de colina acetiltransferase porcina: tradução in vitro do RNA correspondente produz uma proteína ativa" . Proc. Natl. Acad. Sci. EUA . 84 (24): 9280–4. doi : 10.1073 / pnas.84.24.9280 . PMC 373252 . PMID 3480542 .
- Chireux MA, Le Van Thai A. Weber MJ (1995). "Human choline acetyltransferase gene: localization of alternative first exons". J. Neurosci. Res . 40 (4): 427–38. doi : 10.1002 / jnr.490400402 . PMID 7616604 . S2CID 42856768 .
- Bausero P, Schmitt M, Toussaint JL, Simoni P, Geoffroy V, Queuche D, Duclaud S, Kempf J, Quirin-Stricker C (1993). "Identificação e análise do promotor do gene da colina acetiltransferase humana". NeuroReport . 4 (3): 287–90. doi : 10.1097 / 00001756-199303000-00015 . PMID 7682855 .
- Quirin-Stricker C, Nappey V, Simoni P, Toussaint JL, Schmitt M (1994). "Transativação pelos receptores do hormônio tireoidiano da região flanqueadora 5 'do gene ChAT humano". Brain Res. Mol. Brain Res . 23 (3): 253–65. doi : 10.1016 / 0169-328X (94) 90232-1 . PMID 8057782 .
- Erickson JD, Varoqui H, Schäfer MK, Modi W, Diebler MF, Weihe E, Rand J, Eiden LE, Bonner TI, Usdin TB (1994). "Identificação funcional de um transportador vesicular de acetilcolina e sua expressão a partir de um locus gênico" colinérgico " . J. Biol. Chem . 269 (35): 21929–32. doi : 10.1016 / S0021-9258 (17) 31734-9 . PMID 8071310 .
- Kengaku M., Misawa H., Deguchi T. (1993). "Multiple mRNA species of choline acetyltransferase from rat spinal cord". Brain Res. Mol. Brain Res . 18 (1–2): 71–6. doi : 10.1016 / 0169-328X (93) 90174-N . PMID 8479291 .
- Misawa H, Matsuura J, Oda Y, Takahashi R, Deguchi T (1997). "Os mRNAs de colina acetiltransferase humana com diferentes regiões 5 'produzem um produto de tradução principal de 69 kDa". Brain Res. Mol. Brain Res . 44 (2): 323–33. doi : 10.1016 / S0169-328X (96) 00231-8 . PMID 9073174 .
- Lönnerberg P, Ibáñez CF (1999). "Novos transcritos de mRNA específicos do testículo que codificam a colina acetiltransferase truncada no terminal N". Mol. Reprod. Dev . 53 (3): 274–81. doi : 10.1002 / (SICI) 1098-2795 (199907) 53: 3 <274 :: AID-MRD3> 3.0.CO; 2-8 . PMID 10369388 .
- Sakakibara A, Hattori S (2000). "Chat, uma proteína adaptadora associada a Cas / HEF1 que integra várias vias de sinalização" . J. Biol. Chem . 275 (9): 6404–10. doi : 10.1074 / jbc.275.9.6404 . PMID 10692442 .
links externos
- Colina + acetiltransferase na Biblioteca Nacional de Medicina dos EUA. Cabeçalhos de assuntos médicos (MeSH)