Contração muscular - Muscle contraction
A contração muscular é a ativação de locais geradores de tensão dentro das células musculares . Na fisiologia , a contração muscular não significa necessariamente encurtamento muscular porque a tensão muscular pode ser produzida sem alterações no comprimento do músculo, como ao segurar um livro pesado ou um halter na mesma posição. O término da contração muscular é seguido pelo relaxamento muscular , que é um retorno das fibras musculares ao seu estado gerador de baixa tensão.
As contrações musculares podem ser descritas com base em duas variáveis: comprimento e tensão. Uma contração muscular é descrita como isométrica se a tensão muscular muda, mas o comprimento do músculo permanece o mesmo. Em contraste, uma contração muscular é isotônica se a tensão muscular permanecer a mesma durante a contração. Se o comprimento do músculo encurta, a contração é concêntrica; se o comprimento do músculo aumenta, a contração é excêntrica. Nos movimentos naturais subjacentes à atividade locomotora , as contrações musculares são multifacetadas, pois são capazes de produzir mudanças no comprimento e na tensão de uma maneira que varia com o tempo. Portanto, nem o comprimento nem a tensão provavelmente permanecerão os mesmos nos músculos que se contraem durante a atividade locomotora.
Em vertebrados , as contrações do músculo esquelético são neurogênicas , pois requerem entrada sináptica dos neurônios motores . Um único neurônio motor é capaz de inervar várias fibras musculares, fazendo com que as fibras se contraiam ao mesmo tempo. Uma vez inervados, os filamentos de proteína dentro de cada fibra muscular esquelética deslizam uns sobre os outros para produzir uma contração, que é explicada pela teoria do filamento deslizante . A contração produzida pode ser descrita como um tique , somatório ou tétano, dependendo da frequência dos potenciais de ação . Nos músculos esqueléticos, a tensão muscular é máxima quando o músculo é alongado a um comprimento intermediário, conforme descrito pela relação comprimento-tensão.
Ao contrário do músculo esquelético, as contrações dos músculos lisos e cardíacos são miogênicas (o que significa que são iniciadas pelas próprias células do músculo liso ou cardíaco em vez de serem estimuladas por um evento externo, como a estimulação nervosa), embora possam ser moduladas por estímulos do sistema nervoso autônomo . Os mecanismos de contração nesses tecidos musculares são semelhantes aos dos tecidos musculares esqueléticos.
Tipos
As contrações musculares podem ser descritas com base em duas variáveis: força e comprimento. A própria força pode ser diferenciada como tensão ou carga. A tensão muscular é a força exercida pelo músculo em um objeto, enquanto uma carga é a força exercida por um objeto no músculo. Quando a tensão muscular muda sem nenhuma mudança correspondente no comprimento do músculo, a contração muscular é descrita como isométrica. Se o comprimento do músculo muda enquanto a tensão do músculo permanece a mesma, então a contração do músculo é isotônica. Em uma contração isotônica, o comprimento do músculo pode encurtar para produzir uma contração concêntrica ou aumentar para produzir uma contração excêntrica. Nos movimentos naturais subjacentes à atividade locomotora, as contrações musculares são multifacetadas, pois são capazes de produzir mudanças no comprimento e na tensão de uma maneira que varia com o tempo. Portanto, nem o comprimento nem a tensão provavelmente permanecerão constantes quando o músculo estiver ativo durante a atividade locomotora.
Contração isométrica
Uma contração isométrica de um músculo gera tensão sem alterar o comprimento. Um exemplo pode ser encontrado quando os músculos da mão e do antebraço seguram um objeto; as articulações da mão não se movem, mas os músculos geram força suficiente para evitar que o objeto caia.
Contração isotônica
Na contração isotônica , a tensão no músculo permanece constante, apesar de uma mudança no comprimento do músculo. Isso ocorre quando a força de contração de um músculo corresponde à carga total no músculo.
Contração concêntrica
Na contração concêntrica, a tensão muscular é suficiente para superar a carga e o músculo encurta à medida que se contrai. Isso ocorre quando a força gerada pelo músculo excede a carga que se opõe à sua contração.
Durante uma contração concêntrica, um músculo é estimulado a se contrair de acordo com a teoria do filamento deslizante . Isso ocorre em todo o comprimento do músculo, gerando uma força na origem e na inserção, fazendo com que o músculo encurte e alterando o ângulo da articulação. Em relação ao cotovelo , uma contração concêntrica do bíceps faria com que o braço se dobrasse no cotovelo conforme a mão se movia da perna para o ombro (uma rosca direta de bíceps ). Uma contração concêntrica do tríceps mudaria o ângulo da articulação na direção oposta, endireitando o braço e movendo a mão em direção à perna.
Contração excêntrica
Na contração excêntrica , a tensão gerada enquanto isométrica é insuficiente para superar a carga externa no músculo e as fibras musculares se alongam conforme se contraem. Em vez de trabalhar para puxar uma articulação na direção da contração muscular, o músculo atua para desacelerar a articulação no final de um movimento ou controlar o reposicionamento de uma carga. Isso pode ocorrer involuntariamente (por exemplo, ao tentar mover um peso muito pesado para o músculo levantar) ou voluntariamente (por exemplo, quando o músculo está 'suavizando' um movimento ou resistindo à gravidade, como durante uma caminhada em declive). A curto prazo, o treinamento de força envolvendo contrações excêntricas e concêntricas parece aumentar a força muscular mais do que o treinamento apenas com contrações concêntricas. No entanto, o dano muscular induzido pelo exercício também é maior durante o alongamento das contrações.
Durante uma contração excêntrica do músculo bíceps , o cotovelo inicia o movimento enquanto está dobrado e então se endireita quando a mão se afasta do ombro . Durante uma contração excêntrica do músculo tríceps , o cotovelo inicia o movimento reto e então se dobra conforme a mão se move em direção ao ombro. Desmina , titina e outras proteínas da linha-z estão envolvidas nas contrações excêntricas, mas seu mecanismo é mal compreendido em comparação com o ciclo de crossbridge em contrações concêntricas.
Embora o músculo esteja fazendo uma quantidade negativa de trabalho mecânico (trabalho está sendo feito no músculo), a energia química (originalmente de oxigênio , liberada por gordura ou glicose e temporariamente armazenada em ATP ) é consumida, embora menos do que seria consumido durante uma contração concêntrica da mesma força. Por exemplo, gasta-se mais energia subindo um lance de escada do que descendo o mesmo lance.
Os músculos submetidos a uma carga excêntrica pesada sofrem maiores danos quando sobrecarregados (como durante a construção muscular ou exercício de treinamento de força ) em comparação com a carga concêntrica. Quando as contrações excêntricas são usadas no treinamento com pesos, normalmente são chamadas de negativas . Durante uma contração concêntrica, os miofilamentos musculares deslizam uns sobre os outros, puxando as linhas Z juntas. Durante uma contração excêntrica, os miofilamentos deslizam uns sobre os outros no sentido oposto, embora o movimento real das cabeças de miosina durante uma contração excêntrica não seja conhecido. O exercício com uma carga excêntrica pesada pode realmente suportar um peso maior (os músculos são aproximadamente 40% mais fortes durante as contrações excêntricas do que durante as contrações concêntricas) e também resulta em maior dano muscular e dor muscular de início retardado um a dois dias após o treinamento. O exercício que incorpora contrações musculares excêntricas e concêntricas (isto é, envolvendo uma forte contração e uma redução controlada do peso) pode produzir maiores ganhos de força do que as contrações concêntricas isoladas. Embora contrações excêntricas pesadas não habituais possam facilmente levar ao supertreinamento , o treinamento moderado pode conferir proteção contra lesões.
Contrações excêntricas em movimento
Contrações excêntricas normalmente ocorrem como uma força de frenagem em oposição a uma contração concêntrica para proteger as articulações de danos. Durante praticamente qualquer movimento rotineiro, as contrações excêntricas ajudam a manter os movimentos suaves, mas também podem retardar movimentos rápidos, como um soco ou arremesso. Parte do treinamento para movimentos rápidos, como arremessar durante o beisebol, envolve a redução da frenagem excêntrica, permitindo que uma maior potência seja desenvolvida ao longo do movimento.
Contrações excêntricas estão sendo pesquisadas por sua capacidade de acelerar a reabilitação de tendões fracos ou lesados. Foi demonstrado que a tendinite de Aquiles e a tendinite patelar (também conhecida como joelho de salto ou tendonose patelar) se beneficiam de contrações excêntricas de alta carga.
Vertebrados
Em animais vertebrados , existem três tipos de tecidos musculares: esquelético, liso e cardíaco. O músculo esquelético constitui a maior parte da massa muscular do corpo e é responsável pela atividade locomotora. O músculo liso forma os vasos sanguíneos , o trato gastrointestinal e outras áreas do corpo que produzem contrações sustentadas. Os músculos cardíacos constituem o coração, que bombeia sangue. Os músculos esqueléticos e cardíacos são chamados de músculo estriado por causa de sua aparência listrada ao microscópio, que se deve ao padrão alternado altamente organizado de bandas A e I.
Músculo esquelético
Excluindo os reflexos, todas as contrações dos músculos esqueléticos ocorrem como resultado do esforço consciente originado no cérebro . O cérebro envia sinais eletroquímicos através do sistema nervoso para o neurônio motor que inerva várias fibras musculares. No caso de alguns reflexos , o sinal de contração pode se originar na medula espinhal por meio de um loop de feedback com a substância cinzenta. Outras ações, como locomoção, respiração e mastigação, têm um aspecto reflexo: as contrações podem ser iniciadas consciente ou inconscientemente.
Junção neuromuscular
Uma junção neuromuscular é uma sinapse química formada pelo contato entre um neurônio motor e uma fibra muscular . É o local no qual um neurônio motor transmite um sinal a uma fibra muscular para iniciar a contração muscular. A sequência de eventos que resulta na despolarização da fibra muscular na junção neuromuscular começa quando um potencial de ação é iniciado no corpo celular de um neurônio motor, que é então propagado por condução saltatória ao longo de seu axônio em direção à junção neuromuscular. Uma vez que atinge o botão terminal , o potencial de ação causa um Ca2+
influxo de íons no terminal por meio dos canais de cálcio dependentes de voltagem . O Ca2+
o influxo faz com que vesículas sinápticas contendo o neurotransmissor acetilcolina se fundam com a membrana plasmática, liberando acetilcolina na fenda sináptica entre o terminal do neurônio motor e a junção neuromuscular da fibra muscular esquelética. A acetilcolina se difunde através da sinapse e se liga e ativa os receptores nicotínicos da acetilcolina na junção neuromuscular. A ativação do receptor nicotínico abre seu canal intrínseco de sódio / potássio , fazendo com que o sódio entre e o potássio goteje para fora. Como resultado, o sarcolema inverte a polaridade e sua voltagem salta rapidamente do potencial de membrana em repouso de -90mV para tão alto quanto + 75mV quando o sódio entra. O potencial de membrana então se torna hiperpolarizado quando o potássio sai e é então ajustado de volta ao potencial de membrana em repouso. Essa flutuação rápida é chamada de potencial da placa terminal. Os canais iônicos dependentes de voltagem do sarcolema próximo à placa terminal se abrem em resposta ao potencial da placa terminal. Eles são específicos do sódio e do potássio e só permitem a passagem de um. Essa onda de movimentos iônicos cria o potencial de ação que se espalha a partir da placa motora em todas as direções. Se os potenciais de ação param de chegar, a acetilcolina deixa de ser liberada do botão terminal. A acetilcolina restante na fenda sináptica é degradada pela acetilcolina esterase ativa ou reabsorvida pelo botão sináptico e não sobra nada para substituir a acetilcolina degradada.
Alternância excitação-contração
O acoplamento excitação-contração é o processo pelo qual um potencial de ação muscular na fibra muscular faz com que as miofibrilas se contraiam. No músculo esquelético, o acoplamento de excitação-contração depende de um acoplamento direto entre proteínas-chave, o canal de liberação de cálcio do retículo sarcoplasmático (SR) (identificado como receptor de rianodina 1 , RYR1) e canais de cálcio tipo L dependentes de voltagem (identificados como receptores de diidropiridina , DHPRs). DHPRs estão localizados no sarcolema (que inclui o sarcolema de superfície e os túbulos transversos ), enquanto os RyRs residem através da membrana SR. A próxima aposição de um túbulo transverso e duas regiões SR contendo RyRs é descrita como uma tríade e é predominantemente onde ocorre o acoplamento excitação-contração. O acoplamento excitação-contração ocorre quando a despolarização da célula do músculo esquelético resulta em um potencial de ação muscular, que se espalha pela superfície da célula e na rede de túbulos T da fibra muscular , despolarizando assim a porção interna da fibra muscular. A despolarização das porções internas ativa os receptores de diidropiridina nas cisternas terminais, que estão em estreita proximidade com os receptores de rianodina no retículo sarcoplasmático adjacente . Os receptores de diidropiridina ativados interagem fisicamente com os receptores de rianodina para ativá-los por meio de processos de pé (envolvendo mudanças conformacionais que ativam alostericamente os receptores de rianodina). À medida que os receptores de rianodina se abrem, o Ca2+
é liberado do retículo sarcoplasmático para o espaço juncional local e se difunde no citoplasma para causar uma centelha de cálcio . Observe que o retículo sarcoplasmático tem uma grande capacidade de tamponamento de cálcio , parcialmente devido a uma proteína de ligação ao cálcio chamada calsequestrina . A ativação quase síncrona de milhares de faíscas de cálcio pelo potencial de ação causa um aumento de cálcio em toda a célula, dando origem ao movimento ascendente do transiente de cálcio . O Ca2+
liberado no citosol liga-se à troponina C pelos filamentos de actina , para permitir o ciclo da ponte cruzada, produzindo força e, em algumas situações, movimento. O sarco / retículo endoplasmático cálcio-ATPase (SERCA) bombeia Ca ativamente2+
de volta ao retículo sarcoplasmático. Como Ca2+
declina de volta aos níveis de repouso, a força diminui e ocorre o relaxamento.
Teoria do filamento deslizante
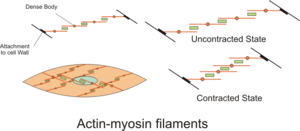
A teoria do filamento deslizante descreve um processo usado pelos músculos para se contrair. É um ciclo de eventos repetitivos que fazem com que um filamento fino deslize sobre um filamento grosso e gere tensão no músculo. Foi desenvolvido independentemente por Andrew Huxley e Rolf Niedergerke e por Hugh Huxley e Jean Hanson em 1954. Fisiologicamente, essa contração não é uniforme no sarcômero; a posição central dos filamentos grossos torna-se instável e pode mudar durante a contração. No entanto, as ações das proteínas elásticas, como a titina, são hipotetizadas para manter a tensão uniforme através do sarcômero e puxar o filamento espesso para uma posição central.
Ciclo de ponte cruzada
O ciclo de ponte cruzada é uma sequência de eventos moleculares que fundamenta a teoria do filamento deslizante. Uma ponte cruzada é uma projeção de miosina, que consiste em duas cabeças de miosina, que se estende a partir dos filamentos grossos. Cada cabeça de miosina tem dois locais de ligação: um para ATP e outro para actina. A ligação do ATP a uma cabeça de miosina separa a miosina da actina , permitindo assim que a miosina se ligue a outra molécula de actina. Uma vez ligado, o ATP é hidrolisado pela miosina, que usa a energia liberada para se mover para a "posição armada", por meio da qual se liga fracamente a uma parte do local de ligação da actina. O restante do local de ligação da actina é bloqueado pela tropomiosina . Com o ATP hidrolisado, a cabeça de miosina inclinada agora contém ADP + P i . Two Ca2+
os íons se ligam à troponina C nos filamentos de actina. A troponina- Ca2+
complexo faz com que a tropomiosina deslize e desbloqueie o restante do local de ligação da actina. O desbloqueio do resto dos locais de ligação da actina permite que as duas cabeças da miosina se fechem e a miosina se ligue fortemente à actina. A cabeça de miosina então libera o fosfato inorgânico e inicia um golpe de força, que gera uma força de 2 pN. O golpe de força move o filamento de actina para dentro, encurtando o sarcômero . A miosina então libera ADP, mas ainda permanece fortemente ligada à actina. No final do golpe de força, o ADP é liberado da cabeça da miosina, deixando a miosina ligada à actina em um estado de rigor até que outro ATP se ligue à miosina. A falta de ATP resultaria no estado de rigor característico do rigor mortis . Assim que outro ATP se liga à miosina, a cabeça da miosina se separa novamente da actina e ocorre outro ciclo de pontes cruzadas.
O ciclo da ponte cruzada é capaz de continuar, desde que haja quantidades suficientes de ATP e Ca2+
no citoplasma. O término do ciclo da ponte cruzada pode ocorrer quando o Ca2+
é ativamente bombeado de volta para o retículo sarcoplasmático. Quando Ca2+
não está mais presente no filamento fino, a tropomiosina muda de conformação de volta ao seu estado anterior para bloquear os locais de ligação novamente. A miosina deixa de se ligar ao filamento fino e o músculo relaxa. O Ca2+
íons deixam a molécula de troponina para manter o Ca2+
concentração de íons no sarcoplasma. O bombeamento ativo de Ca2+
íons no retículo sarcoplasmático cria uma deficiência no fluido ao redor das miofibrilas. Isso causa a remoção do Ca2+
íons da troponina. Assim, o complexo tropomiosina-troponina cobre novamente os locais de ligação nos filamentos de actina e a contração cessa.
Gradação das contrações do músculo esquelético
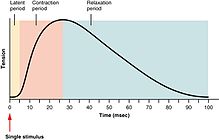
A força das contrações do músculo esquelético pode ser amplamente separada em contração , somação e tétano . Uma contração muscular é um ciclo único de contração e relaxamento produzido por um potencial de ação dentro da própria fibra muscular. O tempo entre um estímulo ao nervo motor e a subsequente contração do músculo inervado é chamado de período latente , que geralmente leva cerca de 10 ms e é causado pelo tempo que leva para o potencial de ação do nervo se propagar, o tempo para a transmissão química no junção neuromuscular e, em seguida, as etapas subsequentes do acoplamento excitação-contração.
Se outro potencial de ação muscular fosse produzido antes do relaxamento completo de uma contração muscular, então a contração seguinte simplesmente somaria a contração anterior, produzindo assim uma soma . A soma pode ser obtida de duas maneiras: soma de frequência e soma de múltiplas fibras . Na soma de frequência , a força exercida pelo músculo esquelético é controlada pela variação da frequência com que os potenciais de ação são enviados às fibras musculares. Os potenciais de ação não chegam aos músculos de forma síncrona e, durante uma contração, alguma fração das fibras do músculo estará disparando a qualquer momento. Em uma circunstância típica, quando os humanos estão exercendo seus músculos com tanta força quanto são conscientemente capazes, cerca de um terço das fibras em cada um desses músculos dispara de uma vez, embora essa proporção possa ser afetada por vários fatores fisiológicos e psicológicos (incluindo Órgãos tendinosos de Golgi e células de Renshaw ). Esse nível 'baixo' de contração é um mecanismo de proteção para evitar a avulsão do tendão - a força gerada por uma contração de 95% de todas as fibras é suficiente para danificar o corpo. Na soma de múltiplas fibras , se o sistema nervoso central envia um sinal fraco para contrair um músculo, as unidades motoras menores , sendo mais excitáveis do que as maiores, são estimuladas primeiro. À medida que a força do sinal aumenta, mais unidades motoras são excitadas, além de unidades maiores, com as maiores unidades motoras tendo até 50 vezes a força contrátil que as menores. À medida que mais e maiores unidades motoras são ativadas, a força de contração muscular torna-se progressivamente mais forte. Um conceito conhecido como princípio do tamanho permite que uma gradação da força muscular durante a contração fraca ocorra em pequenos passos, que se tornam progressivamente maiores quando maiores quantidades de força são necessárias.
Finalmente, se a frequência dos potenciais de ação muscular aumenta de tal forma que a contração muscular atinge seu pico de força e platôs neste nível, então a contração é um tétano .
Relação comprimento-tensão
A relação comprimento-tensão relaciona a força de uma contração isométrica ao comprimento do músculo no qual a contração ocorre. Os músculos operam com maior tensão ativa quando próximos de um comprimento ideal (geralmente seu comprimento de repouso). Quando alongado ou encurtado além disso (seja pela ação do próprio músculo ou por uma força externa), a tensão ativa máxima gerada diminui. Essa diminuição é mínima para pequenos desvios, mas a tensão cai rapidamente à medida que o comprimento se desvia mais do ideal. Devido à presença de proteínas elásticas dentro de uma célula muscular (como a titina) e da matriz extracelular, como o músculo é alongado além de um determinado comprimento, há uma tensão inteiramente passiva, que se opõe ao alongamento. Combinado, há uma forte resistência ao alongamento de um músculo ativo muito além do pico de tensão ativa.
Relações força-velocidade
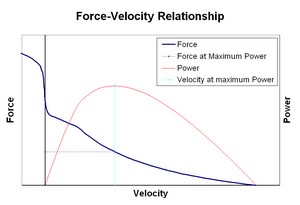
A relação força-velocidade relaciona a velocidade com que um músculo muda seu comprimento (geralmente regulado por forças externas, como carga ou outros músculos) com a quantidade de força que ele gera. A força diminui de uma forma hiperbólica em relação à força isométrica à medida que a velocidade de encurtamento aumenta, eventualmente chegando a zero em alguma velocidade máxima. O inverso é verdadeiro para quando o músculo é alongado - a força aumenta acima do máximo isométrico, até finalmente atingir um máximo absoluto. Esta propriedade intrínseca do tecido muscular ativo desempenha um papel no amortecimento ativo das articulações que são acionadas por músculos opostos simultaneamente ativos. Nesses casos, o perfil força-velocidade aumenta a força produzida pelo músculo em alongamento às custas do músculo em encurtamento. Este favorecimento de qualquer músculo retorna a articulação ao equilíbrio efetivamente aumenta o amortecimento da articulação. Além disso, a força do amortecimento aumenta com a força muscular. O sistema motor pode, assim, controlar ativamente o amortecimento articular por meio da contração simultânea (co-contração) de grupos musculares opostos.
Músculo liso
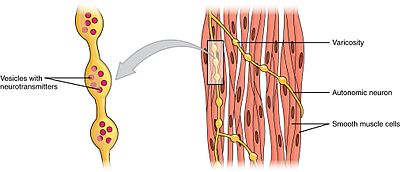
Os músculos lisos podem ser divididos em dois subgrupos: unidade única e multiunidades . As células musculares lisas de uma unidade podem ser encontradas no intestino e nos vasos sanguíneos. Como essas células estão ligadas entre si por junções comunicantes, elas são capazes de se contrair como um sincício funcional . As células musculares lisas de uma unidade se contraem miogenicamente, que podem ser moduladas pelo sistema nervoso autônomo.
Ao contrário das células musculares lisas de uma unidade, as células musculares lisas com várias unidades são encontradas no músculo do olho e na base dos folículos capilares. As células do músculo liso com várias unidades se contraem ao serem estimuladas separadamente pelos nervos do sistema nervoso autônomo. Como tal, eles permitem um controle preciso e respostas graduais, bem como o recrutamento de unidades motoras no músculo esquelético.
Mecanismos de contração do músculo liso
A atividade contrátil das células musculares lisas pode ser tônica (sustentada) ou fásica (transitória) e é influenciada por múltiplas entradas, como atividade elétrica espontânea, entradas neurais e hormonais, mudanças locais na composição química e alongamento. Isso contrasta com a atividade contrátil das células do músculo esquelético, que depende de uma única entrada neural. Alguns tipos de células musculares lisas são capazes de gerar seus próprios potenciais de ação espontaneamente, o que geralmente ocorre após um potencial de marca - passo ou de onda lenta . Esses potenciais de ação são gerados pelo influxo de Ca extracelular2+
e não Na+
. Como os músculos esqueléticos, Ca citosólico2+
íons também são necessários para o ciclo da ponte cruzada nas células musculares lisas.
As duas fontes de Ca citosólico2+
nas células musculares lisas estão o Ca extracelular2+
entrando pelos canais de cálcio e o Ca2+
íons que são liberados do retículo sarcoplasmático. A elevação do Ca citosólico2+
resulta em mais Ca2+
ligação à calmodulina , que então se liga e ativa a quinase de cadeia leve da miosina . O complexo cálcio-calmodulina-miosina-cadeia leve quinase fosforila a miosina nas cadeias leves de miosina de 20 quilodaltons (kDa) no resíduo de aminoácido serina 19, iniciando a contração e ativando a miosina ATPase . Ao contrário das células do músculo esquelético, as células do músculo liso carecem de troponina, embora contenham a proteína de filamento fino tropomiosina e outras proteínas notáveis - caldesmon e calponina. Assim, as contrações do músculo liso são iniciadas pelo Ca2+
-fosforilação ativada de miosina em vez de Ca2+
ligação ao complexo de troponina que regula os locais de ligação da miosina na actina, como nos músculos esqueléticos e cardíacos.
O término do ciclo da ponte cruzada (e deixando o músculo em estado de bloqueio) ocorre quando a fosfatase da cadeia leve da miosina remove os grupos fosfato das cabeças da miosina. A fosforilação das cadeias leves de miosina de 20 kDa se correlaciona bem com a velocidade de encurtamento do músculo liso. Durante este período, há uma rápida explosão de utilização de energia medida pelo consumo de oxigênio. Poucos minutos após o início, o nível de cálcio diminui acentuadamente, a fosforilação das cadeias leves de miosina de 20 kDa diminui e a utilização de energia diminui; entretanto, a força no músculo liso tônico é mantida. Durante a contração do músculo, pontes cruzadas de ciclo rápido se formam entre a actina ativada e a miosina fosforilada, gerando força. É hipotetizado que a manutenção da força resulta de "pontes de engate" desfosforiladas que fazem um ciclo lento e mantêm a força. Acredita-se que uma série de quinases, como rho quinase , DAPK3 e proteína quinase C, participam da fase sustentada de contração, e Ca2+
o fluxo pode ser significativo.
Neuromodulação
Embora as contrações do músculo liso sejam miogênicas, a taxa e a força de suas contrações podem ser moduladas pelo sistema nervoso autônomo . As fibras nervosas pós-ganglionares do sistema nervoso parassimpático liberam o neurotransmissor acetilcolina, que se liga aos receptores muscarínicos de acetilcolina (mAChRs) nas células musculares lisas. Esses receptores são metabotrópicos , ou receptores acoplados à proteína G, que iniciam uma cascata de segundo mensageiro. Por outro lado, as fibras nervosas pós-ganglionares do sistema nervoso simpático liberam os neurotransmissores epinefrina e norepinefrina, que se ligam a receptores adrenérgicos que também são metabotrópicos. Os efeitos exatos sobre o músculo liso dependem das características específicas do receptor ativado - tanto a entrada parassimpática quanto a simpática podem ser excitatórias (contráteis) ou inibitórias (relaxamento).
Músculo cardíaco
Existem dois tipos de células musculares cardíacas: autorítmicas e contráteis. As células autorítmicas não se contraem, mas, em vez disso, definem o ritmo de contração de outras células do músculo cardíaco, que podem ser moduladas pelo sistema nervoso autônomo. Em contraste, as células musculares contráteis (cardiomiócitos) constituem a maior parte do músculo cardíaco e são capazes de se contrair.
Alternância excitação-contração
Tanto no acoplamento excitação-contração (EC) do músculo esquelético e cardíaco , ocorrem os processos de condução de despolarização e liberação de Ca 2+ . No entanto, embora as proteínas envolvidas sejam semelhantes, elas são distintas em estrutura e regulação. Os receptores de diidropiridina (DHPRs) são codificados por diferentes genes, e os receptores de rianodina (RyRs) são isoformas distintas. Além disso, os contatos de DHPR com RyR1 (isoforma RyR principal no músculo esquelético) para regular a liberação de Ca 2+ no músculo esquelético, enquanto o canal de cálcio do tipo L (DHPR em miócitos cardíacos) e RyR2 (isoforma RyR principal em músculo cardíaco) não são fisicamente acoplados no músculo cardíaco, mas face um ao outro por um acoplamento juncional.
Ao contrário do músculo esquelético, acredita-se que o acoplamento EC no músculo cardíaco dependa principalmente de um mecanismo denominado liberação de cálcio induzida pelo cálcio , que se baseia na estrutura juncional entre o túbulo T e o retículo sarcoplasmático. Junctophilin-2 (JPH2) é essencial para manter esta estrutura, bem como a integridade de t-túbulo . Outra proteína, a proteína acessória receptora 5 (REEP5), funciona para manter a morfologia normal da RS juncional. Defeitos de acoplamento juncional podem resultar de deficiências de qualquer uma das duas proteínas. Durante o processo de liberação de cálcio induzida pelo cálcio, os RyR2s são ativados por um gatilho de cálcio, que é provocado pelo fluxo de Ca 2+ através dos canais de cálcio do tipo L. Depois disso, o músculo cardíaco tende a exibir estruturas diad , ao invés de tríades .
O acoplamento excitação-contração nas células do músculo cardíaco ocorre quando um potencial de ação é iniciado por células marcapasso no nó sinoatrial ou nó atrioventricular e conduzido para todas as células do coração por meio de junções comunicantes . O potencial de ação viaja ao longo da membrana superficial para os túbulos T (os últimos não são vistos em todos os tipos de células cardíacas) e a despolarização causa Ca extracelular2+
para entrar na célula através dos canais de cálcio do tipo L e possivelmente trocador de sódio-cálcio (NCX) durante a parte inicial da fase de platô . Embora esse influxo de Ca 2+ conte apenas para cerca de 10% do Ca 2+ necessário para a ativação, ele é relativamente maior do que o do músculo esquelético. Este Ca2+
influxo causa um pequeno aumento local no Ca intracelular2+
. O aumento do Ca intracelular2+
é detectado pelo RyR2 na membrana do retículo sarcoplasmático, que libera Ca2+
em uma resposta fisiológica de feedback positivo . Este feedback positivo é conhecido como liberação de cálcio induzida por cálcio e dá origem a faíscas de cálcio ( Ca2+
faíscas). A soma espacial e temporal de ~ 30.000 Ca2+
as faíscas aumentam a concentração de cálcio citoplasmático em toda a célula. O aumento do cálcio citosólico seguindo o fluxo de cálcio através da membrana celular e retículo sarcoplasmático é moderado por tampões de cálcio , que se ligam a uma grande proporção do cálcio intracelular. Como resultado, um grande aumento no cálcio total leva a um aumento relativamente pequeno no Ca livre2+
.
O cálcio citoplasmático se liga à troponina C, movendo o complexo da tropomiosina para fora do local de ligação da actina, permitindo que a cabeça da miosina se ligue ao filamento de actina. Deste ponto em diante, o mecanismo contrátil é essencialmente o mesmo do músculo esquelético (acima). Resumidamente, usando a hidrólise de ATP, a cabeça da miosina puxa o filamento de actina em direção ao centro do sarcômero.
Após a sístole, o cálcio intracelular é absorvido pela bomba sarcoplasmática de retículo endoplasmático ATPase (SERCA) de volta para o retículo sarcoplasmático, pronta para o início do próximo ciclo. O cálcio também é ejetado da célula principalmente pelo trocador sódio-cálcio (NCX) e, em menor grau, por uma ATPase de cálcio da membrana plasmática . Algum cálcio também é absorvido pelas mitocôndrias. Uma enzima, o fosfolambam , serve como freio para a SERCA. Em baixas frequências cardíacas, o fosfolambam é ativo e desacelera a atividade da ATPase para que o Ca2+
não precisa deixar a célula totalmente. Em altas frequências cardíacas, o fosfolambam é fosforilado e desativado, portanto, tomando a maior parte do Ca2+
do citoplasma de volta ao retículo sarcoplasmático. Mais uma vez, os tampões de cálcio moderam esta queda em Ca2+
concentração, permitindo uma diminuição relativamente pequena no Ca livre2+
concentração em resposta a uma grande mudança no cálcio total. A queda Ca2+
a concentração permite que o complexo de troponina se dissocie do filamento de actina, encerrando assim a contração. O coração relaxa, permitindo que os ventrículos se encham de sangue e reiniciem o ciclo cardíaco.
Invertebrados
Músculos circulares e longitudinais
Em anelídeos como minhocas e sanguessugas , células dos músculos circulares e longitudinais formam a parede corporal desses animais e são responsáveis por seus movimentos. Em uma minhoca que se move através do solo, por exemplo, as contrações dos músculos circulares e longitudinais ocorrem reciprocamente, enquanto o fluido celômico serve como um hidrosqueleto , mantendo a turgidez da minhoca. Quando os músculos circulares nos segmentos anteriores se contraem, a porção anterior do corpo do animal começa a se contrair radialmente, o que empurra o fluido celômico incompressível para frente e aumenta o comprimento do animal. Como resultado, a extremidade dianteira do animal se move para frente. À medida que a extremidade anterior da minhoca fica ancorada e os músculos circulares nos segmentos anteriores relaxam, uma onda de contrações musculares longitudinais passa para trás, puxando o resto do corpo do animal para frente. Essas ondas alternadas de contrações circulares e longitudinais são chamadas de peristaltismo , que é a base do movimento de rastejamento das minhocas.
Músculos estriados obliquamente
Invertebrados, como anelídeos, moluscos e nematóides , possuem músculos estriados obliquamente, que contêm bandas de filamentos grossos e finos que são dispostos helicoidalmente em vez de transversalmente, como nos músculos esqueléticos ou cardíacos dos vertebrados. Em bivalves , os músculos estriados obliquamente podem manter a tensão por longos períodos sem usar muita energia. Os bivalves usam esses músculos para manter suas conchas fechadas.
Músculos assíncronos
Insetos avançados como vespas , moscas , abelhas e besouros possuem músculos assíncronos que constituem os músculos de vôo desses animais. Esses músculos de vôo são freqüentemente chamados de músculos fibrilares porque contêm miofibrilas que são grossas e evidentes. Uma característica notável desses músculos é que eles não requerem estimulação para cada contração muscular. Conseqüentemente, eles são chamados de músculos assíncronos porque o número de contrações nesses músculos não corresponde (ou sincroniza) com o número de potenciais de ação. Por exemplo, um músculo da asa de uma mosca amarrada pode receber potenciais de ação a uma frequência de 3 Hz, mas é capaz de bater a uma frequência de 120 Hz. A batida de alta frequência é possível porque os músculos estão conectados a um sistema ressonante , que é conduzido a uma frequência natural de vibração.
História
Em 1780, Luigi Galvani descobriu que os músculos das pernas das rãs mortas estremeciam quando atingidos por uma faísca elétrica. Essa foi uma das primeiras incursões no estudo da bioeletricidade , um campo que ainda estuda os padrões e sinais elétricos em tecidos como nervos e músculos.
Em 1952, o termo acoplamento excitação-contração foi cunhado para descrever o processo fisiológico de conversão de um estímulo elétrico em uma resposta mecânica. Esse processo é fundamental para a fisiologia muscular, onde o estímulo elétrico costuma ser um potencial de ação e a resposta mecânica é a contração. O acoplamento excitação-contração pode ser desregulado em muitas doenças. Embora o acoplamento excitação-contração seja conhecido há mais de meio século, ainda é uma área ativa da pesquisa biomédica. O esquema geral é que chega um potencial de ação para despolarizar a membrana celular. Por mecanismos específicos ao tipo de músculo, essa despolarização resulta em um aumento do cálcio citosólico que é chamado de transiente de cálcio. Esse aumento no cálcio ativa as proteínas contráteis sensíveis ao cálcio que, então, usam o ATP para causar o encurtamento das células.
O mecanismo de contração muscular evitou os cientistas por anos e requer pesquisas e atualizações contínuas. A teoria do filamento deslizante foi desenvolvida independentemente por Andrew F. Huxley e Rolf Niedergerke e por Hugh Huxley e Jean Hanson . Suas descobertas foram publicadas como dois artigos consecutivos publicados na edição de 22 de maio de 1954 da Nature sob o tema comum "Alterações estruturais no músculo durante a contração".
Veja também
- Termos anatômicos de movimento
- liberação de cálcio induzida por cálcio
- Potencial de ação cardíaca
- Cãibra
- Distonia
- Fisiologia do exercício
- Fasciculação
- Modelo muscular de Hill
- Idiota hipnótico
- Teste muscular in vitro
- Paradoxo de Lombard
- Mioclonia
- Rigidez cadavérica
- Espasmo
- Contração uterina
Referências
Leitura adicional
- Saladin, Kenneth S., Stephen J. Sullivan e Christina A. Gan. (2015). Anatomia e Fisiologia: A Unidade de Forma e Função. 7ª ed. Nova York: McGraw-Hill Education.
- Krans, JL (2010) The Sliding Filament Theory of Muscle Contraction. Nature Education 3 (9): 66