Brugia malayi - Brugia malayi
| Brugia malayi | |
|---|---|
|
|
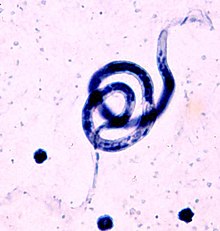
| B. malayi , esfregaço de sangue, coloração de Giemsa | |
|
Classificação científica |
|
| Reino: | Animalia |
| Filo: | Nematoda |
| Aula: | Chromadorea |
| Pedido: | Rhabditida |
| Família: | Onchocercidae |
| Gênero: | Brugia |
| Espécies: |
B. malayi
|
| Nome binomial | |
|
Brugia malayi SL Brug, 1927
|
|
Brugia malayi é um nematóide filarial ( transmitido por artrópodes ) (lombriga), um dos três agentes causadores da filariose linfática em humanos. A filariose linfática, também conhecida como elefantíase , é uma condição caracterizada pelo inchaço dos membros inferiores. As duas outras causas filariais de filariose linfática são Wuchereria bancrofti e Brugia timori , que diferem de B. malayi morfológica, sintomaticamente e em extensão geográfica.
B. malayi é transmitida pelos mosquitos Mansonia e é restrita ao sul e sudeste da Ásia. É uma das doenças tropicais com eliminação até o ano 2020 pela Organização Mundial da Saúde , o que impulsionou o desenvolvimento de vacinas e medicamentos, além de novos métodos de controle do vetor.
sinais e sintomas
| Brugia malayi | |
|---|---|
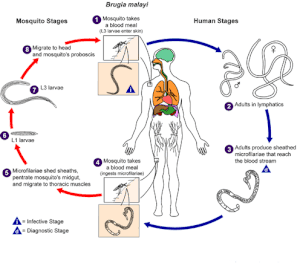 | |
| O ciclo de vida de Brugia malayi . | |
| Especialidade | Doença infecciosa |
B. malayi é um dos agentes causadores da filariose linfática , uma condição caracterizada por infecção e edema do sistema linfático. A doença é causada principalmente pela presença de vermes nos vasos linfáticos e a resposta inflamatória resultante do hospedeiro. Os sinais de infecção são tipicamente consistentes com aqueles observados na filariose de Bancroft - febre, linfadenite , linfangite , linfedema e infecção bacteriana secundária - com algumas exceções.
Linfadenite
A linfadenite , o inchaço dos gânglios linfáticos, é um sintoma comumente reconhecido de muitas doenças. É uma manifestação precoce da filariose, geralmente ocorre na área inguinal durante a infecção por B. malayi e pode ocorrer antes de os vermes amadurecerem.
Linfangite
Linfangite é a inflamação dos vasos linfáticos em resposta à infecção. Ocorre no início da infecção em resposta ao desenvolvimento de vermes, muda, morte ou infecção bacteriana e fúngica. Os vasos linfáticos afetados tornam-se distendidos e sensíveis, e a pele subjacente torna-se eritematosa e quente. A formação de abscesso e a ulceração do linfonodo afetado ocorrem ocasionalmente durante a infecção por B. malayi , mais frequentemente do que na filariose de Bancroft. Restos de vermes adultos às vezes podem ser encontrados na drenagem da úlcera.
Linfedema
O sinal mais óbvio de infecção, a elefantíase, é o aumento dos membros - geralmente as pernas. Uma complicação tardia da infecção, a elefantíase é uma forma de linfedema e é causada por inflamação repetida dos vasos linfáticos. Reações inflamatórias repetidas causam dilatação dos vasos e espessamento dos vasos linfáticos afetados, o que pode comprometer a função. O sistema linfático normalmente funciona para manter o equilíbrio de fluidos entre os tecidos e o sangue e atua como parte integrante do sistema imunológico. O bloqueio desses vasos devido a fibrose induzida por inflamação, vermes mortos ou reações granulomatosas pode interferir no equilíbrio normal de fluidos, causando inchaço nas extremidades. Elefantíase resultante da infecção por B. malayi geralmente afeta as porções distais das extremidades. Ao contrário da filariose de Bancroft, B. malayi raramente afeta a genitália e não causa funiculite, orquite, epididimite, hidrocele ou quilúria, condições mais frequentemente observadas na infecção por Bancroft.
Infecção bacteriana secundária
A infecção bacteriana secundária é comum entre pacientes com filariose. A função imunológica comprometida devido a danos linfáticos, além de ulcerações dos linfonodos e exposição a abscessos e circulação prejudicada devido à elefantíase pode causar infecção bacteriana ou fúngica secundária. A elefantíase, além da carga física de um membro inchado, pode ser uma condição gravemente debilitante devido à infecção bacteriana. Parte da "Estratégia para Eliminar a Filariose Linfática" da OMS visa programas de promoção da higiene a fim de aliviar o sofrimento dos indivíduos afetados (ver Estratégias de Prevenção).
No entanto, as manifestações clínicas da infecção são variáveis e dependem de vários fatores, incluindo o sistema imunológico do hospedeiro, a dose infecciosa e as diferenças entre as cepas do parasita. A maioria das infecções parece assintomática, embora varie de indivíduo para indivíduo. Indivíduos que vivem em áreas endêmicas com microfilaremia podem nunca apresentar sintomas evidentes, ao passo que, em outros casos, apenas alguns vermes podem exacerbar uma resposta inflamatória grave.
O desenvolvimento da doença em humanos, entretanto, não é bem compreendido. Os adultos geralmente desenvolvem sintomas piores, devido ao longo tempo de exposição necessário para a infecção. A infecção pode ocorrer durante a infância, mas a doença parece levar muitos anos para se manifestar. O período de incubação da infecção varia de 1 mês a 2 anos e normalmente as microfilárias aparecem antes dos sintomas evidentes. O linfedema pode se desenvolver em seis meses e o desenvolvimento de elefantíase foi relatado dentro de um ano da infecção entre os refugiados, que são mais ingênuos do ponto de vista imunológico. Os homens tendem a desenvolver sintomas piores do que as mulheres.
Causa
Ciclo da vida
O desenvolvimento e a replicação de B. malayi ocorrem em duas fases distintas: no mosquito vetor e no humano. Ambos os estágios são essenciais para o ciclo de vida do parasita.
Mosquito: O mosquito serve como vetor biológico e hospedeiro intermediário - é necessário para o ciclo de desenvolvimento e transmissão de B. malayi .
4. O mosquito se alimenta de sangue humano e ingere microfilárias (ovos revestidos de vermes) que circulam na corrente sanguínea humana.
5-7 No mosquito, as microfilárias liberam bainhas, penetram no intestino médio e migram para os músculos torácicos onde as microfilárias aumentam de tamanho, mudam e se desenvolvem em larvas infectantes (L1 e L3) ao longo de um período de 7–21 dias. Nenhuma multiplicação ou reprodução sexual de microfilárias ocorre no mosquito.
8-1 As larvas infectantes (L3) migram para as glândulas salivares, entram na tromba e escapam para a pele humana quando o mosquito faz outra refeição de sangue.
Humano: B. malayi passa por um maior desenvolvimento na reprodução humana e sexual e na produção de ovos.
1-2 As larvas infectantes (L3) penetram ativamente na pele através do orifício da picada e se desenvolvem em adultos no sistema linfático em um período de 6 meses. Os vermes adultos podem sobreviver no sistema linfático de 5 a 15 anos
3. Os vermes adultos machos e fêmeas acasalam-se e as fêmeas produzem uma média de 10.000 ovos com bainha (microfilárias) diariamente. As microfilárias entram na corrente sanguínea e exibem periodicidade e subperiodicidade noturna.
4. Outro mosquito se alimenta de sangue e ingere as microfilárias. A infecção depende de o mosquito se alimentar de sangue durante um episódio periódico - quando as microfilárias estão presentes na corrente sanguínea.
Morfologia
Adulto
Os vermes adultos assemelham-se aos vermes nematóides típicos. Longos e filiformes, B. malayi e outros nematóides possuem apenas músculos longitudinais e se movem em um movimento em forma de S. Os adultos são geralmente menores do que o adulto W. bancrofti , embora poucos adultos tenham sido isolados. Os vermes adultos fêmeas (50 mm) são maiores do que os vermes machos (25 mm).
Microfilariae
As microfilárias de B. malayi têm 200–275 µm de comprimento e têm uma extremidade anterior arredondada e uma extremidade posterior pontiaguda. As microfilárias são embainhadas, o que se mancha fortemente com Giemsa. A bainha é na verdade a casca do ovo, uma camada fina que envolve a casca do ovo enquanto as microfilárias circulam na corrente sanguínea. As microfilárias retêm a bainha até serem digeridas no intestino do mosquito.
As microfilárias de B. malayi se assemelham às microfilárias de W. bancrofti e Loa loa com pequenas diferenças que podem ajudar no diagnóstico laboratorial. As microfilárias de B. malayi podem ser distinguidas pela fileira descontínua de núcleos encontrados na ponta da cauda. Existem dois núcleos terminais que estão distintamente separados dos outros núcleos na cauda, enquanto a cauda de W. bancrofti não contém nenhum núcleo e os núcleos das microfilárias Loa loa formam uma fileira contínua na cauda. As microfilárias de B. malayi também têm uma proporção de espaço cefálico característica de 2: 1.
Espalhar
B. malayi é transmitida por um mosquito vetor. Os principais vetores de mosquitos incluem os mosquitos Mansonia , Anopheles e Aedes . A distribuição geográfica da doença depende, portanto, de um habitat adequado para a reprodução do mosquito.
- A forma periódica noturna é transmitida pela Mansônia e alguns mosquitos anofelinos em pântanos abertos e áreas de cultivo de arroz. Esses mosquitos tendem a picar à noite e parecem infectar apenas humanos. As infecções naturais em animais são raras e os animais experimentais não retêm a infecção.
- A forma noturna subperiódica é transmitida pela Mansônia em pântanos florestais, onde os mosquitos picam na sombra a qualquer momento. As infecções zoonóticas naturais são comuns. Gatos, cães, macacos, lorises lentos, gatos civetas e hamsters foram todos infectados experimentalmente com B. malayi do homem e podem servir como reservatórios importantes.
O acúmulo de muitas picadas de mosquitos infectantes - de várias centenas a milhares - é necessário para estabelecer a infecção. Isso ocorre porque um mosquito competente geralmente transmite apenas algumas larvas L3 infectantes (ver Ciclo de vida ), e menos de 10% dessas larvas passam por todas as etapas de muda necessárias e se desenvolvem em vermes adultos que podem acasalar. Portanto, aqueles com maior risco de infecção são os indivíduos que vivem em áreas endêmicas - turistas de curta duração provavelmente não desenvolverão filariose linfática.
Diagnóstico
Gânglios linfáticos inguinais sensíveis ou aumentados ou inchaço nas extremidades podem alertar os médicos ou funcionários da saúde pública sobre a infecção.
Com equipamento de laboratório apropriado, o exame microscópico das características morfológicas diferenciais das microfilárias em esfregaços de sangue corados pode auxiliar no diagnóstico - em particular o exame da porção da cauda, a presença de uma bainha e o tamanho do espaço cefálico. A coloração de Giemsa tingirá exclusivamente a bainha de B. malayi de rosa. No entanto, encontrar as microfilárias em esfregaços de sangue pode ser difícil devido à periodicidade noturna de algumas formas de B. malayi .
Os ensaios baseados em PCR são altamente sensíveis e podem ser usados para monitorar infecções tanto em humanos quanto em mosquitos vetores. No entanto, os ensaios de PCR são demorados, trabalhosos e requerem equipamento de laboratório. A filariose linfática afeta principalmente os pobres, que vivem em áreas sem esses recursos.
O teste de cartão de antígeno ICT é amplamente utilizado no diagnóstico de W. bancrofti , mas os antígenos comerciais de B. malayi não estão amplamente disponíveis. No entanto, novos desenvolvimentos de pesquisa identificaram um antígeno recombinante (BmR1) que é específico e sensível na detecção de anticorpos IgG4 contra B. malayi e B. timori em um ensaio imunoenzimático e um teste imunocromatográfico rápido (Brugia Rapid) . No entanto, parece que a imunorreatividade a este antígeno é variável em indivíduos infectados com outros nematóides filariais. Essa pesquisa levou ao desenvolvimento de dois novos testes imunocromatográficos rápidos de cassete IgG4 - WB rapid e panLF rapid - que detectam a filariose Bancroftiana e todas as três espécies de filariose linfática, respectivamente, com alta sensibilidade e seletividade.
Prevenção
Vacinas
Atualmente, não há vacina licenciada para prevenir a filariose linfática. No entanto, pesquisas recentes produziram vacinas candidatas com bons resultados em animais de experimentação. A glutationa-S-transferase, uma enzima de desintoxicação em parasitas isolados de Setaria cervi , um parasita filarial bovino, reduziu a carga do parasita adulto de B. malayi em mais de 82% por 90 dias após o tratamento.
Controle de vetores
O controle do vetor tem sido eficaz na eliminação virtual da filariose linfática em algumas regiões, mas o controle do vetor combinado com a quimioterapia produz os melhores resultados. Sugere-se que 11 a 12 anos de controle eficaz do vetor podem eliminar a filariose linfática. Métodos bem-sucedidos de controle do vetor de B. malayi incluem pulverização residencial residual usando DDT e mosquiteiros tratados com inseticida. As larvas de Mansonia prendem seus tubos de respiração às raízes e plantas subaquáticas para sobreviver. Embora os larvicidas químicos tenham fornecido apenas controle parcial, a remoção das plantas pode prevenir o desenvolvimento do vetor, mas também potenciais efeitos adversos no ambiente aquático. O controle do vetor da filariose linfática é negligenciado em comparação com os esforços muito mais estabelecidos para controlar os vetores da malária e da dengue. Métodos integrados de controle de vetores devem ser aplicados em áreas onde a mesma espécie de mosquito é responsável pela transmissão de múltiplos patógenos.
Gestão
A Aliança Global para Eliminar a Filariose Linfática foi lançada pela Organização Mundial da Saúde em 2000 com dois objetivos principais: 1) interromper a transmissão e 2) aliviar o sofrimento dos indivíduos afetados. Os programas de tratamento medicamentoso em massa são a principal estratégia para interromper a transmissão do parasita, e o manejo da morbidade, com foco na higiene, melhora a qualidade de vida dos indivíduos infectados.
Drogas
Um objetivo dos esforços comunitários é eliminar as microfilárias do sangue de indivíduos infectados para prevenir a transmissão ao mosquito. Isso é feito principalmente por meio do uso de drogas. O tratamento da infecção por B. malayi é o mesmo da filariose de Bancroft. A dietilcarbamazina tem sido usada em programas de tratamento em massa como um medicamento microfilaricida eficaz em vários locais, incluindo a Índia. Embora a dietilcarbamazina tenda a causar reações adversas como febre imediata e fraqueza, não se sabe que causa efeitos adversos a longo prazo. Foi demonstrado que ele mata vermes adultos e microfilárias. Na Malásia, as dosagens de dietilcarbamazina (6 mg / kg por semana por 6 semanas; 6 mg / kg por dia por 9 dias) reduziram as microfilárias em 80% por 18 a 24 meses após o tratamento na ausência de controle do mosquito. O número de microfilárias retorna lentamente muitos meses após o tratamento, exigindo, assim, múltiplas doses do medicamento ao longo do tempo para atingir o controle em longo prazo. No entanto, não se sabe quantos anos de administração em massa do medicamento são necessários para eliminar a transmissão. houve casos confirmados de resistência à dietilcarbamazina em 2007.
Foi demonstrado que doses únicas de dois medicamentos (albendazol-dietilcarbamazina e albendazol-ivermectina) removem 99% das microfilárias por um ano após o tratamento e ajudam a melhorar a elefantíase durante os estágios iniciais da doença. A ivermectina não parece matar os vermes adultos, mas atua como um microfilaricida menos tóxico.
Desde a descoberta da importância da bactéria Wolbachia no ciclo de vida de B. malayi e outros nematóides, novos esforços de drogas têm como alvo a endobactéria. Tetraciclinas, rifampicina e cloranfenicol têm sido eficazes in vitro, interferindo na muda de larvas e no desenvolvimento de microfilárias. Foi demonstrado que as tetraciclinas causam anormalidades reprodutivas e de embriogênese em vermes adultos, resultando em sua esterilidade. Os ensaios clínicos demonstraram a redução bem-sucedida de Wolbachia e microfilárias em pacientes infectados com oncocercose e W. bancrofti . Esses antibióticos, embora atuem por uma via um pouco mais indireta, são drogas antifilariais promissoras.
Higiene
A infecção bacteriana secundária é freqüentemente observada com a filariose linfática. Práticas rigorosas de higiene, incluindo lavagem com água e sabão diariamente e desinfecção de feridas podem ajudar a curar superfícies infectadas e retardar e potencialmente reverter o dano ao tecido existente. Promover a higiene é essencial para pacientes com filariose linfática, devido ao comprometimento do sistema imunológico e ao sistema linfático danificado, e pode ajudar a prevenir o sofrimento e a incapacidade.
Epidemiologia
B. malayi infecta 13 milhões de pessoas no sul e sudeste da Ásia e é responsável por quase 10% do total de casos de filariose linfática no mundo. A infecção por B. malayi é endêmica ou potencialmente endêmica em 16 países, onde é mais comum no sul da China e na Índia, mas também ocorre na Indonésia, Tailândia, Vietnã, Malásia, Filipinas e Coréia do Sul. A distribuição de B. malayi se sobrepõe a W. bancrofti nessas regiões, mas não coexiste com B. timori . Os focos regionais de endemicidade são determinados em parte pelos mosquitos vetores
História
Parasita distinto
B. malayi foi descoberta em 1927 pelo parasitologista holandês Steffen Lambert Brug (1879–1946) (que é comumente conhecido na literatura científica como SL Brug) enquanto trabalhava na Indonésia. Era semelhante a outra lombriga filariana Wuchereria bancrofti (então chamada de Filaria (Microfilaria) bancrofti ). Mas a nova espécie de filaria humana no norte de Sumatra era fisiológica e morfologicamente distinta das microfilárias de W. bancrofti comumente encontradas em Jacarta. Com base em suas semelhanças e diferenças, a nova espécie foi batizada de Filaria malayi . Apesar de estudos epidemiológicos identificando Filaria malayi na Índia, Sri Lanka, China, Vietnã do Norte e Malásia na década de 1930, a hipótese de Lichtenstein e Brug não foi aceita até a década de 1940, quando Rao e Mapelstone identificaram dois vermes adultos na Índia.
Com base nas semelhanças com W. bancrofti , Rao e Mapelstone propuseram denominar o parasita Wuchereria malayi. Após a descoberta de novas espécies como W. pahangi (agora B. pahangi ) em 1956, e W. patei (agora B. patei ) em 1958, a classificação científica foi reavaliada em 1960. Buckley propôs dividir o antigo gênero Wuchereria , em dois gêneros, Wuchereria e introduziu um novo Brugia após o descobridor original. Então Wuchereria contém apenas W. bancrofti , que até agora infecta apenas humanos, e o gênero Brugia contém B. malayi , que infecta humanos e animais, bem como outras espécies zoonóticas.
Cepas diferentes
Em 1957, duas subespécies de B. malayi infectadas por humanos foram descobertas por Turner e Edeson na Malásia com base na observação de diferentes padrões de periodicidade da microfilária. A periodicidade se refere a um pico pronunciado na contagem de microfilárias durante um intervalo de 24 horas quando as microfilárias estão presentes e são detectáveis no sangue circulante. A base para esse fenômeno permanece amplamente desconhecida.
- Periodicidade noturna: as microfilárias não são detectáveis no sangue durante a maior parte do dia, mas a densidade da microfilária atinge o pico entre meia-noite e 2h da manhã.
- Subperiodicidade noturna: microfilárias estão presentes no sangue o tempo todo, mas aparecem em maior densidade entre meio-dia e 20h.
Pesquisa
Em 2007, os cientistas sequenciaram o genoma de Brugia malayi . A identificação dos genes desse organismo pode levar ao desenvolvimento de novos medicamentos e vacinas .
Para decifrar o genoma, foi realizado "Whole Genome Shotgun Sequencing". O genoma foi encontrado para ter aproximadamente 90-95 megabases de tamanho. Os resultados do sequenciamento foram então comparados aos do nematóide de referência Caenorhabditis elegans , juntamente com seu protótipo Caenorhabditis briggsae . Esses dois nematóides de vida livre foram incorporados ao estudo e foram importantes por várias razões:
- comparar genomas usando C. elegans permitiu a identificação de ligações semelhantes em genes
- os pesquisadores descobriram uma conservação genômica com ausência de conservação em um nível de gene mais local
- isso demonstrou que rearranjos ocorreram ao longo do tempo entre C. elegans e B. malayi e permitiu aos pesquisadores identificar genes ou proteínas que eram específicos para B. malayi
- esses genes únicos foram significativos porque podem ter levado ao parasitismo visto em B. malayi e, portanto, são alvos potenciais para estudos futuros
- os pesquisadores descobriram uma conservação genômica com ausência de conservação em um nível de gene mais local
- ligações de genes oferecem uma visão sobre a tendência evolutiva de genes parasitas que podem fornecer pistas para explicar melhor sua capacidade única de sobreviver com sucesso por muitos anos em humanos
Novos medicamentos
As comparações de sequência entre os dois genomas permitem o mapeamento de ortólogos de C. elegans para genes de B. malayi . Usando mapeamentos de ortologia (entre C. elegans e B.malayi ) e incorporando os extensos dados genômicos e genômicos funcionais, incluindo telas de RNAi em todo o genoma que já existem para C. elegans , genes potencialmente essenciais em B. malayi podem ser identificados. Os cientistas esperam ser capazes de direcionar esses genes como novos alvos potenciais para tratamentos com medicamentos. A longevidade desse parasita complica o tratamento porque a maioria dos medicamentos existentes tem como alvo as larvas e, portanto, não matam os vermes adultos. Os medicamentos geralmente devem ser tomados periodicamente durante anos, e os vermes podem causar uma reação imunológica massiva quando morrem e liberam moléculas estranhas no corpo. Os tratamentos medicamentosos para a filariose não mudaram significativamente em mais de 20 anos e, com o aumento do risco de resistência, há uma necessidade urgente de desenvolvimento de novas terapias com medicamentos anti-filariais. A partir da sequência do genoma, várias vias metabólicas foram identificadas, contendo dezenas de produtos gênicos que podem ser úteis na descoberta de terapias medicamentosas mais direcionadas e eficazes.
- possíveis novos alvos de drogas incluem:
- muda
- receptores nucleares
- colágenos e processamento de colágeno
- sinalização neuronal
- o B. malayi kinome
- dependência do metabolismo do hospedeiro ( B. malayi ) e endossimbionte ( Wolbachia )
Esses novos alvos potenciais para medicamentos ou vacinas podem fornecer novas oportunidades para a compreensão, tratamento e prevenção da elefantíase.
Relacionamento com Wolbachia
A relação entre a bactéria Wolbachia e B. malayi não é totalmente compreendida. Extrapolando a pesquisa feita com Wuchereria bancrofti , outro nematóide que causa a filariose, a Wolbachia pode auxiliar na embriogênese do verme, ser responsável por respostas inflamatórias potentes de macrófagos e doença filarial, e estar ligada ao aparecimento de lifedema e cegueira, às vezes associada a B. infecções malayi . Em um estudo feito pela Universidade de Bonn em Gana, a doxiciclina efetivamente esgotou a Wolbachia de W. bancrofti . É provável que o mecanismo da doxiciclina seja semelhante ao de outras espécies filariais, ou seja, um bloqueio predominante da embriogênese, levando a um declínio das microfilárias de acordo com sua meia-vida. Isso poderia tornar o tratamento com doxiciclina uma ferramenta adicional para o tratamento de doenças associadas à microfilária na filariose de Bancroftiana, juntamente com B. malayi fiariasis. O curso do tratamento com doxiciclina poderia ser muito mais curto, pois tornaria o verme adulto estéril em uma injeção, em vez de ter de visar repetidamente as larvas reabastecidas que os tratamentos atuais matam, e haveria menos efeitos colaterais para o indivíduo infectado.
Pesquisa de transplante
Outro uso promissor para a pesquisa é na área de pesquisa de transplantes. Como o genoma de B. malayi é o primeiro genoma parasitário a ser sequenciado, as implicações sobre o mecanismo de parasitismo em humanos são cruciais para entender. De acordo com Alan L. Scott, Ph.D., um colaborador da Universidade Johns Hopkins, compreender como um parasita específico, como B. malayi , pode se adaptar aos humanos, pode render benefícios médicos muito além do tratamento da elefantíase. De acordo com o autor, “Esse verme pode residir no hospedeiro por anos e não necessariamente causar doenças; na verdade, quanto menos doenças o indivíduo tem, mais vermes existem em circulação. Agora que sabemos que esses genes não existem em humanos podemos direcioná-los para controlar doenças. " Algumas das proteínas previstas para esses novos genes parecem semelhantes às proteínas imunomoduladoras conhecidas, reguladoras do sistema imunológico, sugerindo que estão envolvidas na desativação do sistema imunológico do hospedeiro para garantir que o parasita não seja detectado. O conhecimento desses imunossupressores até então desconhecidos também pode ser útil em transplantes de órgãos e para ajudar a tratar doenças autoimunes.
De acordo com o Projeto Genoma Filarial realizado pelo Programa Especial para Pesquisa e Treinamento em Doenças Tropicais, o gene MIF de Brugia malayi é expresso em todos os estágios do ciclo de vida do parasita, e os resultados sugerem que o MIF de B. malayi pode interagir com o humano sistema imunológico durante o curso da infecção, alterando a função dos macrófagos no indivíduo infectado. Atualmente, os estudos estão testando a hipótese de que o MIF pode estar envolvido na redução da resposta imune do hospedeiro às microfilárias. Entender como esse parasita em particular se adaptou aos humanos pode ajudar os pesquisadores de transplante de órgãos, descobrindo como evitar que o sistema imunológico ataque o tecido transplantado.
Veja também
Referências
- O artigo é baseado no domínio público (site do governo dos EUA), fonte US Dept. of Health and Human Services / Center for Disease Control: Filariosis
links externos
| Classificação |
|---|
- Brugia_life_cycle_and_adults_in_lymphatics vídeo de R. Rao
- Brugia malayi em UMich
- O Programa Especial de Pesquisa e Treinamento em Doenças Tropicais (TDR). "Análise funcional dos genes de Brugia malayi". 2004
- Universidade de Pittsburgh. "Pesquisadores revelam segredos genéticos de um parasita humano devastador". 20 de setembro de 2007.
- Hoerauf, Achim. "Visando a wolbachia, a doxiciclina reduz a patologia da filariose linfática". 18, setembro de 2006.
- Programa Global da Organização Mundial da Saúde para Eliminar a Filariose Linfática
- A Aliança Global para Eliminar a Filariose Linfática
- Gideon Infectious Diseases Online
- Biblioteca de imagens de parasitas, centros de controle de doenças
