Batracotoxina -Batrachotoxin
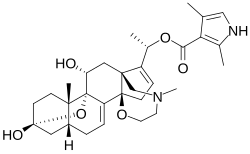
Fórmula esquelética de batracotoxina
|
|
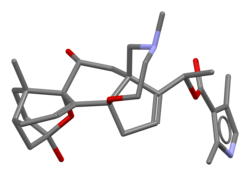
Modelo bastão de batracotoxina baseado na estrutura cristalina da batracotoxina A O - p -bromobenzoato
|
|

Modelo de bola e bastão de batracotoxina, como acima
|
|
| nomes | |
|---|---|
| Outros nomes
3α,9α-epoxi-14β,18-(2′-oxietil- N -metilamino)-5β-pregna-7,16-dieno-3β,11α,20α-triol 20α-2,4-dimetilpirrol-3-carboxilato
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 31 H 42 N 2 O 6 | |
| Massa molar | 538,685 g·mol −1 |
| Densidade | 1,304 g/mL |
| Perigos | |
| Segurança e saúde ocupacional (SSO/SST): | |
|
Principais perigos
|
Altamente tóxico |
| Dose letal ou concentração (LD, LC): | |
|
LD 50 ( dose mediana )
|
2 μg/kg (camundongo, subcutâneo) |
|
Exceto quando indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 °C [77 °F], 100 kPa).
|
|
A batracotoxina ( BTX ) é um alcaloide esteróide cardio e neurotóxico extremamente potente encontrado em certas espécies de besouros, pássaros e sapos. O nome vem da palavra grega βάτραχος , bátrachos , 'sapo'. Compostos químicos estruturalmente relacionados são muitas vezes referidos coletivamente como batracotoxinas. É um alcaloide extremamente venenoso. Em certas rãs, este alcaloide está presente principalmente na pele. Essas rãs estão entre as usadas para dardos envenenados . A batracotoxina liga-se e abre irreversivelmente os canais de sódio das células nervosas , impedindo-os de fechar, resultando em paralisia e morte. Nenhum antídoto é conhecido.
História
A batracotoxina foi descoberta por Fritz Märki e Bernhard Witkop , no National Institute of Arthritis and Metabolic Diseases, National Institutes of Health, Bethesda, Maryland , EUA Märki e Witkop separaram a potente fração de alcaloides tóxicos do Phyllobates bicolor e determinaram suas propriedades químicas em 1963. Eles isolaram quatro principais alcaloides esteróides tóxicos, incluindo batracotoxina, isobatracotoxina, pseudobatracotoxina e batracotoxina A. Devido à dificuldade de manusear uma toxina tão potente e à quantidade minúscula que poderia ser coletada, uma determinação abrangente da estrutura envolveu várias dificuldades . No entanto, Takashi Tokuyama, que se juntou à investigação mais tarde, converteu um dos compostos congêneres , a batracotoxina A, em um derivado cristalino e sua estrutura esteróide única foi resolvida com técnicas de difração de raios-x (1968). Quando o espectro de massa e o espectro de NMR da batracotoxina e dos derivados da batracotoxina A foram comparados, percebeu-se que os dois compartilhavam a mesma estrutura esteroidal e que a batracotoxina era a batracotoxina A com uma única porção extra de pirrol ligada . De fato, a batracotoxina foi parcialmente hidrolisada usando hidróxido de sódio em um material com TLC e reações de cor idênticas às da batracotoxina A. A estrutura da batracotoxina foi estabelecida em 1969 por meio da recombinação química de ambos os fragmentos. A batracotoxina A foi sintetizada por Michio Kurosu, Lawrence R. Marcin, Timothy J. Grinsteiner e Yoshito Kishi em 1998.
Toxicidade
De acordo com experimentos com roedores , a batracotoxina é um dos alcaloides mais potentes conhecidos: seu LD 50 intravenoso em camundongos é de 2 a 3 µg/kg. Enquanto isso, seu derivado, a batracotoxina A, tem uma toxicidade muito menor com um LD 50 de 1000 µg/kg.
A toxina é liberada por meio de secreções incolores ou leitosas de glândulas localizadas no dorso e atrás das orelhas de rãs do gênero Phyllobates . Quando um desses sapos está agitado, se sente ameaçado ou com dor, a toxina é liberada reflexivamente por vários canais.
A atividade da batracotoxina depende da temperatura, com atividade máxima a 37 °C (99 °F). Sua atividade também é mais rápida em pH alcalino , o que sugere que a forma não protonada pode ser mais ativa.
Neurotoxicidade
Como uma neurotoxina , afeta o sistema nervoso . A função neurológica depende da despolarização das fibras nervosas e musculares devido ao aumento da permeabilidade ao íon sódio da membrana celular excitável . As toxinas lipossolúveis, como a batracotoxina, atuam diretamente nos canais de íons de sódio envolvidos na geração do potencial de ação e modificando sua seletividade iônica e sensibilidade à voltagem. A batracotoxina liga-se irreversivelmente aos canais de Na + o que causa uma alteração conformacional nos canais que obriga os canais de sódio a permanecerem abertos. A batracotoxina não apenas mantém os canais de sódio dependentes de voltagem abertos, mas também reduz a condutância de canal único. Em outras palavras, a toxina se liga ao canal de sódio e mantém a membrana permeável aos íons de sódio de maneira "tudo ou nada".
Isso tem um efeito direto no sistema nervoso periférico (SNP). A batracotoxina no SNP produz aumento da permeabilidade (seletiva e irreversível) da membrana celular em repouso aos íons sódio, sem alterar a concentração de potássio ou cálcio . Esse influxo de sódio despolariza a membrana celular anteriormente polarizada. A batracotoxina também altera a seletividade iônica do canal iônico, aumentando a permeabilidade do canal para cátions maiores. Os canais de sódio sensíveis à voltagem tornam-se persistentemente ativos no potencial de repouso da membrana. A batracotoxina mata bloqueando permanentemente a transmissão do sinal nervoso para os músculos.
A batracotoxina liga-se e abre irreversivelmente os canais de sódio das células nervosas, impedindo-os de fechar. O neurônio não pode mais enviar sinais e isso resulta em paralisia. Além disso, o influxo maciço de íons sódio produz alterações osmóticas em nervos e músculos, o que causa alterações estruturais. Foi sugerido que também pode haver um efeito no sistema nervoso central , embora atualmente não se saiba qual pode ser esse efeito.
Cardiotoxicidade
Embora geralmente classificada como uma neurotoxina , a batracotoxina tem efeitos marcantes nos músculos cardíacos e seus efeitos são mediados pela ativação do canal de sódio. A condução cardíaca é prejudicada, resultando em arritmias , extrassístoles , fibrilação ventricular e outras alterações que levam à assistolia e parada cardíaca . A batracotoxina induz uma liberação maciça de acetilcolina nos nervos e músculos e também a destruição das vesículas sinápticas . A batracotoxina R é mais tóxica do que a batracotoxina A relacionada.
Tratamento
Atualmente, não existe nenhum antídoto eficaz para o tratamento da intoxicação por batracotoxina. Veratridina , aconitina e grayanotoxina - como a batracotoxina - são venenos lipossolúveis que alteram de forma semelhante a seletividade iônica dos canais de sódio, sugerindo um local de ação comum. Devido a essas semelhanças, o tratamento para envenenamento por batracotoxina pode ser melhor modelado ou baseado em tratamentos para um desses venenos. O tratamento também pode ser modelado após aquele para digitálicos , que produz efeitos cardiotóxicos um tanto semelhantes.
Embora não seja um antídoto, a despolarização da membrana pode ser evitada ou revertida pela tetrodotoxina (do baiacu ), que é um inibidor não competitivo , ou pela saxitoxina (" maré vermelha "). Ambos têm efeitos antagônicos aos da batracotoxina sobre o fluxo de sódio. Certos anestésicos podem atuar como receptores antagonistas da ação desse veneno alcaloide, enquanto outros anestésicos locais bloqueiam completamente sua ação agindo como antagonistas competitivos .
Fontes
A batracotoxina foi encontrada em quatro espécies de besouros da Papua, todas do gênero Choresine na família Melyridae ; C. pulchra , C. semiopaca , C. rugiceps e C. sp. A. _
Várias espécies de aves endêmicas da Nova Guiné têm a toxina em sua pele e em suas penas: o ifrit de cabeça azul ( Ifrita kowaldi ), o pequeno picanço (também conhecido como picanço ruivo, Colluricincla megarhyncha ) e as seguintes espécies de pitohui : o encapuzado o pitohui ( Pitohui dichrous , o mais tóxico dos pássaros), o pitohui com crista ( Ornorectes cristatus ), o pitohui preto ( Melanorectes nigrescens ), o pitohui enferrujado ( Pseudorectes ferrugineus ) e o pitohui variável, que agora está dividido em três espécies: a variável do norte pitohui ( Pitohui kirhocephalus ), Raja Ampat pitohui ( P. cerviniventris ) e pitohui variável do sul ( P. uropygialis ).
Embora o propósito da toxicidade nessas aves não seja certo, a presença de batracotoxinas nessas espécies é um exemplo de evolução convergente . Acredita-se que essas aves obtêm a toxina de insetos contendo batracotoxina que comem e depois a secretam através da pele.
A batracotoxina também foi encontrada em todas as espécies descritas do gênero de sapo venenoso Phyllobates da Nicarágua à Colômbia , incluindo o sapo venenoso dourado ( Phylobates terribilis ), sapo venenoso de pernas pretas ( P. bicolor ), adorável sapo venenoso ( P. lugubris ) , sapo venenoso Golfodulceano ( P. vittatus ) e sapo venenoso Kokoe ( P. aurotaenia ). O sapo venenoso Kokoe costumava incluir P. sp. aff. aurotaenia , agora reconhecida como distinta. Todas as seis espécies de sapos estão na família dos sapos venenosos .
As próprias rãs não produzem batracotoxina. Assim como nas aves, acredita-se que essas rãs obtêm a toxina de insetos contendo batracotoxina que comem e depois a secretam através da pele. Besouros do gênero Choresine não são encontrados na Colômbia, mas acredita-se que as rãs possam obter a toxina de besouros de outros gêneros da mesma família ( Melyridae ), vários dos quais são encontrados na Colômbia.
Rãs criadas em cativeiro não produzem batracotoxina e, portanto, podem ser manuseadas sem risco. No entanto, isso limita a quantidade de batracotoxina disponível para pesquisa, pois 10.000 sapos produziram apenas 180 mg de batracotoxina. Como essas rãs estão ameaçadas de extinção, sua colheita é antiética . Os estudos biossintéticos também são desafiados pela baixa taxa de síntese da batracotoxina.
O habitat nativo dos sapos venenosos são as regiões quentes da América Central e do Sul , nas quais a umidade é de cerca de 80%.
Usar
O uso mais comum dessa toxina é pelos Noanamá Chocó e Emberá Chocó dos Embera-Wounaan do oeste da Colômbia para envenenar dardos de zarabatana para uso na caça.
Os dardos venenosos são preparados pelos Chocó primeiro empalando um sapo em um pedaço de madeira. Segundo alguns relatos, o sapo é então segurado ou assado vivo no fogo até chorar de dor. Bolhas de veneno se formam quando a pele do sapo começa a formar bolhas. As pontas do dardo são preparadas tocando-as na toxina, ou a toxina pode ser apanhada em um recipiente e fermentada. Dardos venenosos feitos de batracotoxina fresca ou fermentada são suficientes para derrubar macacos e pássaros em seus rastros. A paralisia nervosa é quase instantânea. Outros relatos dizem que um bastão siurukida ("dente de bambu") é colocado na boca do sapo e sai por uma de suas patas traseiras. Isso faz com que o sapo transpire profusamente nas costas, que ficam cobertas por uma espuma branca. Os dardos são mergulhados ou enrolados na espuma, preservando seu poder letal por até um ano.
Veja também
- Tetrodotoxina , uma toxina que funciona de maneira oposta à batracotoxina
Citações
Referências gerais e citadas
- Daly, JW; Witkop, B. (1971). "Química e farmacologia de venenos de rãs" . Em Bücherl, W.; Buckley, EE; Deulofeu, V. (eds.). Animais Peçonhentos e Seus Venenos . Vol. 2. Nova York: Academic Press. LCCN 66014892 . OCLC 299757 .
