Tioester - Thioester
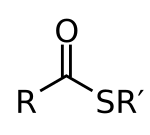
Em química, os tioésteres são compostos com o grupo funcional R – S – CO – R '. Eles são análogos aos ésteres de carboxilato, com o enxofre no tioéster desempenhando o papel de ligação do oxigênio no éster de carboxilato. Eles são o produto da esterificação entre um ácido carboxílico e um tiol . Em bioquímica , os tioésteres mais conhecidos são derivados da coenzima A , por exemplo, acetil-CoA .
Síntese
A rota mais típica para o tioéster envolve a reação de um cloreto de ácido com um sal de metal alcalino de um tiol:
- RSNa + R′COCl → R′COSR + NaCl
Outra rota comum envolve o deslocamento de haletos pelo sal de metal alcalino de um ácido tiocarboxílico . Por exemplo, ésteres de tioacetato são comumente preparados por alquilação de tioacetato de potássio :
- CH 3 COSK + RX → CH 3 COSR + KX
A alquilação análoga de um sal de acetato raramente é praticada. A alquilação pode ser conduzida usando bases de Mannich e o ácido tiocarboxílico:
- CH 3 COSH + R ′ 2 NCH 2 OH → CH 3 COSCH 2 NR ′ 2 + H 2 O
Os tioésteres podem ser preparados por condensação de tióis e ácidos carboxílicos na presença de agentes desidratantes:
- RSH + R′CO 2 H → RSC (O) R ′ + H 2 O
Um agente de desidratação típico é o DCC . Esforços para melhorar a sustentabilidade da síntese de tioéster também foram relatados utilizando o reagente de acoplamento T3P mais seguro e o solvente mais verde ciclopentanona . Os anidridos ácidos e algumas lactonas também fornecem tioésteres após tratamento com tióis na presença de uma base.
Os tioésteres podem ser convenientemente preparados a partir de álcoois pela reação de Mitsunobu , usando ácido tioacético .
Eles também surgem por meio da carbonilação de alcinos e alcenos na presença de tióis.
Reações
Os tioésteres hidrolisam em tióis e no ácido carboxílico:
- RC (O) SR '+ H 2 O → RCO 2 H + RSH
O centro de carbonil em tioésteres é mais reativo para nucleófilos de amina para dar amidas :
Em uma reação relacionada, mas usando um metal macio para capturar o tiolato, os tioésteres são convertidos em ésteres. Os tioésteres fornecem quimiosseletividade útil na síntese de biomoléculas.
Uma reação única dos tioésteres é o acoplamento de Fukuyama , no qual o tioéster é acoplado a um haleto de organozinco por um catalisador de paládio para dar uma cetona.

Bioquímica

Os tioésteres são intermediários comuns em muitas reações biossintéticas, incluindo a formação e degradação de ácidos graxos e mevalonato , precursor dos esteróides. Os exemplos incluem malonil-CoA , acetoacetil-CoA , propionil-CoA , cinamoil-CoA e tioésteres de proteína transportadora de acila (ACP). A acetogênese prossegue através da formação de acetil-CoA . A biossíntese de lignina , que compreende uma grande fração da biomassa terrestre da Terra, prossegue por meio de um derivado tioéster do ácido caféico . Esses tioésteres surgem de forma análoga aos preparados sinteticamente, com a diferença de que o agente de desidratação é o ATP. Além disso, os tioésteres desempenham um papel importante na marcação de proteínas com ubiquitina , que marca a proteína para degradação.
A oxidação do átomo de enxofre em tioésteres (tiolactonas) é postulada na bioativação dos pró-fármacos antitrombóticos ticlopidina, clopidogrel e prasugrel.
Tioésteres e a origem da vida
Conforme postulado em um "Mundo Tioéster", os tioésteres são possíveis precursores da vida. Como Christian de Duve explica:
É revelador que os tioésteres são intermediários obrigatórios em vários processos-chave nos quais o ATP é usado ou regenerado. Os tioésteres estão envolvidos na síntese de todos os ésteres , incluindo aqueles encontrados em lipídios complexos . Eles também participam da síntese de vários outros componentes celulares, incluindo peptídeos , ácidos graxos , esteróis , terpenos , porfirinas e outros. Além disso, os tioésteres são formados como intermediários-chave em vários processos particularmente antigos que resultam na formação de ATP. Em ambos os casos, o tioéster está mais próximo do que o ATP do processo que usa ou produz energia. Em outras palavras, os tioésteres poderiam realmente ter desempenhado o papel de ATP em um "mundo tioéster" inicialmente desprovido de ATP. Eventualmente, [esses] tioésteres poderiam ter servido para inaugurar o ATP por meio de sua capacidade de apoiar a formação de ligações entre os grupos fosfato .
No entanto, devido à alta mudança de energia livre da hidrólise do tioéster e, correspondentemente, às suas constantes de equilíbrio baixas, é improvável que esses compostos possam ter se acumulado abioticamente em qualquer extensão significativa, especialmente em condições de ventilação hidrotérmica.
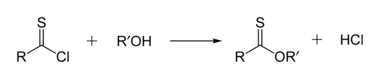
Thionoésteres

Os tionoésteres são isoméricos com os tioésteres. Em um tionoéster, o enxofre substitui o oxigênio carbonil em um éster. Metil thionobenzoate é C 6 H 5 C (S) OCH 3 . Esses compostos são tipicamente preparados pela reação do cloreto de tioacila com um álcool.
Eles também podem ser feitos pela reação do reagente de Lawesson com ésteres ou pelo tratamento de sais de pinner com sulfeto de hidrogênio. Alternativamente, vários tionoésteres podem ser preparados através da transesterificação de um metil tionoéster existente com um álcool sob condições catalisadas por base.