Resposta SOS - SOS response

A resposta SOS é uma resposta global ao dano ao DNA em que o ciclo celular é interrompido e o reparo do DNA e a mutagênese são induzidos. O sistema envolve a proteína RecA (Rad51 em eucariotos). A proteína RecA, estimulada por DNA de fita simples, está envolvida na inativação do repressor ( LexA ) dos genes de resposta SOS, induzindo assim a resposta. É um sistema de reparo sujeito a erros que contribui significativamente para as mudanças no DNA observadas em uma ampla gama de espécies.
Descoberta
A resposta SOS foi descoberta e nomeada por Miroslav Radman em 1975.
Mecanismo
Durante o crescimento normal, os genes SOS são regulados negativamente pelos dímeros da proteína repressora LexA . Em condições normais, o LexA se liga a uma sequência de consenso de 20 bp (a caixa SOS ) na região do operador para esses genes. Alguns desses genes SOS são expressos em certos níveis, mesmo no estado reprimido, de acordo com a afinidade de LexA por sua caixa SOS. A ativação dos genes SOS ocorre após dano ao DNA pelo acúmulo de regiões de fita simples (ssDNA) geradas em bifurcações de replicação, onde a DNA polimerase é bloqueada. RecA forma um filamento em torno dessas regiões de ssDNA de um modo dependente de ATP e torna-se ativado. A forma ativada de RecA interage com o repressor LexA para facilitar a autoclivagem do repressor LexA do operador.
Uma vez que o pool de LexA diminui, a repressão dos genes SOS diminui de acordo com o nível de afinidade de LexA para as caixas SOS. Os operadores que ligam o LexA fracamente são os primeiros a serem totalmente expressos. Desta forma, o LexA pode ativar sequencialmente diferentes mecanismos de reparo. Genes com uma caixa SOS fraca (como lexA , recA , uvrA , uvrB e uvrD ) são totalmente induzidos em resposta mesmo a tratamentos indutores de SOS fracos. Assim, o primeiro mecanismo de reparo SOS a ser induzido é o reparo por excisão de nucleotídeos (NER), cujo objetivo é consertar o dano ao DNA sem o compromisso de uma resposta SOS completa. Se, no entanto, o NER não for suficiente para consertar o dano, a concentração de LexA é ainda mais reduzida, de modo que a expressão de genes com caixas LexA mais fortes (como sulA , umuD , umuC - estes são expressos tardiamente) é induzida. SulA interrompe a divisão celular ligando-se a FtsZ , a proteína iniciadora neste processo. Isso causa a filamentação e a indução de reparo mutagênico dependente de UmuDC. Como resultado dessas propriedades, alguns genes podem ser parcialmente induzidos em resposta até mesmo a níveis endógenos de dano ao DNA, enquanto outros genes parecem ser induzidos apenas quando um dano alto ou persistente ao DNA está presente na célula.
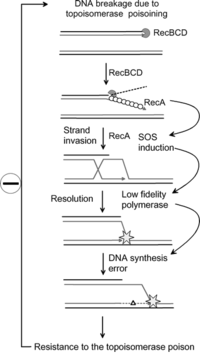
Resistência a antibióticos
Pesquisas recentes mostraram que a via SOS pode ser essencial na aquisição de mutações bacterianas que levam à resistência a alguns antibióticos. O aumento da taxa de mutação durante a resposta SOS é causado por três baixa fidelidade polimerases de ADN : Pol II , Pol IV e Pol V . Os pesquisadores agora estão direcionando essas proteínas com o objetivo de criar drogas que impedem o reparo do SOS. Ao fazer isso, o tempo necessário para que as bactérias patogênicas desenvolvam resistência aos antibióticos pode ser estendido, melhorando assim a viabilidade a longo prazo de alguns antibióticos.
Teste de genotoxicidade
Em Escherichia coli , diferentes classes de agentes de dano ao DNA podem iniciar a resposta SOS, conforme descrito acima. Tirando vantagem de uma fusão de operon que coloca o operon lac (responsável pela produção de beta-galactosidase, uma proteína que degrada a lactose) sob o controle de uma proteína relacionada ao SOS, um ensaio colorimétrico simples para genotoxicidade é possível. Um análogo da lactose é adicionado à bactéria, que é então degradada pela beta-galactosidase, produzindo assim um composto colorido que pode ser medido quantitativamente por espectrofotometria . O grau de desenvolvimento da cor é uma medida indireta da beta-galactosidase produzida, que por sua vez está diretamente relacionada à quantidade de dano ao DNA.
A E. coli é ainda modificada a fim de ter uma série de mutações, incluindo uma mutação uvrA que torna a cepa deficiente no reparo por excisão, aumentando a resposta a certos agentes que danificam o DNA, bem como uma mutação rfa, que torna a bactéria um lipopolissacarídeo -deficiente, permitindo uma melhor difusão de certos produtos químicos na célula, a fim de induzir a resposta SOS. Kits comerciais que medem a resposta primária da célula de E. coli ao dano genético estão disponíveis e podem ser altamente correlacionados com o Teste de Ames para certos materiais.
Outras imagens
A resposta SOS inibe a formação do septo até que o DNA bacteriano possa ser reparado e é observável como filamentação quando as células são examinadas por microscopia (canto superior direito da imagem).


