Fosfoglucomutase - Phosphoglucomutase
| Fosfoglucomutase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Fosfoglucomutase de músculo de coelho, extraída de PDB : 1JDY
| |||||||||
| Identificadores | |||||||||
| EC nº | 5.4.2.2 | ||||||||
| CAS no. | 9001-81-4 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
A fosfoglucomutase ( EC 5.4.2.2 ) é uma enzima que transfere um grupo fosfato em um monômero α-D- glicose da posição 1 para a 6 na direção direta ou da posição 6 para a 1 na direção reversa.
Mais precisamente, facilita a interconversão de glicose 1-fosfato e glicose 6-fosfato .
Função Biológica
Papel na glicogenólise
Depois que o glicogênio fosforilase catalisa a clivagem fosforolítica de um resíduo de glicosil do polímero de glicogênio , a glicose liberada tem um grupo fosfato em seu carbono 1. Esta molécula de glicose 1-fosfato não é ela própria um intermediário metabólico útil, mas a fosfoglucomutase catalisa a conversão dessa glicose 1-fosfato em glicose 6-fosfato (veja abaixo o mecanismo dessa reação).
O destino metabólico da glicose 6-fosfato depende das necessidades da célula no momento em que é gerada. Se a célula estiver com pouca energia, então a glicose 6-fosfato viajará pela via glicolítica , eventualmente produzindo duas moléculas de trifosfato de adenosina . Se a célula necessita de intermediários biossintéticos, a glicose 6-fosfato entrará na via da pentose fosfato , onde passará por uma série de reações para produzir riboses e / ou NADPH , dependendo das condições celulares.
Se a glicogenólise estiver ocorrendo no fígado, a glicose 6-fosfato pode ser convertida em glicose pela enzima glicose 6-fosfatase ; a glicose produzida no fígado é então liberada para a corrente sanguínea para uso em outros órgãos. As células musculares, ao contrário, não possuem a enzima glicose 6-fosfatase, portanto, não podem compartilhar seus estoques de glicogênio com o resto do corpo.
Papel na glicogênese
A fosfoglucomutase também atua de maneira oposta quando os níveis de glicose no sangue estão altos. Nesse caso, a fosfoglucomutase catalisa a conversão da glicose 6-fosfato (que é facilmente gerada a partir da glicose pela ação da hexoquinase ) em glicose 1-fosfato.
Este glicose-1-fosfato pode então reagir com UTP para produzir UDP-glicose em uma reação catalisada por UDP-glicose-pirofosforilase . Se ativada pela insulina , a glicogênio sintase continuará a cortar a glicose do complexo UDP-glicose em um polímero de glicogênio.
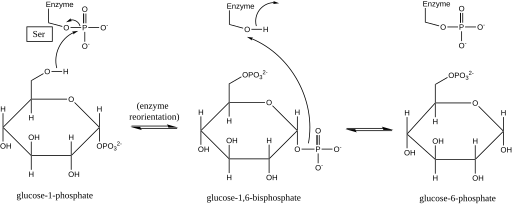
Mecanismo de reação
A fosfoglucomutase afeta a mudança do grupo fosforil ao trocar um grupo fosforil pelo substrato . Experimentos de marcação isotópica confirmaram que esta reação prossegue através de um intermediário de glicose 1,6-bifosfato .
O primeiro passo na reação direta é a transferência de um grupo fosforil da enzima para a glicose 1-fosfato, formando a glicose 1,6-bifosfato e deixando uma forma desfosforilada da enzima. A enzima então sofre uma rápida reorientação difusional para posicionar o 1-fosfato do intermediário de bifosfato adequadamente em relação à enzima desfosforilada. Relações de velocidade de substrato e testes de transporte induzido revelaram que a enzima desfosforilada facilita a transferência de um grupo fosforil do intermediário glicose-1,6-bifosfato para a enzima, regenerando a fosfoglucomutase fosforilada e produzindo glicose 6-fosfato (na direção direta ) Estudos estruturais posteriores confirmaram que o único local da enzima que se torna fosforilado e desfosforilado é o oxigênio do resíduo de serina do local ativo (ver diagrama abaixo). Um íon metálico bivalente , geralmente magnésio ou cádmio , é necessário para a atividade enzimática e demonstrou complexar diretamente com o grupo fosforil esterificado no sítio ativo serina.
Esta formação de um intermediário de glicose 1,6-bifosfato é análoga à interconversão de 2-fosfoglicerato e 3-fosfoglicerato catalisada pela fosfoglicerato mutase , na qual o 2,3-bisfosfoglicerato é gerado como um intermediário.
Estrutura
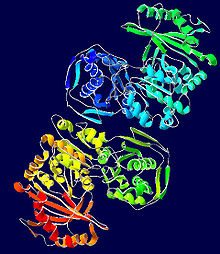
Embora a fosfoglucomutase de músculo de coelho tenha servido como protótipo para grande parte da elucidação da estrutura dessa enzima, as estruturas de cristal derivadas de bactérias mais novas exibem muitas das mesmas características definidoras. Cada monômero de fosfoglucomutase pode ser dividido em quatro domínios de sequência, I-IV, com base na configuração espacial padrão da enzima (veja a imagem à direita).
Cada monômero compreende quatro unidades estruturais α / β distintas, cada uma das quais contém uma das quatro fitas em cada folha β do monômero e é composta apenas pelos resíduos em um determinado domínio de sequência (ver imagem à direita). O enterro do sítio ativo (incluindo Ser-116, o resíduo crítico na enzima que é fosforilado e desfosforilado) no interior hidrofóbico da enzima serve para excluir a água da hidrólise contraprodutiva das ligações fosfoéster críticas, embora ainda permita que o substrato acesse o local.
Relevância da doença
O músculo humano contém duas fosfoglucomutases com propriedades catalíticas quase idênticas, PGM I e PGM II. Uma ou outra dessas formas está ausente em alguns humanos de forma congênita.
A deficiência de PGM é uma condição extremamente rara que não apresenta um conjunto de sintomas fisiológicos bem caracterizados. Esta condição pode ser detectada por um estudo in vitro de glicólise anaeróbica que revela um bloqueio no caminho para a produção de ácido lático após a glicose 1-fosfato, mas antes da glicose 6-fosfato.
A deficiência de PGM1 é conhecida como síndrome CDG tipo 1t (CDG1T, anteriormente conhecida como doença de armazenamento de glicogênio tipo 14 (GSD XIV).
Genes
Veja também
Referências
links externos
- Fosfoglucomutase na Biblioteca Nacional de Medicina dos Estados Unidos. Cabeçalhos de Assuntos Médicos (MeSH)