Quimioterapia intraperitoneal hipertérmica - Hyperthermic intraperitoneal chemotherapy
| Quimioterapia intraperitoneal hipertérmica | |
|---|---|
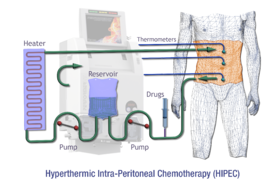 Visão geral esquemática de HIPEC
| |
| Outros nomes | Quimioterapia intraperitoneal hipertérmica (HIPEC), quimoperfusão hipertérmica intra-abdominal, perfusão peritoneal quimio-hipertérmica (CHPP) intraoperatória ou a técnica Sugarbaker |
| Especialidade | Oncologia Cirúrgica |
Quimoperfusão hipertérmica intraperitoneal ( HIPEC ou IPHC ) é um tipo de terapia de hipertermia usada em combinação com cirurgia no tratamento de cânceres abdominais avançados. Neste procedimento, medicamentos anticâncer aquecidos são infundidos e circulados na cavidade peritoneal (abdômen) por um curto período de tempo. Os agentes quimioterápicos geralmente infundidos durante a IPHC são mitomicina-C e cisplatina .
Usos médicos
O IPHC é geralmente usado após a remoção cirúrgica do máximo possível de câncer ( redução de volume ), o que pode incluir a remoção de todas as áreas peritoneais envolvidas . A evidência apóia um benefício em certos casos de câncer de ovário .
A evidência é insuficiente em 2020 para apoiar seu uso em carcinoma epitelial primário avançado de ovário, trompa de Falópio ou carcinoma peritoneal primário, câncer de ovário recorrente, carcinomatose colorretal peritoneal, carcinomatose peritoneal gástrica, mesotelioma peritoneal maligno ou neoplasia mucinosa disseminada do apêndice .
Esses procedimentos podem durar de 8 a 10 horas e acarretam uma taxa significativa de complicações.
A contraparte torácica da HIPEC é a quimioterapia intratorácica hipertérmica (HITOC).
Agentes quimioterápicos
Vários quimioterápicos são usados e não há um consenso claro sobre quais drogas devem ser usadas. A mitomicina C e a oxaliplatina são os agentes mais comumente usados para o câncer colorretal, enquanto a cisplatina é usada no câncer de ovário.
História
Em 1934, Joe Vincent Meigs, em Nova York, descreveu originalmente a cirurgia de redução de volume (cirurgia citorredutiva) para câncer de ovário sob a premissa de redução da doença macroscópica. Nas décadas de 60 e 70, essa abordagem citorredutiva agressiva começou a ser aceita. Durante esse tempo, o Dr. Kent Griffith do National Cancer Institute também relatou indicadores de prognóstico de sobrevida em pacientes com câncer de ovário nos estágios II e III, notando de maneira importante que o tamanho da massa tumoral residual (<1,6 cm) após a cirurgia citorredutora foi significativamente associado à sobrevida estendida . Durante esse tempo, a pesquisa começou a mostrar que a hipertermia, assim como a quimioterapia intraperitoneal, era eficaz em matar as células cancerosas. Spratt et al. na década de 1980, na Universidade de Louisville, em Kentucky, combinou esses conceitos em um sistema de infiltração de transfusão térmica (TIFS) para aplicação de quimioterapia aquecida no espaço peritoneal de caninos. O primeiro humano foi submetido a TIFS com administração de quimioterapia hipertérmica para malignidade abdominal localmente avançada em 1979. Estudos adicionais na década de 1980 entregaram agentes quimioterápicos em concentrações até 30 vezes maiores do que aquelas administradas com segurança por via IV. Em meados da década de 1980, Sugarbaker liderou o Washington Cancer Institute em uma investigação mais aprofundada sobre a terapia para malignidades gastrointestinais com disseminação peritoneal e foi capaz de relatar benefícios de sobrevivência. Tornou-se evidente desde o início que a conclusão da citorredução estava associada a benefícios de sobrevida. Em 1995, Sugarbaker criou uma abordagem gradual para citorredução, em uma tentativa de padronizar e otimizar esse processo.
A técnica HIPEC também foi melhorada, sugerindo várias modalidades de entrega. A técnica do "Coliseu", bem como uma abordagem semelhante descrita pelo Dr. Paul Sugarbaker em 1999, eram técnicas abdominais abertas onde a quimioterapia aquecida era aplicada . Os benefícios dessa abordagem aberta incluíam acesso direto do cirurgião à cavidade durante a administração dos agentes hipertérmicos manipular o fluido e o intestino para atingir uma temperatura e distribuição rápida e homogênea do fármaco no abdômen. Além disso, deve-se tomar cuidado para garantir que todas as superfícies peritoneais sejam expostas igualmente ao longo da terapia, bem como evitar temperaturas perigosas ou superexposição aos tecidos normais. Em comparação, a técnica fechada envolve o fechamento da parede abdominal antes da infusão da quimioterapia, reduzindo o problema de perda de calor das superfícies peritoneais. Na tentativa de combinar vantagens potenciais dessas duas técnicas, Sugarbaker empregou um método semiaberto desenvolvendo um novo instrumento de contenção (afastador de Thompson) descrito em 2005 para suportar a elevação estanque das bordas da pele abdominal. Mais recentemente, uma abordagem laparoscópica para SRC com HIPEC em pacientes altamente selecionados com carga mínima de doença foi descrita.
Outro avanço ocorreu em 2016, quando Lotti M. et al. descreveram uma nova técnica, a técnica Laparoscopy-Enhanced HIPEC (LE-HIPEC), na qual a quimioterapia hipertérmica é administrada após o fechamento da ferida abdominal e uma abordagem laparoscópica é usada para agitar o conteúdo abdominal durante a perfusão. Lotti M questionou a afirmação de que a técnica do Coliseu poderia alcançar a distribuição homogênea do calor. O objetivo do LE-HIPEC é obter uma melhor distribuição e preservação do calor (como na técnica fechada) e uma melhor circulação do fluido de perfusão (como na técnica aberta). Em comparação com a técnica de abdômen fechado padrão, a técnica LE-HIPEC permite que o cirurgião abra os compartimentos abdominais para permitir a entrada do fluido de perfusão aquecido. Além disso, permite a identificação e divisão das aderências intra-abdominais iniciais que podem dificultar a circulação do fluido de perfusão durante uma perfusão de abdome fechado padrão. Em outro estudo, Lotti M et al. mostraram que após a RSC ocorrem aderências intra-abdominais precoces em 70% dos pacientes, logo após o fechamento da ferida.
Mecanismo
A quimioterapia infundida difunde-se do fluido intraperitoneal para o tecido, espaço intersticial e plasma, semelhante à diálise peritoneal . A barreira plasma-peritônio evita a absorção sistêmica da quimioterapia na corrente sanguínea, limitando assim a toxicidade e os efeitos colaterais. Certos agentes, como cisplatina ou mitomicina C, são aquecidos a 41 ° C-43 ° C para um efeito citotóxico intensificado.
Anestésicos
Foi relatado que a terapia direcionada a objetivos pode contribuir para o ajuste individual da fluidoterapia e dos medicamentos, o que pode permitir evitar a hiperidratação e garantir a estabilidade hemodinâmica .
Controvérsia
Embora potencialmente curativo, CRS mais HIPEC está associado a morbidade e mortalidade perioperatórias substanciais e um declínio de curto prazo na qualidade de vida. Os céticos desse procedimento argumentam que não existe um estudo multicêntrico randomizado de Fase 3 que compare CRS + HIPEC com citorredução completa seguida por terapia sistêmica. Portanto, esta terapia não atingiu os padrões científicos para ser considerada padrão de tratamento. No entanto, os proponentes da CRS + HIPEC argumentam que, até agora, não houve nenhuma terapia sistêmica que forneceu sobrevida prolongada para metástases peritoneais. As metástases peritoneais, com base no tumor primário e na extensão da doença, têm uma sobrevida global mediana de menos de 36 meses com base na terapia sistêmica isolada. O tratamento da carcinomatose peritoneal de origem colorretal com cirurgia citorredutora (CRS) mais quimioterapia intraperitoneal hipertérmica (HIPEC) tem uma taxa de cura livre de 5 anos ou cura de pelo menos 16%.
