Tecido linfóide associado ao intestino - Gut-associated lymphoid tissue
| Tecido linfóide associado ao intestino | |
|---|---|
| Detalhes | |
| Sistema | Sistema linfático |
| Identificadores | |
| Acrônimo (s) | GALT |
| Terminologia anatômica | |
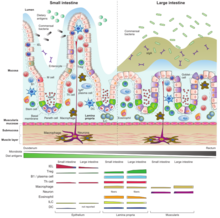
O tecido linfóide associado ao intestino (GALT) é um componente do tecido linfóide associado à mucosa (MALT) que atua no sistema imunológico para proteger o corpo da invasão no intestino .
Devido à sua função fisiológica na absorção dos alimentos, a superfície da mucosa é delgada e atua como uma barreira permeável ao interior do corpo. Da mesma forma, sua fragilidade e permeabilidade criam vulnerabilidade à infecção e, de fato, a grande maioria dos agentes infecciosos que invadem o corpo humano utilizam essa via. A importância funcional do GALT na defesa do organismo depende de sua grande população de plasmócitos , produtores de anticorpos , cujo número supera o número de plasmócitos do baço , linfonodos e medula óssea combinados. GALT constitui cerca de 70% do sistema imunológico por peso; GALT comprometido pode afetar significativamente a força do sistema imunológico como um todo.
Estrutura
O tecido linfóide associado ao intestino se estende por todo o intestino, cobrindo uma área de aproximadamente 260–300 m 2 . Para aumentar a área de superfície de absorção, a mucosa intestinal é formada por projeções em forma de dedo ( vilosidades ), recobertas por uma monocamada de células epiteliais , que separa o GALT do lúmen intestinal e seu conteúdo. Essas células epiteliais são recobertas por uma camada de glicocálice em sua superfície luminal para proteger as células do pH ácido.
Novas células epiteliais derivadas de células-tronco são produzidas constantemente no fundo das glândulas intestinais , regenerando o epitélio (o tempo de renovação das células epiteliais é inferior a uma semana). Embora nessas criptas os enterócitos convencionais sejam o tipo dominante de células, as células de Paneth também podem ser encontradas. Eles estão localizados na parte inferior das criptas e liberam uma série de substâncias antibacterianas, entre elas a lisozima, e acredita-se que estejam envolvidas no controle de infecções.
Abaixo deles, existe uma camada subjacente de tecido conjuntivo frouxo chamada lâmina própria . Também há circulação linfática através do tecido conectado aos linfonodos mesentéricos .
Tanto o GALT quanto os linfonodos mesentéricos são locais onde a resposta imune é iniciada devido à presença de células imunes através das células epiteliais e da lâmina própria .
O GALT também inclui as placas de Peyer no intestino delgado , folículos linfóides isolados presentes em todo o intestino e no apêndice em humanos.
Os exemplos a seguir compreendem tecidos linfóides que atuam como interfaces entre o sistema imunológico e os antígenos de entrada, como antígenos alimentares ou como antígenos da microbiota patogênica ou comensal:
- Anel tonsilar de Waldeyer
- Pequenos agregados linfóides no esôfago
- Tecido linfóide que se acumula com a idade no estômago
- Manchas de Peyer no intestino delgado
- Células linfóides difusamente distribuídas e células plasmáticas na lâmina própria do intestino
- Linfócitos intraepiteliais ( IELs ) intercalados na camada epitelial das superfícies mucosas
- Agregados linfóides no apêndice e no intestino grosso
- Linfonodos mesentéricos drenando linfa proveniente do tecido intestinal
O GALT também pode ser dividido em duas categorias, considerando a estrutura da qual surge a função. Lá podem ser encontrados 1.) GALT organizado formado por foliculos - como placas de Peyer, linfonodos mesentéricos e até apêndices mais organizados. Sua principal função é induzir a reação imunológica. 2.) GALT difuso com células T e B únicas, macrófagos, eosinófilos, basófilos e mastócitos, preferencialmente encontrados na lâmina própria. Esta parte do GALT é composta por células efetoras maduras, prontas para realizar suas ações.
Patches de Peyer
O adesivo de Peyer é um agregado de células linfóides projetadas para o lúmen do intestino que atua como um local muito importante para o início da resposta imune. Ele forma uma cúpula subepitelial onde grande número de folículos de células B com seus centros germinativos, células T estão entre eles em um número menor e células dendríticas são encontradas. Nesta área, a cúpula subepitelial é separada do lúmen intestinal por uma camada de epitélio associado ao folículo . Este contém células epiteliais intestinais convencionais e um pequeno número de células epiteliais especializadas chamadas células microfoldadas (células M) entre elas . Ao contrário dos enterócitos, essas células M apresentam uma superfície luminal dobrada em vez das microvilosidades, não secretam enzimas digestivas ou muco e carecem de uma superfície espessa de glicocálice, podendo estar em contato com a microbiota e antígenos presentes no conteúdo do intestino.
Função
Em circunstâncias normais, o sistema imunológico de todo o organismo precisa de uma fonte intestinal de antígenos para treinar e regular o desenvolvimento de várias células imunológicas. Sem esse estímulo, muitas propriedades do sistema imunológico não se desenvolvem, como é mostrado no caso de animais livres de germes. Como as células imunes estão em contato constante com antígenos bacterianos e alimentares, a resposta primária é configurada como tolerogênica. Ainda assim, deve haver uma defesa robusta em um caso em que os patógenos cruzem a linha limite do epitélio ou produzam substâncias nocivas como toxinas bacterianas. Esse caminhar na ponta de uma faca é garantido por diversos tipos de células do sistema imunológico:
Linfócitos B
As células plasmáticas B que residem na lâmina própria produzem altos níveis de anticorpos IgA secretores específicos . Esses IgA são secretados no lúmen do intestino através da camada epitelial por transcitose. Em primeiro lugar, a célula epitelial se liga a um dímero de IgA via receptor de Ig polimérico no lado basolateral e o transporta em uma vesícula para o espaço luminal. Em seguida, o receptor é clivado proteoliticamente e o dímero de IgA é liberado com uma porção do receptor chamada de componente secretor . O componente secretor protege os anticorpos secretados contra o meio digestivo no intestino.
Um alto nível de IgA secretora resulta da interação de células B e células dendríticas apresentadoras de antígeno intestinal (DC) em cooperação com a célula folicular T helper (Tfh) nos centros germinativos (GCs) das placas de Peyer. Existem duas formas principais de produção de IgA 1) dependente de células T resultando em sIgAs com alta afinidade e especificidade e 2) geração independente de células T de sIgA, que utiliza células dendríticas e sua produção de citocinas BAFF e APRIL. As células T sIgAs produzidas independentemente têm menor afinidade e revestem principalmente comensais. As funções gerais das IgAs secretoras são revestir qualquer uma das bactérias intestinais (comensais ou patogênicas) para prejudicar sua motilidade e evitar que entrem em contato direto e prolongado com o epitélio intestinal e o sistema imunológico intestinal do hospedeiro. Isso é chamado de exclusão imunológica. IgAs secretados se ligam a toxinas bacterianas e também as neutralizam.
Linfócitos T
As células T CD4 + naive diferenciam-se em Treg ou vários subconjuntos de células T auxiliares (Th1, Th2, Th17 ou Tfh). No tecido linfóide associado ao intestino, o processo de diferenciação ocorre por meio da apresentação de antígenos derivados da microbiota intestinal por células apresentadoras de antígenos, como células dendríticas ou células M em placas de Peyer. O processo típico de tolerância oral para antígenos alimentares ingeridos pode ser descrito como uma amostragem luminal contínua de antígenos por DCs e sua migração subsequente seguida por preparação de células T virgens em linfonodos mesentéricos para se tornarem células T imunossupressoras (Treg). Os antígenos recebidos desta forma garantem a tolerância contra eles. A microbiota comensal também ativa a resposta imune - de uma forma que protege o tecido intestinal do hospedeiro de danificá-lo por reações de células imunes. O resultado final das populações de células T em indivíduos saudáveis difere do espectro de células T resultantes de infecção aguda ou inflamação crônica. A estimulação inadequada (tipicamente por bactérias filamentosas segmentadas - SFB ) da resposta crônica das células Th1 ou Th17 desempenha um papel crucial no dano patológico ao hospedeiro.
Várias novas células linfóides associadas ao intestino foram descritas. Eles são de origens diferentes e seguem diferentes processos de maturação, mas compartilham o mesmo papel do GALT - para responder rapidamente a patógenos e secretar citocinas efetoras. Esses sistemas de proteção em várias camadas destacam a suscetibilidade dos locais da mucosa aos agentes invasores. A via mucosa é a forma mais frequente de entrada de infecções patogênicas no hospedeiro. O envolvimento robusto de uma variedade de células linfóides que patrulham a camada epitelial também reflete a pressão evolutiva e a corrida armamentista entre os sistemas imunológicos e os patógenos que escapam ao seu controle.
Linfócitos intraepiteliais (IELs)
Os linfócitos intraepiteliais residenciais e de longa vida são uma das maiores populações de linfócitos T no corpo. Em contraste com outros linfócitos periféricos, o IEL não circula na corrente sanguínea ou no sistema linfático, mas reside na camada epitelial do intestino. Essa localização é muito especial por si só - os IELs patrulham a condição dentro de uma única camada de células e têm aparência dendrítica. Eles fornecem a primeira linha de defesa no caso do patógeno cruzar a barreira epitelial. Os IELs abrangem uma diversidade surpreendente de origens e se dividem em duas categorias principais - convencionais e não convencionais. Baseia-se nas propriedades da superfície molecular e no local onde adquirem seu programa citotóxico efetor final.
Os IELs convencionais carregam o receptor TCR clássico composto pelas subunidades α e β juntamente com co-receptores CD4 ou CD8. Eles representam uma minoria relativa do total de IELs intestinais em comparação com IELs não convencionais. Eles são derivados de células T virgens que encontram antígenos na periferia (normalmente antígenos exibidos por DC nas placas de Peyer). Após essa ativação, os IELs convencionais expressam moléculas com tropismo intestinal, permitindo que se alojem no tecido intestinal após o tráfego através da corrente linfática e subsequente corrente sanguínea. As células intraepiteliais convencionais são, portanto, células T efetoras de memória residentes no tecido, capazes de responder rapidamente com atividade citolítica e liberação de citocinas como INFγ e TNF.
Os IELs não convencionais apresentam a maioria das células IEL na camada epitelial intestinal e adquirem seu programa efetor após sair do timo como células virgens e encontrar antígenos no GALT. Após tal estimulação, IELs não convencionais (principalmente células T γδ ) residem no epitélio intestinal. As células T γδ expressam o receptor de TCR feito das subunidades γ e δ e não reconhecem os peptídeos de antígeno apresentados na forma ligada ao MHC. O processo de sua ativação ainda é amplamente desconhecido. A principal propriedade das células T γδ é a formação de populações de memória de longa duração em tecidos de barreira, como o epitélio intestinal ou na pele. Eles executam a memória imunológica em determinado tecido, mesmo após a eliminação do patógeno ou o recuo da inflamação.
Células linfóides inatas (ILCs)
As células linfoides inatas (ILCs) são a família mais recentemente descoberta de células imunes inatas e o termo "inatas" significa que elas não precisam de rearranjo do gene do receptor de antígeno. Devido ao desenvolvimento de um novo método, como o sequenciamento de RNA de uma única célula, são descritos subtipos de células linfoides inatas. Com base em seu perfil de transcrição definido pelos principais fatores de transcrição, os ILCs são divididos em cinco subconjuntos distintos: células NK, ILC1s, ILC2s, ILC3s e células LTi. As ILCs são prevalentes nas superfícies da mucosa, desempenhando um papel fundamental na imunidade e na homeostase da mucosa devido à sua capacidade de secreção rápida de citocinas imunorreguladoras e, assim, comunicar-se com outras células do sistema imunológico.
Imunidade inata
Ao lado da imunidade adaptativa específica, uma imunidade inata desempenha um papel significativo no GALT porque fornece uma resposta mais rápida. O reconhecimento da não auto-assinatura microbiana ocorre por receptores de reconhecimento de padrões (PRR) que podem ser encontrados em células dendríticas, macrófagos, monócitos, neutrófilos e células epiteliais. Os PRRs se ligam ao padrão microbiano conservado, como componentes da parede celular (LPS, ácido teicóico, flagelina, peptidoglicano) ou ácido nucleico viral ou bacteriano. Os PRRs estão localizados extracelularmente como receptores ligados à membrana (receptores semelhantes a Toll) ou intracelularmente (receptores semelhantes a NOD e semelhantes a RIG). Uma paleta variada de receptores de reconhecimento de padrões é ativada por vários sinais chamados PAMP (padrões moleculares associados a patógenos) ou por sinais conectados a danos ao tecido chamados DAMP (padrões moleculares associados a danos).
Macrófagos
A maioria das células apresentadoras de antígenos (APCs) no intestino é derivada de macrófagos, que têm uma renovação muito rápida. Os macrófagos são prevalentes na lâmina própria e nas camadas mais profundas da submucosa, como a camada muscular. Os macrófagos podem usar seus dendritos transepiteliais (extensões citoplasmáticas longas) e entrar em contato direto com a camada epitelial e amostras de bactérias luminais. Em condições saudáveis, os macrófagos engolfam bactérias comensais e detritos celulares circundantes, secretam IL-10, conduzem a maturação de Treg e contribuem para a homeostase do tecido. Devido à baixa expressão de receptores de resposta inatos e moléculas de superfície coestimulatórias, os macrófagos intestinais não iniciam a inflamação. Porém, com a infecção ou inflamação, o perfil dos macrófagos muda e eles passam a secretar grandes quantidades de TNF- α e se tornam células efetoras pró-inflamatórias.
Células dendríticas
DCs apresentam menos de 10% da lâmina própria APC e normalmente não residem nas camadas inferiores. A produção inerente de ácido retinóico e TGF-β (típica para DCs associadas ao intestino) induz a expressão de moléculas de homing intestinal e favorece a troca de IgA durante a maturação de células B em foliculos. DCs também direcionam Treg e IELs convencionais para receber seu fenótipo final de células efetoras maduras no intestino.
Outros animais
A imunidade adaptativa , mediada por anticorpos e células T , só é encontrada em vertebrados . Enquanto todos eles têm um tecido linfóide associado ao intestino e a grande maioria tem uma versão do baço e do timo , nem todos os vertebrados apresentam medula óssea , linfonodos ou centros germinativos , o que significa que nem todos os vertebrados podem gerar linfócitos na medula óssea. Essa distribuição diferente dos órgãos adaptativos nos diferentes grupos de vertebrados sugere o GALT como a primeira parte do sistema imune adaptativo nos vertebrados. Foi sugerido que a partir desse GALT existente, e devido à pressão exercida por bactérias comensais no intestino que co-evoluíram com vertebrados, especializações posteriores como timo, baço ou linfonodos surgiram como parte do sistema imunológico adaptativo .
Imagens adicionais
Referências
links externos
- Imagem histológica: 12502loa - Sistema de aprendizagem de histologia na Universidade de Boston - "Sistema digestivo: Canal alimentar: cólon , tênia coli "
- Imagem histológica: 11102loa - Sistema de aprendizagem de histologia na Universidade de Boston - "Sistema digestivo: Canal alimentar: junção esofágica / estomacal"