Protoporfiria eritropoiética - Erythropoietic protoporphyria
| Protoporfiria eritropoiética | |
|---|---|
| Outros nomes | EPP |
 | |
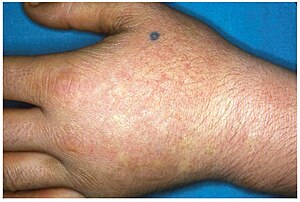
| Lesões cutâneas crônicas de EPP | |
| Especialidade |
Endocrinologia , dermatologia |
| Fatores de risco | dor e irritação |
A protoporfiria eritropoiética (ou comumente chamada de PPE) é uma forma de porfiria , que varia em gravidade e pode ser muito dolorosa. Ela surge de uma deficiência na enzima ferrochelatase , levando a níveis anormalmente elevados de protoporfirina nos glóbulos vermelhos (eritrócitos) , plasma, pele e fígado . A gravidade varia significativamente de indivíduo para indivíduo.
Uma forma clinicamente semelhante de porfiria, conhecida como protoporfiria dominante ligada ao X, foi identificada em 2008.
Apresentação
A PPE geralmente se apresenta na infância com o modo de apresentação mais comum como fotossensibilidade aguda da pele. Afeta áreas expostas ao sol e tende a ser intratável. Alguns minutos de exposição ao sol induzem prurido, eritema, inchaço e dor. Períodos mais longos de exposição podem induzir queimaduras de segundo grau. Após exposições repetitivas, os pacientes podem apresentar liquenificação, hipopigmentação, hiperpigmentação e cicatrizes na pele.
A PPE geralmente se apresenta pela primeira vez na infância e geralmente afeta a face e as superfícies superiores dos braços, mãos e pés e as superfícies expostas das pernas. A maioria dos pacientes, se a PPE não for tão grave, manifesta sintomas com início da puberdade, quando os níveis de hormônios masculinos e femininos aumentam durante o desenvolvimento e manutenção sexual. A PPE mais grave pode se manifestar na infância. A PPE pode ser desencadeada pela exposição ao sol, mesmo que o paciente esteja atrás de um vidro. Mesmo as emissões de UV da soldagem a arco com o uso de máscara de proteção completa são conhecidas por desencadear o EPP. A PPE também pode se manifestar entre as idades de 3 e 6 anos.
A exposição prolongada ao sol pode causar edema das mãos, rosto e pés, raramente com bolhas e petéquias. O espessamento da pele às vezes pode ocorrer com o tempo.
Pessoas com PPE também apresentam risco aumentado de desenvolver cálculos biliares . Um estudo observou que os pacientes com PPE sofrem de deficiência de vitamina D.
Insuficiência hepática
A protoporfirina se acumula em níveis tóxicos no fígado em 5–20% dos pacientes com PPE, levando à insuficiência hepática. O espectro da doença hepatobiliar associada à PPE é amplo. Inclui colelitíase, doença hepática parenquimatosa leve, doença hepatocelular progressiva e doença hepática em estágio terminal.
A falta de marcadores diagnósticos para a insuficiência hepática torna difícil prever quais pacientes podem apresentar insuficiência hepática, e o mecanismo da insuficiência hepática é mal compreendido. Um estudo europeu retrospectivo identificou 31 pacientes com PPE que receberam transplante de fígado entre 1983 e 2008, com reações fototóxicas em 25% dos pacientes desprotegidos por filtros de luz cirúrgicos. O mesmo estudo observou uma recorrência de 69% da doença no órgão enxertado. Cinco transplantes de fígado no Reino Unido para PPE foram identificados entre 1987 e 2009. Teste hepático frequente é recomendado em pacientes com PPE, onde nenhuma terapia eficaz foi identificada para controlar a insuficiência hepática até o momento.
Gravidez
Há relatos de que os sintomas de fotossensibilidade da PPE diminuem em algumas pacientes do sexo feminino durante a gravidez e a menstruação, embora esse fenômeno não seja consistente e o mecanismo não seja compreendido.
Genética
A maioria dos casos de PPE são resultados de erros inatos do metabolismo, mas o defeito metabólico em alguns pacientes pode ser adquirido. A mutação do gene que codifica a ferrochelatase no braço longo do cromossomo 18 é encontrada na maioria dos casos. A ferroquelatase (FECH) catalisa a inserção de ferro ferroso no anel da protoporfirina IX para formar o heme. A EPP exibe padrões de herança recessivos e dominantes e um alto grau de heterogeneidade alélica com penetrância incompleta. A maioria dos heterozigotos é assintomática. Os sintomas não ocorrem, a menos que a atividade de FECH seja inferior a 30% do normal, mas esses níveis baixos não estão presentes na maioria dos pacientes.
Fisiopatologia
As células que sintetizam heme são predominantemente eritroblastos / reticulócitos na medula óssea (80%) e hepatócitos (20%). A deficiência de FECH resulta no aumento da liberação de protoporfirina, que se liga à albumina no plasma e, subsequentemente, sofre extração hepática. Normalmente, a maior parte da protoporfirina nos hepatócitos é secretada na bile; o restante sofre transformação em heme. Alguma protoporfirina na bile retorna ao fígado como consequência da circulação entero-hepática; a protoporfirina restante no intestino sofre excreção fecal. A protoporfirina é insolúvel e, portanto, indisponível para excreção renal. Na PPE, a biotransformação subnormal da protoporfirina em heme resulta no acúmulo de protoporfirina nos hepatócitos.
Uma vez que a deficiência de FECH está associada a concentrações aumentadas de protoporfirina nos eritrócitos, plasma, pele e fígado, a retenção de protoporfirina na pele predispõe à fotossensibilidade aguda. Como resultado da absorção de luz ultravioleta e visível (pico de sensibilidade a 400 nm, com picos menores entre 500-625 nm) pela protoporfirina no plasma e eritrócitos, quando o sangue circula pelos vasos dérmicos, os radicais livres são formados, os eritrócitos tornam-se instáveis e sofrem lesões para a pele é induzida.
Um aumento significativo na excreção hepatobiliar de protoporfirina pode causar danos ao fígado por meio de fenômenos colestáticos e estresse oxidativo - predispondo à doença hepatobiliar em vários graus de gravidade
Diagnóstico
A EPP é geralmente suspeitada pela presença de fotossensibilidade aguda da pele e pode ser confirmada pela detecção de um pico de fluorescência plasmática a 634 nm. Também é útil encontrar níveis aumentados de protoporfirina nas fezes e a demonstração de um excesso de protoporfirina livre nos eritrócitos.
A triagem de mutação FECH em um alelo ou mutação de ganho de função do ácido aminolevulínico sintase 2 em membros da família selecionados pode ser útil, especialmente no aconselhamento genético.
A biópsia hepática confirma a doença hepática na PPE pela presença de depósitos de protoporfirina nos hepatócitos que podem ser observados como um pigmento marrom nos canalículos biliares e nos macrófagos portais. Macroscopicamente, o fígado cirrótico pode ter uma coloração preta devido aos depósitos de protoporfirina. Usando luz polarizada, é encontrada a forma em cruz de Malta característica de depósitos de pigmentos cristalinos birrefringentes. O exame do tecido hepático sob uma lâmpada de Wood revela uma fluorescência vermelha devido à protoporfirina. A biópsia hepática não é útil para estimar o prognóstico de doença hepática.
Tratamento
Não há cura para esse distúrbio; no entanto, os sintomas geralmente podem ser controlados limitando a exposição ao sol diurno e alguns tipos de iluminação artificial. A maioria dos tipos de iluminação artificial emite luz em comprimentos de onda problemáticos, sendo a iluminação fluorescente a pior infratora. A temperatura da cor pode ser um bom indicador de qual luz é mais prejudicial, pois quanto mais alta a temperatura da cor, mais luz violeta (380-450 nm) é emitida. A iluminação incandescente e LED na faixa de branco suave (2700-3000K) produz a luz menos problemática. Além disso, a seleção de lâmpadas de baixa potência pode reduzir a produção geral de luz.
Uma vez que a fotossensibilidade resulta da luz no espectro visível, a maioria dos filtros solares tem pouca utilidade (com exceção do óxido de zinco não nano , que fornece proteção uniforme entre 290-400 nm e alguma proteção até 700 nm). Roupas de proteção solar também podem ser muito úteis, embora roupas com valores UPF sejam avaliados apenas com base em sua proteção UV (até 400 nm) e não em sua proteção do espectro visível. Alguns fabricantes de roupas de proteção solar usam óxido de zinco em seus tecidos, como a linha ZnO Suntect da Coolibar, que oferece proteção contra a luz visível.
Alguns pacientes constroem gradualmente uma camada protetora de melanina , expondo-se regularmente por curtos períodos de tempo à radiação ultravioleta.
Películas para janelas que bloqueiam a luz ultravioleta e visível até 450 nm podem fornecer alívio dos sintomas se aplicadas nas janelas do automóvel e da casa do paciente. Um exemplo disso seria Madico Amber 81, que pode proteger através da faixa de 500 nm.
Os protetores de tela de bloqueio azul podem ajudar a aliviar os sintomas causados por televisores, telefones, tablets e telas de computador.
A EPP é considerada uma das porfirias menos graves. A menos que haja insuficiência hepática, não é uma doença com risco de vida.
Terapias aprovadas
O afamelanotido , desenvolvido pela Clinuvel Pharmaceuticals, com sede na Austrália, foi aprovado na Europa em dezembro de 2014 para o tratamento ou prevenção da fototoxicidade em adultos com PPE.
Uso não descrito
Vários medicamentos são usados off label por pacientes com PPE:
- O ácido ursodeoxicólico é um ácido biliar administrado para promover a secreção biliar de protoporfirina. Os resultados de seu uso na EPP são controversos. No entanto, sabe-se que altera a composição da bile, protege os hepatócitos do efeito citotóxico dos ácidos biliares hidrofóbicos e estimula a secreção biliar por vários mecanismos distintos.
- A hematina parece reduzir o excesso de produção de protoporfirina na medula óssea. Foi administrado a pacientes com PPE (3-4 mg / kg iv) que desenvolveram uma crise após o transplante de fígado.
- A plasmaférese também pode diminuir os níveis de protoporfirina no plasma, porém seu uso no tratamento de episódios agudos é controverso.
- A colestiramina é uma resina administrada por via oral que reduz os níveis circulantes de protoporfirina ligando-se à protoporfirina no intestino e, portanto, interrompendo a circulação entero-hepática. Geralmente é usado em combinação com outras abordagens de tratamento.
- O carvão ativado , como a colestiramina, liga-se à protoporfirina no intestino e impede sua absorção. É barato e está prontamente disponível. Parece ser eficaz na redução dos níveis circulantes de protoporfirina.
O transplante de medula óssea , o transplante de fígado , a acetilcisteína , a diálise extracorpórea com albumina , o ferro parenteral e a transfusão de eritrócitos são planos alternativos para o tratamento do PEE.
Suplementos OTC
Alguns suplementos de venda livre podem ajudar:
- Proferrin é um suplemento oral de heme que pode funcionar de forma semelhante à hematina.
- B. subtilis (um probiótico de solo gram-positivo) produz ferrochelatase, que pode ser capaz de converter parte da protoporfirina no intestino em heme.
- Beta-caroteno , embora uma recente meta-análise do tratamento com caroteno tenha questionado sua eficácia.
Epidemiologia
Relatos de caso sugerem que a EPP é prevalente em todo o mundo. A prevalência foi estimada em algo entre 1 em 75.000 e 1 em 200.000, no entanto, observou-se que a prevalência de EPP pode estar aumentando devido a uma melhor compreensão da doença e a um melhor diagnóstico. Estima-se que 5.000 a 10.000 pessoas em todo o mundo tenham EPP. A EPP é considerada a forma mais comum de porfiria em crianças. A prevalência na Suécia foi publicada como 1: 180.000.
História
A protoporfiria eritropoiética foi descrita pela primeira vez em 1953 por Kosenow e Treibs e concluída em 1960 por Magnus et al. no Instituto de Dermatologia de St John, em Londres.
Veja também
Referências
links externos
- Protoporfiria eritropoiética na NLM Genetics Home Reference
| Classificação | |
|---|---|
| Fontes externas |