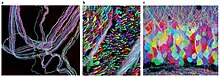
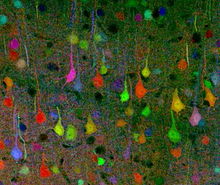
Brainbow - Brainbow
Brainbow é um processo pelo qual neurônios individuais no cérebro podem ser distinguidos de neurônios vizinhos usando proteínas fluorescentes. Ao expressar aleatoriamente diferentes proporções de derivados vermelhos, verdes e azuis da proteína fluorescente verde em neurônios individuais, é possível sinalizar cada neurônio com uma cor distinta. Este processo tem sido uma importante contribuição para o campo da neurais conectonomia .
A técnica foi desenvolvida originalmente em 2007 por uma equipe liderada por Jeff W. Lichtman e Joshua R. Sanes , ambos da Universidade de Harvard . A técnica original foi recentemente adaptado para utilização com outros organismos modelo, incluindo Drosophila melanogaster , Danio rerio , e Arabidopsis thaliana .
Embora as técnicas de rotulagem anteriores permitissem o mapeamento de apenas alguns neurônios, esse novo método permite que mais de 100 neurônios mapeados de forma diferente sejam iluminados de forma simultânea e diferencial dessa maneira. Isso leva à sua característica aparência multicolorida na imagem, ganhando seu nome e ganhando prêmios em competições de fotografia científica.
História e desenvolvimento
Brainbow foi inicialmente desenvolvido por Jeff W. Lichtman e Joshua R. Sanes na Universidade de Washington em St. Louis , embora eles tenham se mudado para a Universidade de Harvard desde então. A equipe construiu Brainbow usando um processo de duas etapas: primeiro, uma construção genética específica foi gerada que poderia ser recombinada em vários arranjos para produzir uma de três ou quatro cores com base nas proteínas fluorescentes específicas (XFPs) sendo implementadas. Em seguida, várias cópias da mesma construção transgênica foram inseridas no genoma da espécie alvo, resultando na expressão aleatória de diferentes proporções de XFP e, subsequentemente, fazendo com que diferentes células exibissem uma variedade de tons coloridos.
Brainbow foi originalmente criado como uma melhoria em relação às técnicas de neuroimagem mais tradicionais , como coloração de Golgi e injeção de corante, ambas apresentando limitações severas para os pesquisadores em sua capacidade de visualizar a intrincada arquitetura do circuito neural no cérebro . Enquanto as técnicas mais antigas só eram capazes de corar células com uma gama restrita de cores, muitas vezes utilizando camundongos transgênicos bicolores e tricolores para revelar informações limitadas em relação às estruturas neuronais, o Brainbow é muito mais flexível porque tem a capacidade de rotular de forma fluorescente neurónios individuais com até aproximadamente 100 tons diferentes, de modo que os cientistas podem identificar e diferenciar entre mesmo dendríticas e axonais processos. Ao revelar essas informações detalhadas sobre a conectividade e os padrões neuronais, às vezes até in vivo, os cientistas costumam inferir informações sobre as interações neuronais e seu subsequente impacto sobre o comportamento e a função. Assim, Brainbow preencheu o vazio deixado pelos métodos de neuroimagem anteriores.
Com o recente advento do Brainbow na neurociência , os pesquisadores agora são capazes de construir mapas específicos de circuitos neurais e investigar melhor como eles se relacionam com várias atividades mentais e seus comportamentos conectados (ou seja, Brainbow revela informações sobre as interconexões entre os neurônios e suas interações subsequentes que afetam funcionalidade geral do cérebro). Como uma extrapolação adicional deste método, Brainbow pode, portanto, também ser usado para estudar distúrbios neurológicos e psicológicos, analisando as diferenças nos mapas neurais.
Métodos
As técnicas do Brainbow baseiam-se na recombinação Cre-Lox , na qual a proteína Cre recombinase conduz a inversão ou excisão de DNA entre os locais loxP. O método Brainbow original inclui Brainbow-1 e Brainbow-2, que utilizam diferentes formas de recombinação cre / lox. Brainbow-3, uma versão modificada do Brainbow-1, foi desenvolvido em 2013. Para todos os subtipos Brainbow, a expressão de um determinado XFP é um evento estocástico ou aleatório.
Brainbow-1 usa construções de DNA com diferentes genes de proteínas fluorescentes (XFPs) separados por formas mutantes e canônicas de loxP. Isso cria um conjunto de possibilidades de excisão mutuamente exclusivas, uma vez que a recombinação mediada por cre ocorre apenas entre locais loxP idênticos. Após a recombinação ocorrer, a proteína fluorescente que é deixada diretamente após o promotor é expressa de forma única. Assim, uma construção com quatro XFPs separados por três locais loxP diferentes, três eventos de excisão e a construção original pode produzir quatro proteínas fluorescentes diferentes.
Brainbow-2 usa excisão e inversão Cre para permitir múltiplas possibilidades de expressão em uma determinada construção. Em um segmento de DNA com dois XFPs opostamente orientados, Cre irá induzir um evento de inversão aleatório que deixa uma proteína fluorescente na orientação adequada para expressão. Se duas dessas sequências invertíveis estiverem alinhadas, três eventos de inversão diferentes são possíveis. Quando os eventos de excisão também são considerados, uma das quatro proteínas fluorescentes será expressa para uma determinada combinação de excisões e inversões Cre.
Brainbow-3 retém o formato Brainbow-1 loxP, mas substitui os genes RFP, YFP e CFP por mOrange2, EGFP e mKate2. mO2, EGFP e mK2 foram escolhidos porque sua excitação fluorescente e espectros de emissão se sobrepõem minimamente, e porque eles compartilham homologia de sequência mínima, permitindo o projeto de anticorpos seletivos que podem ser usados para detectá-los em protocolos imunohistoquímicos . Brainbow-3 também aborda a questão do preenchimento desigual de neurônios com XFPs usando derivados farnesilados dos XFPs, que são trafegados de maneira mais uniforme para as membranas neuronais.
Brainbow é implementado in vivo através do cruzamento de duas cepas de organismos transgênicos : uma que expressa a proteína Cre e outra que foi transfectada com várias versões de um construto loxP / XFP. O uso de várias cópias do transgene permite que os XFPs se combinem de uma maneira que pode fornecer uma de aproximadamente 100 cores diferentes. Assim, cada neurônio é marcado com uma tonalidade diferente com base em sua expressão combinatória e estocástica de proteínas fluorescentes.
A fim de elucidar os padrões de expressão diferencial de XFP em uma forma visível, fatias do cérebro são fotografadas com microscopia confocal . Quando exposto a um fóton com seu comprimento de onda de excitação particular, cada fluoróforo emite um sinal que é coletado em um canal vermelho, verde ou azul, e a combinação de luz resultante é analisada com um software de análise de dados. A sobreposição de neurônios de cores diferentes permite o desemaranhamento visual de circuitos neurais complicados.
Brainbow foi predominantemente testado em camundongos até o momento; no entanto, a técnica básica descrita acima também foi modificada para uso em estudos mais recentes desde o advento do método original introduzido em 2007.
Camundongos

O cérebro do rato tem 75 milhões de neurônios e é mais semelhante a um cérebro humano do que a drosófila e outros organismos comumente usados para modelar essa técnica, como C. elegans . Os camundongos foram os primeiros organismos nos quais o método Brainbow de neuroimagem foi empregado com sucesso. Livet et al. (2007) desenvolveram duas versões de ratos Brainbow usando Brainbow-1 e Brainbow-2, que são descritos acima. Ao usar esses métodos para criar um mapa completo e rastrear os axônios de um músculo de rato, é necessário coletar dezenas de milhares de imagens e compilá-las em pilhas para criar um esquema completo. É então possível traçar cada axônio motor e seus contatos sinápticos para construir um conectoma completo do músculo.
Mais exemplos de neurônios examinados usando a técnica Brainbow em camundongos transgênicos estão localizados nos músculos do ouvido que inervam o nervo motor, tratos axônicos no tronco cerebral e no giro dentado do hipocampo .
Drosófila
A complexidade do cérebro da Drosophila, que consiste em cerca de 100.000 neurônios, o torna um excelente candidato para a implementação de técnicas de neurofisiologia e neurociência como Brainbow. Na verdade, Stefanie Hampel et al. (2011) combinou Brainbow em conjunto com ferramentas de direcionamento genético para identificar neurônios individuais dentro do cérebro de Drosophila e várias linhagens neuronais. Uma das ferramentas de direcionamento genético foi um sistema de expressão binária GAL4 / UAS que controla a expressão de UAS-Brainbow e direciona a expressão para pequenos grupos de neurônios. A utilização de métodos 'Flip Out' aumentou a resolução celular da construção do repórter. A expressão de proteínas fluorescentes, como com o Brainbow original, dependia da recombinação Cre correspondente a locais lox correspondentes. Hampel et al. (2011) também desenvolveram sua própria variação de Brainbow (dBrainbow), com base na marcação de epítopos de anticorpos em vez de fluorescência endógena. Duas cópias de sua construção geram seis cores brilhantes e separáveis. Isso, junto com as simplificações na atribuição de cores, permitiu que observassem as trajetórias de cada neurônio em longas distâncias. Especificamente, eles rastrearam neurônios motores do lobo antenal às junções neuromusculares, permitindo-lhes identificar os alvos musculares específicos de neurônios individuais.
Em última análise, esta técnica fornece a capacidade de mapear com eficácia os circuitos neuronais em Drosophila para que os pesquisadores sejam capazes de descobrir mais informações sobre a estrutura do cérebro deste invertebrado e como ela se relaciona com seu comportamento resultante.
Limitações
Como acontece com qualquer técnica de neuroimagem , Brainbow tem uma série de limitações que se originam dos métodos necessários para realizá-la. Por exemplo, o processo de criação de pelo menos duas linhagens de animais transgênicos a partir de células-tronco embrionárias é demorado e complexo. Mesmo que duas espécies transgênicas sejam criadas com sucesso, nem todos os seus descendentes apresentarão a recombinação. Portanto, isso requer um planejamento extensivo antes de realizar um experimento.
Além disso, devido à natureza aleatória da expressão das proteínas fluorescentes, os cientistas são incapazes de controlar com precisão a rotulagem dos circuitos neurais, o que pode resultar na má identificação de neurônios específicos.
O uso do arco-íris em populações de mamíferos também é dificultado pela incrível diversidade de neurônios do sistema nervoso central . A densidade absoluta de neurônios, juntamente com a presença de longos tratos de axônios, dificultam a visualização de regiões maiores do SNC com alta resolução. Brainbow é mais útil ao examinar a resolução de uma única célula no contexto de um ambiente multicelular complexo. No entanto, devido aos limites de resolução da microscopia óptica , a identificação conclusiva de conexões sinápticas entre neurônios não é facilmente realizada. Esse problema é um pouco evitado pelo uso de marcadores sinápticos para complementar o uso de microscopia óptica na visualização de conexões sinápticas.