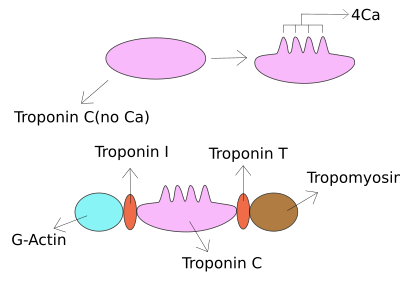
Troponina I - Troponin I
A troponina I é uma família de proteínas do músculo cardíaco e esquelético . É uma parte do complexo da proteína troponina , onde se liga à actina em miofilamentos finos para manter o complexo da tropomiosina no lugar. A troponina I impede que a miosina se ligue à actina no músculo relaxado. Quando o cálcio se liga à troponina C, ele causa mudanças conformacionais que levam ao deslocamento da troponina I. Posteriormente, a tropomiosina deixa o local de ligação da miosina na actina, levando à contração do músculo. A letra I é dada devido ao seu caráter inibitório. É um marcador útil no diagnóstico laboratorial de ataque cardíaco. Ocorre em diferentes concentrações plasmáticas, mas nas mesmas circunstâncias que a troponina T - qualquer um dos testes pode ser realizado para confirmação de lesão do músculo cardíaco e os laboratórios geralmente oferecem um ou outro.
Três parálogos com padrões de expressão específicos de tecido exclusivos são expressos em humanos, listados abaixo com suas localizações e acessos OMIM :
- Isoforma de músculo esquelético de contração lenta troponina I, TNNI1 (1q31.3, 191042 )
- Isoforma de músculo esquelético de contração rápida troponina I, TNNI2 (11p15.5, 191043 )
- Troponina I cardíaca, TNNI3 (19q13.4, 191044 )
cTnI
A troponina I cardíaca, frequentemente denominada cTnI, é apresentada no tecido muscular cardíaco por uma única isoforma com peso molecular de 23,9 kDa. Consiste em 209 resíduos de aminoácidos. O pI teórico de cTnI é 9,05. A cTnI difere de outras troponinas devido à sua extensão N-terminal de 26 aminoácidos. Esta extensão contém duas serinas, resíduos 23 e 24, que são fosforiladas pela proteína quinase A em resposta à estimulação beta-adrenérgica e importantes no aumento da resposta inotrópica. A fosforilação da cTnI altera a conformação da proteína e modifica sua interação com outras troponinas, bem como a interação com anticorpos anti-TnI. Essas mudanças alteram a resposta do miofilamento ao cálcio e são de interesse no combate à insuficiência cardíaca. O monitoramento de múltiplas reações da cTnI humana revelou que existem 14 locais de fosforilação e o padrão de fosforilação observado nesses locais é alterado em resposta à doença. Foi demonstrado que a cTnI é fosforilada pela proteína quinase A, proteína quinase C , proteína quinase G e p21-quinase 3 ativada . Uma parte significativa da cTnI liberada na corrente sanguínea do paciente é fosforilada. Por mais de 15 anos, a cTnI é conhecida como um marcador confiável de lesão do tecido muscular cardíaco. É considerada mais sensível e significativamente mais específica no diagnóstico de infarto do miocárdio do que o " marcador dourado " das últimas décadas - CK-MB , assim como as isoenzimas creatina quinase total , mioglobina e lactato desidrogenase .
A troponina I não é totalmente específica para dano miocárdico secundário ao infarto. Outras causas de troponina I elevada incluem insuficiência renal crônica , insuficiência cardíaca , hemorragia subaracnoide e embolia pulmonar .
Na medicina veterinária, o aumento da cTnI foi observado em danos ao miocárdio após a toxicidade dos ionóforos em bovinos.
Veja também
links externos
- Troponina + I nos títulos de assuntos médicos da Biblioteca Nacional de Medicina dos EUA (MeSH)