Reação em cascata - Cascade reaction

Uma reação em cascata , também conhecida como reação dominó ou reação em tandem , é um processo químico que compreende pelo menos duas reações consecutivas, de modo que cada reação subsequente ocorre apenas em virtude da funcionalidade química formada na etapa anterior. Nas reações em cascata, o isolamento dos intermediários não é necessário, pois cada reação que compõe a sequência ocorre espontaneamente. Na definição mais estrita do termo, as condições de reação não mudam entre as etapas consecutivas de uma cascata e nenhum novo reagente é adicionado após a etapa inicial. Em contraste, os procedimentos de um único recipiente permitem, de forma semelhante, que pelo menos duas reações sejam realizadas consecutivamente sem qualquer isolamento de intermediários, mas não impede a adição de novos reagentes ou a alteração das condições após a primeira reação. Assim, qualquer reação em cascata também é um procedimento de um único recipiente, enquanto o inverso não é verdadeiro. Embora muitas vezes compostas exclusivamente de transformações intramoleculares, as reações em cascata também podem ocorrer intermolecularmente, caso em que também se enquadram na categoria de reações multicomponentes .
Os principais benefícios das sequências em cascata são a alta economia de átomos e a redução dos desperdícios gerados pelos diversos processos químicos, bem como do tempo e trabalho necessários para realizá-los. A eficiência e a utilidade de uma reação em cascata podem ser medidas em termos do número de ligações formadas na sequência geral, o grau de aumento da complexidade estrutural por meio do processo e sua aplicabilidade a classes mais amplas de substratos.
O primeiro exemplo de uma reação em cascata é indiscutivelmente a síntese de tropinona relatada em 1917 por Robinson . Desde então, o uso de reações em cascata proliferou na área de síntese total. Da mesma forma, o desenvolvimento da metodologia orgânica dirigida por cascata também cresceu tremendamente. Este aumento do interesse em sequências em cascata é refletido pelos numerosos artigos de revisão relevantes publicados nas últimas duas décadas. Uma área de foco crescente é o desenvolvimento de catálise assimétrica de processos em cascata, empregando organocatalisadores quirais ou complexos de metais de transição quirais.
A classificação das reações em cascata às vezes é difícil devido à natureza diversa das muitas etapas da transformação. KC Nicolaou rotula as cascatas como nucleofílicas / eletrofílicas, radicais, pericíclicas ou catalisadas por metal de transição, com base no mecanismo das etapas envolvidas. Nos casos em que duas ou mais classes de reação são incluídas em uma cascata, a distinção torna-se bastante arbitrária e o processo é rotulado de acordo com o que pode ser considerado o “tema principal”. Para destacar a notável utilidade sintética das reações em cascata, a maioria dos exemplos abaixo vem da síntese total de moléculas complexas.
Cascatas nucleofílicas / eletrofílicas
Cascatas nucleofílicas / eletrofílicas são definidas como as sequências em cascata nas quais a etapa principal constitui um ataque nucleofílico ou eletrofílico.
Um exemplo de tal cascata é visto na síntese enantiosseletiva curta do antibiótico de amplo espectro (-) - cloranfenicol, relatada por Rao et al. (Esquema 1). Aqui, o epoxi-álcool quiral 1 foi primeiro tratado com dicloroacetonitrila na presença de NaH. O intermediário 2 resultante foi então submetido a uma reação em cascata mediada por BF 3 · Et 2 O. A abertura intramolecular do anel epóxido produziu o intermediário 3 , que, após uma hidrólise in situ facilitada pelo excesso de BF 3 · Et 2 O, proporcionou (-) - cloranfenicol ( 4 ) com 71% de rendimento total.
Uma cascata nucleofílica também foi empregada na síntese total do produto natural pentaleneno (Esquema 2). Neste procedimento, o éster esquarato 5 foi tratado com (5-metilciclopent-1-en-1-il) lítio e propinilítio . Os dois ataques nucleofílicos ocorreram predominantemente com adição de trans para fornecer o intermediário 6 , que espontaneamente passou por uma abertura eletrocíclica 4π-conrotatória do anel de ciclobuteno. A espécie conjugada resultante 7 equilibrou com o conformador 8 , que mais prontamente sofreu uma eletrociclização conrotatória 8π para o intermediário 9 altamente tenso . O potencial para liberar a protonação dirigida por cepas de 9 de modo que a espécie 10 foi obtida seletivamente. A cascata foi completada por uma condensação de aldol intramolecular que proporcionou o produto 11 com rendimento total de 76%. Elaboração posterior forneceu o (±) -pentaleneno alvo ( 12 ).
Cascatas Organocatalíticas
Uma subcategoria de sequências nucleofílicas / eletrofílicas é constituída por cascatas organocatalíticas, nas quais o ataque nucleofílico chave é conduzido pela organocatálise.
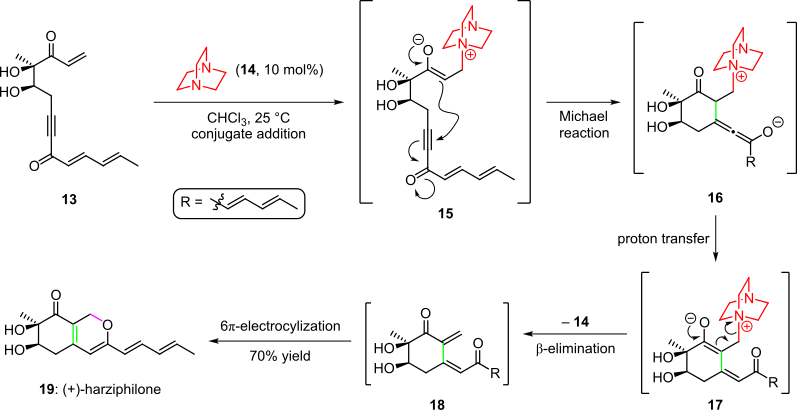
Uma cascata organocatalítica foi empregada na síntese total do produto natural harzifilona, relatada por Sorensen et al. em 2004 (Esquema 3). Aqui, o tratamento do material de partida enona 13 com organocatalisador 14 rendeu intermediário 15 por meio da adição de conjugado. A ciclização subsequente pela adição intramolecular de Michael do enolato na ligação tripla do sistema deu a espécie 16 , que forneceu o intermediário 17 após a transferência de prótons e tautomerização. A cascata foi completada pela eliminação do organocatalisador e um fechamento espontâneo do anel 6π-eletrocíclico da cis -dienona 18 resultante para (+) - harzifilona ( 19 ) em um rendimento total de 70%.
Uma notável cascata organocatalítica tripla foi relatada por Raabe et al. em 2006. Aldeídos lineares ( 20 ), nitroalcenos ( 21 ) e aldeídos α , β- insaturados ( 22 ) poderiam ser condensados organocataliticamente para proporcionar ciclohexano carbaldeídos tetra- substituídos ( 24 ) com diastereoseletividade moderada a excelente e enantiocontrole completo (Esquema 4) . A transformação é mediada pelo organocatalisador derivado de prolina 23 .
A transformação foi proposta para prosseguir através de uma sequência de adição de Michael / adição de Michael / condensação de aldol (Esquema 5). Na primeira etapa, a adição de Michael do aldeído 20 ao nitroalceno 21 ocorre por meio da catálise da enamina, originando o nitroalcano 25 . A condensação do aldeído α , β- insaturado 22 com o organocatalisador, então, facilita a adição do conjugado de 25 para dar a enamina intermediária 26 , que é propensa a sofrer uma condensação aldólica intramolecular em espécies de imínio 27 . O organocatalisador 23 é regenerado por hidrólise, juntamente com o produto 24 , fechando assim o ciclo de cascata tripla.
Cascatas radicais
Cascatas radicais são aquelas em que a etapa principal constitui uma reação radical. A alta reatividade das espécies de radicais livres torna as abordagens sintéticas baseadas em radicais decididamente adequadas para reações em cascata.
Um dos exemplos mais amplamente reconhecidos da utilidade sintética das cascatas de radicais é a sequência de ciclização empregada na síntese total de (±) -hirsuteno, em 1985 (Esquema 6). Aqui, o iodeto de alquil 28 foi convertido no radical primário intermediário 29 , que passou por uma 5- exo- ciclização para se obter as espécies reativas 30 . Uma ciclização subsequente de radical 5- exo- dig levou ao intermediário 31 , que após a extinção deu o alvo (±) -hirsuteno ( 32 ) em 80% de rendimento global.
Um processo radical em cascata também foi usado em uma das sínteses totais de (-) - morfina (Esquema 7). O brometo de arila 33 foi convertido nas espécies radicais correspondentes 34 por tratamento com hidreto de tri- n- butilestanho. Ocorreu então uma ciclização 5- exo- trig para dar o intermediário 35 estereosseletivamente em virtude da estereoquímica da ligação éter. Na próxima etapa da cascata, as restrições geométricas de 35 proíbem a via cineticamente favorecida de 5- exo- ciclização; em vez disso, a espécie de radical benzílico secundário 36 foi obtida por meio de uma ciclização de 6 endo- trigrama geometricamente permitida . A eliminação subsequente do radical fenilsulfinil proporcionou o produto 37 com 30% de rendimento global, que foi posteriormente elaborado para (-) - morfina ( 38 ).
Cascatas pericíclicas
Possivelmente o tipo de processo mais amplamente encontrado em transformações em cascata, as reações pericíclicas incluem cicloadições, reações eletrocíclicas e rearranjos sigmatrópicos. Embora alguns dos casos acima mencionados de cascatas nucleofílicas / eletrofílicas e radicais envolvam processos pericíclicos, esta seção contém apenas sequências em cascata que são compostas exclusivamente por reações pericíclicas ou em que tal reação constitui indiscutivelmente a etapa chave.
Um exemplo representativo de uma cascata pericíclica é a cascata do ácido endiandrico relatada por Nicolaou et al. em 1982 (Esquema 8). Aqui, o sistema altamente insaturado 39 foi primeiro hidrogenado na espécie de tetraeno conjugado 40 , que após aquecimento sofreu um fechamento de anel eletrocíclico conrotatório 8π, originando o intermediário cíclico 41 . Uma segunda eletrociclização espontânea, desta vez um fechamento do anel disrotatório 6π, converteu 41 na espécie bicíclica 42 , cuja geometria e estereoquímica favoreceram uma reação intramolecular de Diels-Alder subsequente. O éster metílico do ácido endiandrico B ( 43 ) foi assim obtido com um rendimento total de 23%.
Uma sequência pericíclica envolvendo reações de heterocicloadição intramolecular foi empregada na síntese total do alcalóide natural (-) - vindorosina (Esquema 9). O acesso rápido ao alvo foi obtido a partir de uma solução de 1,3,4-oxadiazol 44 em triisopropilbenzeno submetido a altas temperaturas e pressão reduzida. Primeiro, uma reação hetero-Diels-Alder de demanda inversa de elétrons ocorreu para dar o intermediário 45 . A perda termodinamicamente favorável de nitrogênio gerou as espécies contendo 1,3-dipolo 46 . Uma cicloadição espontânea intramolecular [3 + 2] do 1,3-dipolo e do sistema indol formou o endo- produto 47 com rendimento total de 78%. Elaboração posterior resultou no produto natural 48 alvo .
A síntese total de (-) - colombiasina A relatada em 2005 pelo grupo Harrowven incluiu uma cascata eletrocíclica (Esquema 10). Quando submetido ao calor por meio de irradiação de microondas, o esquarato derivado 49 passou por uma abertura eletrocíclica do anel ciclobuteno, seguida por um fechamento do anel eletrocíclico 6π que rendeu o intermediário bicíclico 51 . A sua tautomerização deu a espécie aromática 52 , que após exposição ao ar foi oxidada no produto 53 com um rendimento global de 80%. O alvo (-) - colombiasina A ( 54 ) foi então obtido a partir de 53 por meio de uma reação de Diels-Alder facilitada pelo calor seguida por clivagem do grupo protetor terc- butil.
Certos [2,2] paraciclofanos também podem ser obtidos por meio de cascatas pericíclicas, conforme relatado pelo grupo Hopf em 1981 (Esquema 11). Nesta sequência, uma reação de Diels-Alder entre 1,2,4,5-hexatetraeno 55 e dienófilo 56 formou primeiro o intermediário altamente reativo 57 , que subsequentemente dimerizou para render [2,2] paraciclofano 58 .
Cascatas catalisadas por metal de transição
As sequências em cascata catalisadas por metal de transição combinam a novidade e o poder da química organometálica com a utilidade sintética e a economia das reações em cascata, fornecendo uma abordagem ainda mais ecológica e economicamente desejável para a síntese orgânica.
Por exemplo, a catálise de ródio foi usada para converter monoterpenos acíclicos do tipo 59 a produtos de cromeno 4H em uma cascata de hidroformilação (Esquema 12). Primeiro, a hidroformilação seletiva catalisada por ródio da ligação olefina menos estericamente impedida em 59 rendeu o aldeído insaturado 60 , que nas mesmas condições foi então convertido no intermediário 61 por meio de uma reação de carbonil-eno. Uma segunda hidroformilação catalisada por ródio para a espécie 62 foi seguida por condensação para formar produtos de 4H- cromeno do tipo 63 com rendimento total de 40%.
A catálise de ródio também foi empregada para iniciar uma cascata de ciclização / cicloadição na síntese de uma tigliane relatada pelo grupo Dauben (Esquema 13). O tratamento da diazoimida 64 com dímero de acetato de ródio (II) gerou um carbenóide que rendeu ileto 65 reativo após uma ciclização intramolecular com o grupo carbonila vizinho. Uma cicloadição intramolecular [3 + 2], então, ocorreu espontaneamente para proporcionar o tigliane alvo 66 .
A cicloadição intramolecular [4 + 2] formal de 1,6-eninos do tipo 67 mediada pela catálise de ouro é outro exemplo de uma cascata catalisada por metal de transição (Esquema 14). Uma variedade de 1,6-eninas reagiu sob condições moderadas na presença de complexos de Au (I) 68a - b para produzir os produtos tricíclicos 69 em rendimentos moderados a excelentes.
Esta cicloadição formal foi proposta para prosseguir através do processo em cascata mostrado no Esquema 15. A complexação do 1,6-enino 67 com a forma catiônica do catalisador produz o intermediário 70 , no qual a ligação tripla ativada é atacada pela funcionalidade de olefina para produzir ciclopropano substituído 71 . A abertura eletrofílica do anel de três membros forma a espécie catiônica 72 , que sofre uma reação do tipo Friedel-Crafts e, em seguida, rearomatiza para dar o produto tricíclico 69 . Devido à natureza da interação dos complexos de ouro com sistemas insaturados, este processo também pode ser considerado uma cascata eletrofílica.
Um exemplo de cascatas catalisadas por paládio é representado pela ciclização de Heck de polieno assimétrico usado na preparação de (+) - xestoquinona a partir do substrato triflato 75 (Esquema 16). A adição oxidativa da ligação aril-triflato no complexo paládio (0) na presença do ligante difosfina quiral ( S ) -binap produz o complexo quiral de paládio (II) 77 . Esta etapa é seguida pela dissociação do ânion triflato, associação da olefina vizinha e inserção 1,2 do grupo naftil na olefina para produzir o intermediário 79 . Uma segunda inserção migratória no grupo de olefina remanescente seguida por uma eliminação β ocorre então para se obter o produto 81 com um rendimento geral de 82% e com enantiosseletividade moderada. O catalisador de paládio (0) também é regenerado nesta etapa, permitindo assim que a cascata seja reiniciada.
Reações em tandem de várias etapas
As reações em tandem de várias etapas (ou reações em cascata) são uma sequência de transformações químicas (geralmente mais de duas etapas) que acontecem consecutivamente para converter um material de partida em um produto complexo. Este tipo de reações orgânicas são projetadas para construir estruturas difíceis encontradas na síntese total de produtos naturais .
Na síntese total do antibiótico espirocetal ionóforo rotiennocina 1 (Fig. 1), o esqueleto espirocetal central foi construído por uma reação em tandem de várias etapas (Fig. 2). O fragmento A e o fragmento B foram acoplados em uma única etapa para formar o intermediário chave G que poderia ser posteriormente elaborado para fornecer a rotiennocina do produto final.
Quatro transformações químicas aconteceram nesta reação em tandem. Primeiro, tratando o fragmento A com ânion de carbono formado por n-butil-lítio que atacou a parte alquiliodeto do fragmento B para gerar o intermediário C (etapa 1). Em seguida, um derivado D de 3,4-di-hidropirano foi formado através da reação de eliminação mediada por base no intermediário C (etapa 2). O grupo de proteção na porção 1,3-diol no intermediário D foi removido por tratamento com ácido para dar o produto diol E (etapa 3). O produto espirocetal G foi gerado via reação de formação de cetal intramolecular . Essa reação em tandem de várias etapas simplificou muito a construção dessa complexa estrutura espirocetal e facilitou o caminho para a síntese total da rotiennocina.
Referências
links externos
- Nós Químicos na Tabela Periódica de Vídeos (University of Nottingham)










![Esquema 11. Sequência pericíclica para a síntese de [2,2] paraciclofanos](https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Scheme_11_-_peri_-_pcyclophane.svg/681px-Scheme_11_-_peri_-_pcyclophane.svg.png)


![Esquema 14. Ciclagem intramolecular formal catalisada por ouro [4 + 2] de 1,6-eninos](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2b/Scheme_14_-_metal_-_gold_enyne.svg/481px-Scheme_14_-_metal_-_gold_enyne.svg.png)
![Esquema 15. Processo em cascata proposto na cicloadição intramolecular [4 + 2] formal de 1,6-eninos](https://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Scheme_15_-_metal_-_gold_enyne_mech.svg/751px-Scheme_15_-_metal_-_gold_enyne_mech.svg.png)


