Picrotoxina - Picrotoxin
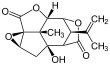
Picrotoxinina (esquerda) e picrotina (direita)
| |||
| Dados clínicos | |||
|---|---|---|---|
| Código ATC | |||
| Identificadores | |||
| Número CAS | |||
| PubChem CID | |||
| IUPHAR / BPS | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| ChEBI | |||
| ChEMBL | |||
| Painel CompTox ( EPA ) | |||
| ECHA InfoCard |
100,004,288 |
||
| Dados químicos e físicos | |||
| Modelo 3D ( JSmol ) | |||
| |||
| |||
|
| |||
A picrotoxina , também conhecida como cocculina , é um composto vegetal cristalino venenoso. Foi isolado pela primeira vez pelo farmacêutico e químico francês Pierre François Guillaume Boullay (1777-1869) em 1812. O nome "picrotoxina" é uma combinação das palavras gregas "picros" (amargo) e "tóxico" (veneno). Uma mistura de dois compostos diferentes, a picrotoxina ocorre naturalmente no fruto da planta Anamirta cocculus , embora também possa ser sintetizada quimicamente.
Devido às suas interações com o neurotransmissor inibitório GABA, a picrotoxina atua como estimulante e convulsivante. Tem impacto principalmente no sistema nervoso central, causando convulsões e paralisia respiratória em doses altas o suficiente.
Estrutura química e síntese
A picrotoxina é uma mistura equi molar de dois compostos, picrotoxinina (C 15 H 16 O 6 ; CAS # 17617-45-7) e picrotina (C 15 H 18 O 7 ; CAS # 21416-53-5). Dos dois compostos, a picrotina é menos ativa.
A picrotoxina ocorre naturalmente no fruto da Anamirta cocculus , uma planta trepadeira originária da Índia e de outras partes do Sudeste Asiático. A planta é conhecida por seus grandes caules de madeira branca e flores com perfume doce. Produz pequenos frutos de caroço, Cocculus indicus , que são tipicamente secos.
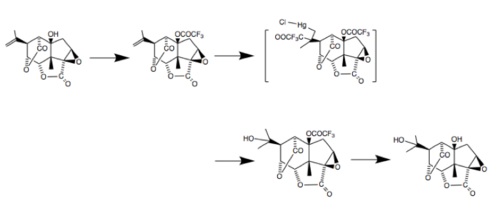
Atualmente, existem até cinco sínteses totais de picrotoxinina - uma das quais foi publicada recentemente em junho de 2020 pelo laboratório Shenvi em Scripps. Essa síntese, como a maioria para essa molécula, envolveu o uso de carvona como molde estereoquímico. A estratégia empregou a rápida formação do núcleo policíclico, seguida da manipulação dos estados de oxidação dos átomos de carbono chave para a produção da molécula alvo. Algumas pesquisas sugerem que isso pode ser feito pela ciclofuncionalização de sistemas cicloalquenila. Sob condições cineticamente controladas, esse processo geralmente resulta em exo ciclização e forma sistemas de anéis em ponte, como os encontrados na picrotoxina. Além disso, várias sínteses têm sido propostas para a picrotoxinina e a picrotina, as duas moléculas que compõem a picrotoxina. Em 1980, foi descoberto um processo para converter a picrotoxinina em picrotina. Esta síntese começa tratando a picrotoxina com anidrido trifluoroacético em piridina para separar os componentes.
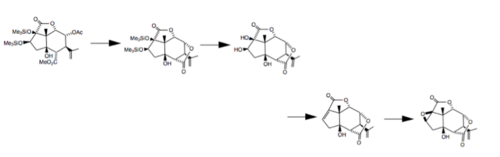
Em 1988, pesquisadores da Universidade Tohoku, no Japão completou uma síntese estéreo total de ambos (-) - picrotoxina e (-) - picrotin início com (+) - 5β-hidroxi carvona . Nesta síntese, oito centros assimétricos foram preparados estereosseletivamente em um sistema de anel de hidrindano cis-fundido usando várias reações diferentes: um rearranjo de Claisen para introduzir o centro quaternário, uma redução mediada por organosselênio de uma epóxi cetona e uma construção estereoespecífica de um éster glicídico . As últimas etapas desse processo são mostradas a seguir.
A picrotoxina também tem sido usada como matéria-prima em vários processos sintéticos, incluindo a criação de dl- picrotoxadieno, que retém certas características do esqueleto da picrotoxina.
Mecanismo de ação
Algumas fibras musculares de crustáceos têm inervação excitatória e inibitória. A picrotoxina bloqueia a inibição. Duas teorias diferentes, mas relacionadas, foram propostas para o mecanismo pelo qual a picrotoxina atua nas sinapses . Uma teoria é que ele atua como um bloqueador de canal não competitivo para os canais de cloreto do receptor GABA A , especificamente o ionóforo de cloreto ativado por ácido gama-aminobutírico. Um estudo de 2006 descobriu que, embora não seja estruturalmente semelhante ao GABA, a picrotoxina impede o fluxo de íons através dos canais de cloreto ativados pelo GABA. Provavelmente atua dentro dos próprios canais iônicos, em vez de nos locais de reconhecimento GABA. Como inibe os canais ativados pelo GABA, os medicamentos que aumentam o GABA, como barbitúricos e benzodiazepínicos, podem ser usados como antídoto.
Outra pesquisa sugere que a toxina atua como um antagonista não competitivo , ou inibidor, para os receptores GABA. Um estudo realizado por Newland e Cull-Candy descobriu que, em concentrações altas o suficiente, a picrotoxina reduziu a amplitude das correntes GABA. Seus dados indicaram que era improvável que a picrotoxina agisse simplesmente como um bloqueador de canal controlado por voltagem, embora tenha reduzido a frequência de aberturas de canal. Em vez disso, eles descobriram que a picrotoxina "se liga preferencialmente a uma forma ligada ao agonista do receptor". Isso significa que, mesmo na presença de baixas concentrações de picrotoxina, a resposta dos neurônios ao GABA é reduzida.
Toxicidade
A picrotoxina atua como um estimulante do sistema nervoso central e respiratório. É extremamente tóxico para peixes e humanos, bem como para roedores e outros mamíferos. De acordo com o Registro de Efeitos Tóxicos de Substâncias Químicas, o LDLo, ou a menor dose letal relatada, é de 0,357 mg / kg. Os sintomas de envenenamento por picrotoxina incluem tosse, dificuldade em respirar, dor de cabeça, tontura, confusão, desconforto gastrointestinal, náusea ou vômito e alterações na frequência cardíaca e pressão arterial. Embora especialmente perigoso se ingerido, os efeitos sistêmicos também podem resultar da inalação ou absorção na corrente sanguínea através de lesões na pele. A picrotoxina também atua como um convulsivo. Em doses maiores, descobriu-se que induz convulsões clônicas ou arritmias cardíacas, com doses especialmente altas que acabam se revelando fatais, tipicamente devido à paralisia respiratória.
Aplicações clínicas e outros usos
Devido à sua toxicidade, a picrotoxina é agora mais comumente usada como uma ferramenta de pesquisa. No entanto, devido ao seu efeito antagonista nos receptores GABA, tem sido utilizado como estimulante do sistema nervoso central. Também foi usado anteriormente como um antídoto para envenenamento por depressores do SNC, especialmente barbitúricos .
Embora não seja comumente usada, a picrotoxina é eficaz como pesticida e pediculicida . No século 19, era usado na preparação de multum duro, que era adicionado à cerveja para torná-la mais intoxicante. Desde então, essa preparação foi proibida.
Apesar de sua toxicidade potencial para mamíferos em doses grandes o suficiente, a picrotoxina também é algumas vezes usada como um intensificador de desempenho em cavalos. É classificado como uma "substância Classe I" ilegal pela American Quarter Horse Association . As substâncias classificadas como “Classe I” provavelmente afetam o desempenho e não têm uso terapêutico na medicina equina. Em 2010, o treinador de um quarto de cavalo, Robert Dimitt, foi suspenso depois que seu cavalo, Stoli Signature, deu positivo para a substância. Tal como acontece com os humanos, é usado para neutralizar o envenenamento por barbitúricos.
Veja também
Referências
Leitura adicional
- Ehrenberger K, Benkoe E, Felix D (1982). "Ação supressiva da picrotoxina, um antagonista do GABA, no nistagmo labiríntico espontâneo e vertigem no homem". Acta Oto-Laryngologica . 93 (1–6): 269–73. doi : 10.3109 / 00016488209130882 . PMID 7064710 .
- Dupont L, Dideberg O, Lamotte-Brasseur J, Angenot L (1976). "Structure cristalline et moléculaire de la picrotoxine, C 15 H 16 O 6 · C 15 H 18 O 7 " . Acta Crystallographica B (em francês). 32 (11): 2987–2993. doi : 10.1107 / S0567740876009424 .
- Olsen RW, DeLorey TM (1999). "GABA Receptor Physiology and Pharmacology" . Em Siegel GJ, Agranoff BW, Albers RW, et al. (eds.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6ª ed.). Filadélfia, PA, EUA: Lippincott-Raven.