Physisorption - Physisorption
A fisiossorção , também chamada de adsorção física , é um processo no qual a estrutura eletrônica do átomo ou molécula quase não é perturbada durante a adsorção .
Visão geral
A força fundamental de interação da fisissorção é a força de Van der Waals . Mesmo que a energia de interação seja muito fraca (~ 10–100 meV), a fisissorção desempenha um papel importante na natureza. Por exemplo, a atração de van der Waals entre as superfícies e os pelos dos pés das lagartixas (veja as cerdas sintéticas ) fornece a notável habilidade de escalar paredes verticais. As forças de Van der Waals se originam das interações entre dipolos elétricos induzidos, permanentes ou transitórios.
Em comparação com a quimissorção , na qual a estrutura eletrônica dos átomos ou moléculas de ligação é alterada e as ligações covalentes ou iônicas se formam, a fisissorção não resulta em alterações na estrutura de ligação química. Na prática, a categorização de uma adsorção particular como fisissorção ou quimissorção depende principalmente da energia de ligação do adsorbato ao substrato, com a fisissorção sendo muito mais fraca em uma base por átomo do que qualquer tipo de conexão envolvendo uma ligação química.
Modelagem por carga de imagem
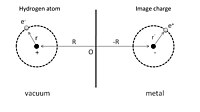
Para dar uma ilustração simples de fisissorção, podemos primeiro considerar um átomo de hidrogênio adsorvido na frente de um condutor perfeito, como mostrado na Fig. 1. Um núcleo com carga positiva está localizado em R = (0, 0, Z ), e o a coordenada de posição de seu elétron, r = ( x , y , z ) é dada em relação ao núcleo. O processo de adsorção pode ser visto como a interação entre este átomo de hidrogênio e suas cargas de imagem do núcleo e do elétron no condutor. Como resultado, a energia eletrostática total é a soma dos termos de atração e repulsão:
O primeiro termo é a interação atrativa do núcleo e sua carga de imagem, e o segundo termo é devido à interação do elétron e sua carga de imagem. A interação repulsiva é mostrada no terceiro e quarto termos decorrentes da interação entre o núcleo e o elétron da imagem, e, a interação entre o elétron e o núcleo da imagem, respectivamente.
Por expansão de Taylor em poderes de | r | / | R |, esta energia de interação pode ser expressa como:
Pode-se descobrir a partir do primeiro termo não-evanescente que o potencial de fisissorção depende da distância Z entre o átomo adsorvido e a superfície como Z- 3 , em contraste com a dependência r -6 do potencial molecular de van der Waals , onde r é a distância entre dois dipolos .
Modelagem por oscilador quântico-mecânico
A energia de ligação de van der Waals pode ser analisada por outra imagem física simples: modelar o movimento de um elétron em torno de seu núcleo por um oscilador harmônico simples tridimensional com uma energia potencial V a :
onde m e e ω são a massa e a frequência vibracional do elétron, respectivamente.
À medida que este átomo se aproxima da superfície de um metal e forma adsorção, esta energia potencial V a será modificada devido às cargas da imagem por termos potenciais adicionais que são quadráticos nos deslocamentos:
- (da expansão de Taylor acima).
Assumindo
o potencial é bem aproximado como
- ,
Onde
Se assumirmos que o elétron está no estado fundamental, a energia de ligação de van der Waals é essencialmente a mudança da energia do ponto zero:
Esta expressão também mostra a natureza da dependência Z- 3 da interação de van der Waals.
Além disso, ao introduzir a polarizabilidade atômica ,
o potencial de van der Waals pode ser ainda mais simplificado:
Onde
é a constante de van der Waals que está relacionada à polarizabilidade atômica.
Além disso, ao expressar a correção de quarta ordem na expansão de Taylor acima como ( aC v Z 0 ) / (Z 4 ), onde a é alguma constante, podemos definir Z 0 como a posição do plano da imagem dinâmica e obter
| Ele | Ne | Ar | Kr | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| C v | Z 0 | C v | Z 0 | C v | Z 0 | C v | Z 0 | C v | Z 0 | |
| Cu | 0,225 | 0,22 | 0,452 | 0,21 | 1.501 | 0,26 | 2,11 | 0,27 | 3.085 | 0,29 |
| Ag | 0,249 | 0,2 | 0,502 | 0,19 | 1.623 | 0,24 | 2.263 | 0,25 | 3.277 | 0,27 |
| Au | 0,274 | 0,16 | 0,554 | 0,15 | 1.768 | 0,19 | 2.455 | 0,2 | 3,533 | 0,22 |
A origem de Z 0 vem do derramamento da função de onda do elétron para fora da superfície. Como resultado, a posição do plano da imagem que representa a referência para a coordenada de espaço é diferente da própria superfície do substrato e modificada por Z 0 .
A Tabela 1 mostra o cálculo do modelo de jélio para a constante de van der Waals C v e o plano de imagem dinâmica Z 0 de átomos de gás raro em várias superfícies de metal. O aumento de C v de He para Xe para todos os substratos de metal é causado pela maior polarizabilidade atômica dos átomos de gás raro mais pesados. Para a posição do plano da imagem dinâmica, ele diminui com o aumento da função dielétrica e é normalmente da ordem de 0,2 Å.
Potencial de fisissorção
Embora a interação de van der Waals seja atraente, à medida que o átomo adsorvido se aproxima da superfície, a função de onda do elétron começa a se sobrepor à dos átomos da superfície. Além disso, a energia do sistema aumentará devido à ortogonalidade das funções de onda do átomo que se aproxima e dos átomos da superfície.
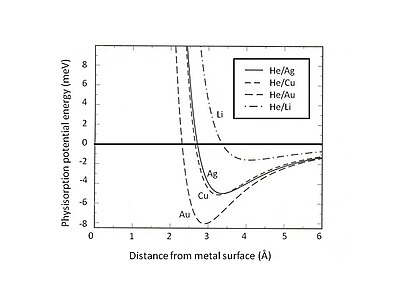
Essa exclusão e repulsão de Pauli são particularmente fortes para átomos com cascas de valência fechadas que dominam a interação da superfície. Como resultado, a energia mínima de fisissorção deve ser encontrada pelo equilíbrio entre a atração de van der Waals de longo alcance e a repulsão de Pauli de curto alcance . Por exemplo, separando a interação total de fisissorção em duas contribuições - um termo de curto alcance representado pela teoria de Hartree-Fock e uma atração de van der Waals de longo alcance - a posição de equilíbrio da fisissorção para gases raros adsorvidos em substrato de jélio pode ser determinada . A Fig. 2 mostra a energia potencial de fisissorção de He adsorvido em substratos de Ag, Cu e Au, que são descritos pelo modelo de jélio com diferentes densidades de cargas positivas de fundo de mancha. Pode-se descobrir que a interação de van der Waals fraca leva a poços de energia atrativa rasos (<10 meV). Um dos métodos experimentais para explorar a energia potencial de fisissorção é o processo de espalhamento, por exemplo, átomos de gases inertes espalhados de superfícies metálicas. Certas características específicas do potencial de interação entre átomos espalhados e superfície podem ser extraídas através da análise da distribuição angular determinada experimentalmente e seções transversais das partículas espalhadas.
Quantum Mechanical - Modelagem termodinâmica para área de superfície e porosidade
Desde 1980, duas teorias foram trabalhadas para explicar a adsorção e obter equações que funcionassem. Essas duas são chamadas de hipótese chi, derivação da mecânica quântica e Excesso de trabalho superficial, ESW. Ambas as teorias produzem a mesma equação para superfícies planas:
Onde U é a função de etapa da unidade. As definições dos outros símbolos são as seguintes:
onde "anúncios" significa "adsorvido", "m" significa "equivalência de monocamada" e "vap" é referência à pressão de vapor ("anúncios" e "vap" são a convenção IUPAC mais recente, mas "m" não tem equivalente IUAPC notação) do adsorvente líquido à mesma temperatura que a amostra sólida. A função de unidade cria a definição da energia molar de adsorção para a primeira molécula adsorvida por:
O gráfico de adsorvido versus é conhecido como gráfico chi. Para superfícies planas, a inclinação do gráfico chi fornece a área da superfície. Empiricamente, esse enredo foi percebido como um ajuste muito bom para a isoterma por Polanyi e também por deBoer e Zwikker, mas não foi seguido. Isso se deveu às críticas, no primeiro caso, de Einstein e, no último, de Brunauer. Esta equação de superfície plana pode ser usada como uma "curva padrão" na tradição normal de curvas de comparação, com a exceção de que a porção inicial da amostra porosa do gráfico de versus atua como um padrão próprio. Condições ultramicroporosas, microporosas e mesoporosas podem ser analisadas usando esta técnica. Os desvios padrão típicos para ajustes isotérmicos completos, incluindo amostras porosas, são normalmente inferiores a 2%.
Um ajuste típico para bons dados em uma superfície homogênea não porosa é mostrado na figura 3. Os dados são de Payne, Sing e Turk e foram usados para criar a curva padrão -s. Ao contrário do BET, que só pode se ajustar, na melhor das hipóteses, na faixa de 0,05 a 0,35 de P / P vap , a faixa de ajuste é a isoterma total.
Comparação com quimissorção
- A fisiossorção é um fenômeno geral e ocorre em qualquer sistema sólido / fluido ou sólido / gás. A quimissorção é caracterizada pela especificidade química.
- Na fisissorção, a perturbação dos estados eletrônicos do adsorvente e do adsorbato é mínima. As forças de adsorção incluem as Forças de Londres, atrações dipolo-dipolo, atração induzida por dipolo e "ligações de hidrogênio". Para a quimissorção, as mudanças nos estados eletrônicos podem ser detectáveis por meios físicos adequados, em outras palavras, ligação química.
- A energia de ligação típica da fisissorção é de cerca de 10–300 meV e não localizada. A quimissorção geralmente forma uma ligação com energia de 1–10 eV e localizada.
- A etapa elementar na fisissorção de uma fase gasosa não envolve uma energia de ativação. A quimissorção freqüentemente envolve uma energia de ativação.
- Para moléculas de fase gasosa de fisissorção, os adsorvidos formam a adsorção em multicamadas, a menos que barreiras físicas, como porosidade, interfiram. Na quimissorção, as moléculas são adsorvidas na superfície por ligações de valência e apenas formam adsorção em monocamada.
- Uma transição direta de fisissorção para quimissorção foi observada anexando uma molécula de CO à ponta de um microscópio de força atômica e medindo sua interação com um único átomo de ferro. Este efeito foi observado no final da década de 1960 a partir de medições de emissão de campo e ESR e relatado por Moyes e Wells.



















