Oncologia Física - Physical oncology
A oncologia física (PO) é definida como o estudo do papel dos sinais mecânicos em um tumor cancerígeno . Os sinais mecânicos podem ser forças, pressões ("puxar", "empurrar" e "cisalhar" designando as forças / pressões que empurram, puxam ou são tangenciais). Se generalizarmos, falaremos de " campo de tensões " e " tensor de tensões ".
Um tumor cancerígeno (ou "tumor sólido" no jargão dos oncologistas para diferenciá-los de malignidades hematológicas) é um órgão constituído por dois tecidos: no centro, o tumor canceroso propriamente dito e em torno da matriz extra - celular (ECM), às vezes chamada de estroma, córion ou tecido conjuntivo. O conceito de tecido conjuntivo é interessante porque define um tecido que viaja por todo o organismo (exceto o cérebro) e é um transmissor preferido de sinais mecânicos. Mas para o órgão canceroso - isolado deste sistema conectivo - preferimos o termo ECM.
O tecido canceroso é derivado de um tecido normal do corpo: o câncer de mama surge de uma transformação cancerosa do tecido glandular mamário normal. Parece mais ou menos com o tecido original: diz-se que é mais ou menos diferenciado; pouco diferenciado tem uma aparência microscópica que está longe do tecido normal e é então de "mau prognóstico", fará mais metástases e será mais difícil de tratar.
Estamos considerando apenas os cânceres derivados de "epitélios", ou seja, o tecido que recobre os órgãos em suas interfaces com o ar, os líquidos ... ou o mundo exterior. As células epiteliais são contíguas e polarizadas. Mais de 90% dos cânceres (mama, próstata, cólon / reto, brônquios, pâncreas, etc.) surgem desses epitélios após um longo processo de cancerização.
Ambos os tecidos do órgão canceroso
O ECM
A ECM é uma mistura de células (imunes, fibroblastos , etc.) dispersas em proteínas, a maioria delas colágeno . Ele envolve o tumor.
É análogo ao tecido conjuntivo e à membrana basal , que é uma condensação local, localizada abaixo do epitélio normal. Esse tecido conjuntivo permite que o oxigênio e os nutrientes se difundam para os epitélios, que não são vascularizados.
Na ECM tumoral, rapidamente, além de um mm3 de tumor, é formada uma rede de vasos sanguíneos, a "neovascularização" (induzida pela " neoangiogênese ") ao redor do tumor e que permitirá a difusão de oxigênio e nutrientes no próprio tecido canceroso, que não é vascularizado.
O tecido canceroso
O próprio tecido canceroso, derivado da transformação cancerosa de um epitélio.
Cancerização
É um processo de vários anos. O aparecimento do câncer é representado pelo cruzamento da membrana basal com o tecido conjuntivo subjacente por uma ou mais células cancerosas.
A redescoberta da importância dos sinais mecânicos na biologia dos organismos vivos
Diversas equipes, principalmente nos Estados Unidos, mantiveram expertise no estudo de sinais não biológicos em oncologia (Donald Ingber, Mina Bissell depois Valerie Weaver, Rakesh J Jain entre outros).
Mas o domínio absoluto da genética e da biologia molecular desde meados do século XX marginalizou essa abordagem até seu renascimento no início do século XXI. Essa renovação leva em conta os imensos ganhos da genética e da biologia molecular na abordagem mecanobiológica. Por outro lado, o PO valida os resultados graças a essas conquistas, mas não usa os conceitos.
Para localizar adequadamente o PO e os sinais mecânicos
Comparação biologia / mecânica
| Sinal de entrada | Sinal de saída | |
| Biologia | Biológico | Biológico |
| Mecanobiologia | Mecânico | Biológico |
| Oncologia Física | Mecânico | Mecânico |
Algumas diferenças entre sinais biológicos e físicos
| Apoio, suporte | Transmissão do sinal | Modulação do sinal | Natureza do Sinal | Açao | Reversibilidade no espaço | |
| Biológico | Líquido | Devagar | Difícil | Bioquímica | Devagar | Não |
| Incompressível | Passo a passo | Unidirecional | ||||
| Fisica | Semissólido
(20% do volume da célula) Compressível |
Rápido
Quase instantâneo |
Fácil | Mecânico | Rápido | sim
Bidirecional |
O uso de sinais mecânicos é, portanto, também o suporte da mecanobiologia, cujo objetivo é muito diferente do PO. De fato, como mostra a tabela acima, o estudo da mecanotransdução , que é o suporte da mecanobiologia, usa uma "entrada" mecânica (entrada do sinal), mas o sinal coletado na saída (a "saída") é biológico. Como resultado, muitos dos artigos publicados na mecanobiologia terminam com a frase "definimos um alvo para encontrar uma molécula terapêutica", o que impede qualquer abordagem terapêutica pelos próprios sinais mecânicos.
Mas essa mudança das ciências físicas para as ciências biológicas é problemática, na ausência de qualquer ponte entre essas duas ciências, uma quantitativa, a física baseada na linguagem matemática e a outra qualitativa, baseada nas leis da genética e da biologia molecular.
OP visa estudar o efeito de uma entrada mecânica em uma saída mecânica. Veremos que essa saída pode ser sintetizada na arquitetura do tecido.
Definição do fenótipo do tecido
O diagnóstico do câncer é feito observando-se ao microscópio um fragmento do tumor (biópsia). O fenótipo do tecido - aqui tecido canceroso - é a soma do fenótipo celular e do tecido. O fenótipo da célula é suposto ser a tradução do genótipo (e do ambiente: epigenética) expresso em uma determinada célula: assim, uma célula do fígado não se parece de forma alguma com uma célula do pâncreas porque não expressa os mesmos genes (ainda todos presentes no genoma de todas as células).
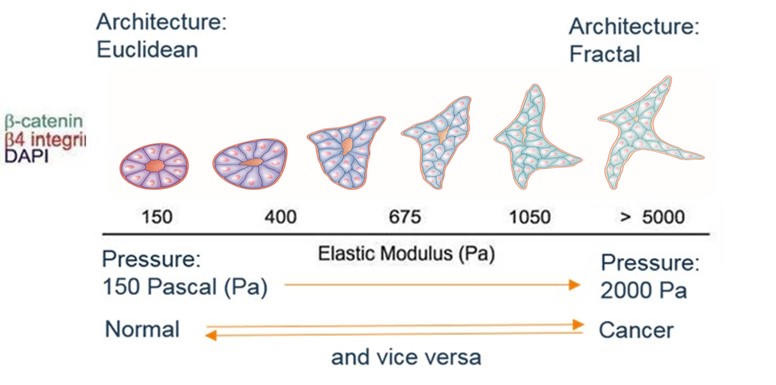
Essas características são resumidas por: diferenciação, divisão celular (mitose), apoptose (ou "suicídio celular") e morte celular. O médico responsável pelo diagnóstico ao microscópio (o patologista) descreverá a biópsia com base nesses critérios. O fenótipo do tecido é centrado na arquitetura: o tecido normal é euclidiano (hexágonos, trapézios, círculos ...) familiar ao nosso cérebro; o canceroso é fractal, menos familiar. Pode ser resumido em um coeficiente de fractalidade fortemente correlacionado com o prognóstico e os componentes do fenótipo celular. Assim, um alto coeficiente de fractalidade está correlacionado a um tumor pouco diferenciado, com muitas mitoses, pouca apoptose e um mau prognóstico.
E aqui temos que citar Mina Bissell: "na oncologia o fenótipo do tecido é dominante sobre o genótipo celular".
A revolução silenciosa: modelos tridimensionais (3D) e outros modelos (esferóides, xenoenxerto animal ...)
A OP foi possibilitada por mudanças técnicas aparentemente menores que permitiram que os modelos in vitro e, em seguida, in vivo estivessem mais próximos da realidade do tumor cancerígeno no paciente.
Por muito tempo, culturas de células bidimensionais (2D) têm sido usadas em caixas de vidro e depois em caixas de plástico. As células cultivadas assim aderiram ao fundo, em material muito rígido, rigidez medida pelo módulo de Young, muito alta para esses suportes.
Módulo de Young
O módulo de elasticidade de Young é a constante que relaciona a tensão de tração / compressão e o início da deformação de um material elástico isotrópico.
É expresso em Pascal (Pa), unidade de pressão.
Surgiram então as culturas tridimensionais (3D) com células que constituíam esferas multicelulares por divisão e foram circundadas por um meio de cultura do tipo gel no módulo de Young próximo ao dos tecidos vivos e variáveis, por exemplo dependendo da quantidade de colágeno em torno dessas culturas em 3D. Organóides , esferóides são variantes desse tipo de cultura.
Ao mesmo tempo, os modelos animais aí também evoluíram para uma maior semelhança com a realidade clínica. O xenoenxerto de tumor humano é hoje o padrão e o transplante ortotópico - por exemplo, câncer de pâncreas humano no pâncreas de camundongo - é um dos melhores modelos experimentais.
A ligação entre a clínica e o experimento torna-se mais realista uma vez que essas culturas 3D permitem usar o meio de cultura ao redor do tecido tumoral em crescimento como uma "MEC virtual", que pode ser variada, por exemplo, para aumentar a pressão ao redor do tumor crescido.
Da mesma forma, o xenoenxerto pode constituir um órgão canceroso com ambos os tecidos, mesmo se a ECM for de origem animal.
O que é difícil no câncer
É o ECM. Então, quando um médico ou paciente sente "um caroço duro na mama" e é um câncer, o que é difícil é a ECM enquanto o próprio tumor é mais macio que o tecido mamário normal. Isso foi demonstrado in vitro e, mais recentemente, ex vivo, e em breve será in vivo.
Em vitro
O papel do estresse no crescimento de um esferóide in vitro já havia sido demonstrado (G Helminger já citado), mas o experimento de Matthew Paszek (último signatário do artigo: Valerie Weaver) em 2005 dará uma nova dimensão a este uso de sinais mecânicos in vitro, mostrando a passagem de uma arquitetura normal de um ácino mamário - a unidade elementar da glândula mamária - para uma arquitetura cancerosa sob a influência de uma única variável, mecânica, aqui a tensão superficial causada por uma concentração crescente de colágeno no meio de cultura em torno do tumor.
Vemos claramente a transição de uma arquitetura para outra, progressiva e reversível se a restrição for relaxada. Mudanças na concentração de marcadores biológicos de cancerização (cateninas , integrinas , etc.), com o desaparecimento da cavidade central, destacam a mudança no fenótipo do tecido.
Além disso, esse experimento abre caminho para a reversibilidade do câncer, a forma real de tratamento, que se destina a substituir as abordagens destrutivas convencionais.
Outra experiência é igualmente espetacular:
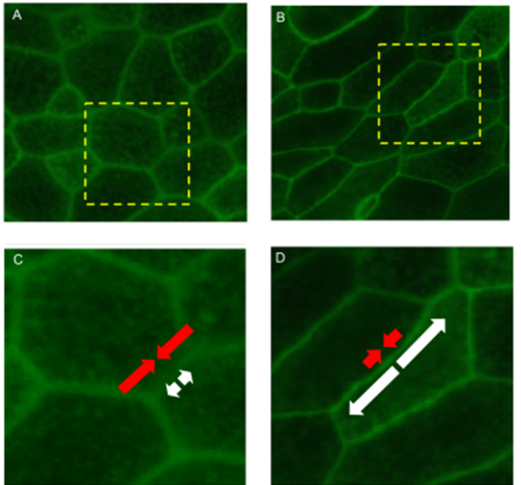
De acordo com Gautham Venugopalan ASCB 2012
Células malignas da mama cultivadas in vitro em 3D formam uma massa "desorganizada" (traduzir fractal) à esquerda na foto.
Mas depois de alguns minutos de compressão, eles formam um ácino, euclidiano, à direita.
Outros autores ampliaram este trabalho em diferentes modelos com diferentes sinais mecânicos. F Montel et al., Em particular, demonstraram em esferóides de origem cancerosa humana o aumento muito significativo da apoptose na resposta ao estresse.
Essas culturas 3D também mostraram a organização das fibras de colágeno dentro da ECM e além, permitindo a transmissão remota de sinais mecânicos e um 'diálogo tensor' entre o tumor, a ECM e o ambiente normal.
Mas esses experimentos têm em comum a aplicação de variáveis físicas (tensão superficial, pressão osmótica ...) que não podem ser usadas in vivo.
Ex vivo
M. Plodinec et al. estendeu este trabalho usando biópsias de câncer de mama mantidas vivas ex vivo e depois passou para um microscópio de força atômica (AFM) para medir os módulos de Young dos diferentes componentes do tecido dessas biópsias de mama normais, tumores benignos e malignos.
Esta equipe encontra os resultados já amplamente explorados em células isoladas e culturas 2D: os tecidos cancerosos têm um módulo de Young em torno de 0,8 kPa, os tecidos normais têm um módulo em torno de 1,1 kPa. O ECM possui um módulo maior que 2 kPa.
Essa diferença - o tecido canceroso é mais macio do que seu equivalente normal - atravessa toda a oncologia, todos os cânceres combinados e desde a célula displásica até o tumor e as células metastáticas.
Todas as medidas, células e tecidos, convergem para a mesma conclusão: o módulo do tecido canceroso está inversamente correlacionado com a 'periculosidade' do câncer: quanto mais macio o tumor, mais indiferenciado, mais dará metástases, o menos responderá aos tratamentos atuais ...
Na Vivo
Na OP para fins terapêuticos, encontramos apenas o artigo de R Brossel et al. (2016) que mostra a possibilidade de atuar sobre um tumor enxertado por via subcutânea em roedor por meio da aplicação de uma restrição.
Está validado nesta Prova de Conceito. Existe uma diferença significativa entre o grupo tratado e os grupos de controle. Esta diferença diz respeito ao volume do tumor medido in vivo que é significativamente diminuído (p = 0,015) no grupo tratado em comparação com os 3 grupos de controle (com partículas e sem gradiente, com gradiente e sem partículas, sem gradiente ou partículas). Também há diferença significativa a favor do grupo tratado na mensuração da superfície do tumor vivo, ex vivo, em cortes histológicos digitalizados (p = 0,001).
Resultados
| Grupos de camundongos enxertados | Volume médio do tumor (mm 3 ) | p (significado da diferença) |
| Grupos tratados | 529 | p = 0,015 |
| Grupos de controle * | 1 334 | |
|
Quer dizer
(mm 2 ) |
Área do tumor em cortes histológicos digitalizados ex vivo | |
| Grupo Tratado | 7,7 | p = 0,001 |
| Grupos de controle * | 23,1; 21,4; 26,8 |
* Três grupos de ratos: apenas com partículas; com gradiente sozinho; sem partículas ou gradiente
Este campo imposto à MEC se sobrepõe àquele já presente no tecido tumoral. Observe a diferença com o in vitro: não há confinamento pela ECM in vitro ou ancoragem pelas integrinas que garantem a continuidade física entre a ECM e o tecido tumoral e, assim, permitem a propagação à distância dos sinais mecânicos.
Nessa perspectiva, o "campo do estresse" passa a ser o agente terapêutico.
Esse estresse é exercido por meio de nanopartículas férricas, portanto magnetizáveis, localizadas ao redor do tumor (e não no tumor) e submetidas de fora do animal a um gradiente de campo magnético gerado por ímãs fixos. As nanopartículas atuam então como '' BioActuadores ', transformando parte da energia magnética em energia mecânica.
A este trabalho podemos associar o projeto europeu "Imaging Force of Cancer" que como o próprio nome indica visa medir, voxel por voxel, os constrangimentos envolvidos no tecido tumoral. Este programa enfoca a mama, o fígado primitivo e o cérebro.
Este projeto é baseado na elastografia por ressonância magnética, que é o método de referência para medição in vivo, in situ e não perturbativa da deformação, ou seja, a deformação elástica muito pequena causada no tecido dará acesso à medida de "tensão "isto é, da restrição. Deve, portanto, possibilitar a construção do tensor de estresse do tecido tumoral in vivo, in situ, sem perturbações intratumorais significativas, base de partida obrigatória para a esperança de modificá-lo.
Existe também um experimento in vivo que demonstra o aumento dos sinais vindos das integrinas, induzido pelo aumento da rigidez da matriz.
A célula isolada
Micropadrões
A padronização celular permitiu mostrar a dependência da arquitetura celular das tensões geradas pelo suporte, variável de acordo com a rigidez desses suportes. Isso possibilitou a hipótese de transmissão de sinais mecânicos entre o "exterior", aqui o suporte (vidro, plástico e depois gel), e o CytoSKeleton (CSK) e o núcleo.
O equilíbrio, na CSK de cada célula, é entre microfilamentos contráteis e microtúbulos resistentes à compressão; também é feito nos membros da ECM por um jogo de pressão e tensão que se cancelam em uma situação de equilíbrio. A energia é fornecida pela actina.
A micropadronização mostrou claramente esses fenômenos na escala de uma célula fixada em um suporte.
Aumento da rigidez da MEC: a propagação da célula - no suporte, representação da MEC - é necessária para a divisão celular (daí o crescimento).
Diminuição da rigidez da MEC: quando a MEC está deformada, a tração celular provoca a parada do crescimento e uma diferenciação da célula ou uma apoptose.
O material macio que transmite os sinais mecânicos é, portanto, pré-tensionado e isso permite a transmissão de forças no corpo com uma distribuição quantitativa de acordo com a escala: o esqueleto, uma estrutura macroscópica, transmitirá forças muito maiores do que um órgão isolado.
Na escala de um tecido de um órgão, toda a rede de transmissão de sinais mecânicos, incluindo integrinas, caderinas, aderências focais (todas as junções intercelulares e ETM / células), membrana, CSK, etc. também suportam a produção de energia. Na verdade, as mitocôndrias são parte integrante desta rede e a bioquímica da fase semissólida (não líquida) é uma parte importante do metabolismo do tecido.
Aqui encontramos um princípio de tratamento pelos sinais mecânicos.
A célula circulante
As células tumorais circulantes (CTCs) são isoláveis e sua rigidez pode ser medida facilmente. Numerosos artigos puderam verificar o que já era conhecido para células em cultura 2D: o módulo de Young da CTC está fortemente correlacionado com a gravidade do câncer em todos os seus parâmetros: diferenciação, potencial metastático, correlação prognóstica e preditiva ...
E essas correlações são válidas para células metaplásicas, displásicas, in situ e cancerosas.
A jornada da célula metastática
Essas CTCs devem primeiro cruzar a ECM, entrar na corrente sanguínea ou nos vasos linfáticos e, em seguida, deixar a circulação para se anexar a um tecido para metástase. Muitos artigos comentaram recentemente sobre esta "jornada" e os muitos elementos físicos que a pontuam.
Os diferentes componentes da restrição
O tumor acumula energia mecânica durante seu crescimento. Em um artigo de Stylianopoulos, o autor usa uma técnica simples para destacar as restrições do tumor: um corte a laser ex vivo do tumor libera as restrições acumuladas. Eles são expressos como protuberâncias que podem ser medidas e relacionadas ao estresse subjacente. No centro do tumor, as tensões radial e circunferencial são compressivas; na periferia do tumor, o estresse radial é compressivo e o estresse circunferencial é uma tração linear ao longo do limite externo do tumor.
O crescimento do tumor causa estresse nos tecidos saudáveis ao seu redor.
A matriz extra-celular (ECM) e as células em contato com a ECM exercem tensões mútuas.
As células do tecido tumoral exercem tensões entre si.
Isso resulta em uma mudança no fluxo de fluido no tumor com um aumento na pressão intersticial intratumoral.
A tensão interna presente no tumor excisado pode ser chamada de "tensão residual": ao cortá-la, vemos claramente uma expansão do volume que mostra essa tensão residual.
Outra faixa foi inaugurada por J Fredberg, em duas dimensões:
À medida que o estresse de adesão intercelular aumenta, há uma mudança na arquitetura histológica e uma transição de fase sólida para líquida.
A energia mecânica, coesão celular do tecido tumoral, é atribuível, em grande parte, às junções intercelulares e pode ser expressa na tração linear que possui dois componentes:
- Energia de contração em vermelho, positiva, que vem do CSK e que minimiza a superfície intercelular (euclidiana, pseudo-sólida quando domina);
- Energia de adesão, em branco, negativa e que maximiza a superfície (fractal, pseudo líquido quando domina).
Matéria mole
Popularizado por Pierre Gilles de Gennes, o termo matéria mole se refere ao estudo de materiais entre sólidos e líquidos; à temperatura ambiente, a da biologia, a energia térmica (kT) é da mesma ordem de magnitude que as energias de interação entre os vários componentes. Devido a esse equilíbrio de entropia / entalpia, esses sistemas biológicos podem ser organizados de uma maneira radicalmente diferente sob a influência de pequenas variações externas.
A física de PO é uma física da matéria mole.
O tensor de estresse
Esta é a generalização do conceito de campo de restrição. Resume em uma expressão matemática todas as pressões envolvidas em um volume. Aqui, é o volume do tumor com esfera sólida, o tecido tumoral, predominantemente viscoelástico e uma esfera oca, a ECM, predominantemente elástica. A esfera sólida está embutida na esfera oca.
Organização de CSK e continuidade de estruturas transmitindo sinais mecânicos
Os sinais mecânicos viajam pelos órgãos, sem nenhuma quebra de continuidade. No nível do tecido, é o tecido conjuntivo ou ECM que garante essa continuidade. No nível celular, é a continuidade entre o tecido conjuntivo, a membrana celular, o CSK e o núcleo que garante essa transmissão.
Em que escala? As leis da biologia / física
Uma abordagem até então dominante é a "de baixo para cima": a compreensão dos mecanismos biológicos (mecanorreceptores, actina e outros componentes de CSK, sinalização intracelular, efetores de genes, etc.) deve levar a uma compreensão dos fenômenos em escala, acima estar aqui mesoscópico, tecido.
Existem histórias de sucesso dessa abordagem quando se pode identificar um gene defeituoso com uma mutação e é possível agir por uma droga no resultado da mutação: um receptor ou uma enzima.
Essa "equação um para um e de primeiro grau" permitiu que a leucemia mieloide crônica fosse controlada pelo imatinibe. O gene BCR-ABL defeituoso torna possível a fabricação de uma versão anormal de uma enzima do tipo Tirosina Quinase presente nas células leucêmicas. O imatinibe inibe essa enzima e a fabricação dessas células.
Essas poucas exceções levaram a crer que esse raciocínio poderia ser aplicado ao câncer como um todo.
Mas a "equação" do câncer é muito mais complexa. E o grande fracasso das "terapias direcionadas" para curar o câncer é a ilustração. Essas terapias direcionadas curaram apenas 50% dos cânceres de mama HER2 positivos tratados com terapia adjuvante após o tratamento local do câncer. Isso é 3% dos cânceres de mama. Isso é tudo. Além disso, sua participação na "cronicidade" da mama e da próstata - mesmo de algum cólon ou reto - é muito menor se comparada à quimio / hormonoterapia, muito mais bem utilizada hoje.
A outra abordagem, "de cima para baixo", leva em consideração o surgimento de fenômenos imprevisíveis por meio da abordagem reducionista. Assim, a evidência experimental que mostra que a carcinogênese é um processo destinado a emergir uma geometria de quebra da arquitetura do tecido requer abandonar o nível genético ou acima da genética para entrar na biologia de sistemas e colocar a matéria no nível de célula / tecido.
Na verdade, os fenótipos celulares são fenômenos emergentes que resultam de interações não lineares intercelulares e da interação com o ambiente, ou seja, a MEC. Isso geralmente é descrito em um espaço de fase onde atratores pontilham a paisagem e são pontos de estabilidade ou instabilidade.
Fractalidade
O câncer é fractal e isso em todos os seus componentes e em diferentes escalas micro / meso e macroscópica.
Essa geometria é recente e ainda pouco integrada em nossas representações mentais.
A primeira observação foi a natureza fractal das microcalcificações ligadas ao câncer de mama em uma mamografia.
Então, a fractalidade do câncer foi demonstrada em diferentes estruturas do câncer de órgão - neoangiogênese, zona de crescimento tumoral, tecido tumoral ... - e em escala microscópica: núcleo celular, superfície celular.
Sinergia
Uma sinergia entre a imunoterapia e o uso de sinais mecânicos é altamente provável, conforme mostrado por dois artigos recentes que descrevem o controle da expressão de PDL-1 e células imunocompetentes pela rigidez da matriz extracelular.
Termodinâmica
Fractalidade é um meio que a evolução encontrou para minimizar a energia usada para distribuir recursos. Lembre-se de que o câncer usa uma fonte de energia diferente de outros tecidos, menos eficiente em rendimento.
A morte do paciente
Do que está morrendo um paciente com câncer?
As possibilidades são várias: as complicações infecciosas relacionadas à imunodepressão devido à doença e aos tratamentos, o ataque de um órgão vital como o pulmão invadido por tantas metástases que a respiração fica impossível, as complicações trombóticas como uma embolia pulmonar, um fim de vida precipitada por tratamentos analgésicos cujas doses são aumentadas. Mas por trás de todas essas causas está o desvio de energia pelo câncer, que se comporta como um parasita que mata seu hospedeiro. Em alguns tipos de câncer particularmente locais, como o câncer de pâncreas, isso é particularmente perceptível: o paciente morre de caquexia, ou seja, de grande desnutrição.
Os grandes ancestrais e a poeira sob o tapete
As brilhantes intuições de D'Arcy Thompson são agora aceitas por todos: a forma que os órgãos (incluindo o câncer) e os organismos assumem depende das variações no tempo e no espaço das propriedades mecânicas dos tecidos. Mas ele descreve, sem fazer suposições sobre por que e como.
J Wolff descreveu as variações histológicas do osso de acordo com a carga que pesa sobre ele.
Isso é bem conhecido dos cirurgiões torácicos: uma veia retirada para contornar uma artéria coronária e enxertada na posição da artéria muda a histologia e se torna uma artéria devido a esse novo regime de pressão.
A mesma conclusão pode ser tirada de estudos sobre a transformação do tecido ósseo e cartilaginoso sob diferentes regimes de pressão.
Desde a década de 1950, o paradigma genético surgiu. Os cânceres surgem de uma (ou algumas) células mutadas e a progressão resulta do acúmulo sequencial de mutações aleatórias sem tumor de todos os controles homeostáticos.
A descoberta de oncogenes, genes supressores, genes de estabilidade (zelador) é um conjunto coerente e confiável para rastrear o nascimento e a progressão do câncer.
Mas não faltam os fatos experimentais contraditórios: os carcinógenos não são todos mutagênicos (hormônios ...); o alvo dos carcinógenos pode ser a ECM e não a célula; uma MEC exposta a um carcinógeno posto em contato com um tecido não canceroso causará o câncer desse tecido, mas não vice-versa; um tecido canceroso em contato próximo com uma ECM normal pode se tornar tecido normal novamente.
Outros autores mostraram que é possível devolver a uma arquitetura normal um tecido canceroso quando ele foi levado por um ambiente embrionário e depois por tecido somático.
Esses últimos exemplos pleiteiam a realidade da possível reversão do canceroso para o não canceroso.
Finalmente, mais cânceres são devidos a "causas" infecciosas do que a "causas" genéticas.
Esses últimos exemplos pleiteiam a realidade da possível reversão do canceroso para o não canceroso.
Rumo a uma abordagem global do câncer
Qualquer teoria da carcinogênese deve explicar a cancerização desde o seu aparecimento, displasia, in situ, passando então pela membrana basal, o crescimento do tumor primário e o aparecimento de metástases.
Citemos DW Smithers (1962): "o câncer não é uma doença das células mais do que o engarrafamento é uma doença dos carros".
Vemos, portanto, uma abordagem global levando em consideração os sinais mecânicos e biológicos nesse longo processo que vai da displasia às metástases.
Este novo ramo da biologia tem consequências além da oncologia, na embriologia, engenharia de tecidos, etc.
É hora de a Oncologia Física se tornar visível. Visível porque agora integrável a uma imagem que pode medir sinais mecânicos e visível no campo científico como um componente completo da carcinogênese.
Referências
Anexos
Artigos relacionados
links externos
- Estados Unidos: National Cancer Institute (NCI) [arquivo]
- Singapura: Instituto de Mecanobiologia (MBI) [arquivo] - Universidade Nacional de Singapura
- Europa: Imaging the Force of Cancer [arquivo] , H2020
- Jornal: Convergent Science Physical Oncology [arquivo]