pGLO - pGLO
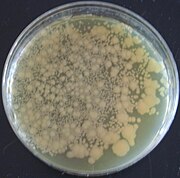
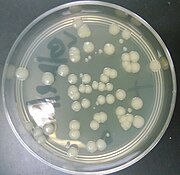
O plasmídeo pGLO é um plasmídeo projetado usado em biotecnologia como um vetor para a criação de organismos geneticamente modificados . O plasmídeo contém vários genes repórter , mais notavelmente a proteína fluorescente verde (GFP) e o gene de resistência à ampicilina. A GFP foi isolada da água-viva Aequorea victoria . Por compartilhar um promotor bidirecional com um gene para metabolizar a arabinose , o gene GFP é expresso na presença de arabinose, o que faz com que o organismo transgênico expresse sua fluorescência sob luz ultravioleta . A GFP pode ser induzida em bactérias contendo o plasmídeo pGLO, cultivando-as em placas de + arabinose. O pGLO é fabricado pela Bio-Rad Laboratories .
Estrutura
O pGLO é composto por três genes que são unidos por meio de tecnologia de DNA recombinante. Eles são os seguintes:
- Bla, que codifica a enzima beta-lactamase que confere resistência à bactéria transformada à família beta-lactama de antibióticos (como da família da penicilina )
- araC, uma região promotora que regula a expressão de GFP (especificamente, o gene GFP será expresso apenas na presença de arabinose )
- GFP, a proteína verde fluorescente, que dá um brilho verde se as células produzem este tipo de proteína
Como a maioria dos outros plasmídeos circulares, o plasmídeo pGLO contém uma origem de replicação (ori), que é uma região do plasmídeo onde a replicação terá origem. O plasmídeo pGLO ficou famoso por pesquisadores na França que o usaram para produzir um coelho verde fluorescente chamado Alba .
Outras características do pGLO, como a maioria dos outros plasmídeos, incluem um marcador selecionável e um MCS ( sítio de clonagem múltipla ) localizado no final do gene GFP. O plasmídeo tem 5371 pares de bases de comprimento. Na forma superenrolada , ele é executado em um gel de agarose na faixa de 4200–4500.
Descoberta de GFP
O gene GFP foi observado pela primeira vez por Osamu Shimomura e sua equipe em 1962, enquanto estudava a água-viva Aequorea victoria, que tem um anel de luz azul sob seu guarda-chuva . Shimomura e sua equipe isolaram a proteína aequorin de milhares de águas-vivas até que reuniram o suficiente para uma análise completa da proteína. Foi através do estudo da aequorina que Shimomura descobriu pequenas quantidades de GFP que brilha em verde quando a aequorina emite luz azul. Depois de descobrir com sucesso como o GFP funciona com aequorina na água-viva, ele o separou para estudar a bioluminescência em outros organismos.
Em 1994, Marty Chalfie e sua equipe foram capazes de criar bactérias e vermes redondos que expressam a proteína GFP. Logo depois, Roger Tsien e sua equipe foram capazes de criar GFP mutante que pode emitir uma gama de cores, não apenas o verde.
Os três cientistas receberam o Prêmio Nobel de Química de 2008 pela descoberta e desenvolvimento da proteína fluorescente verde, GFP.