Potencial da placa final - End-plate potential

Os potenciais da placa terminal ( PPE ) são as tensões que causam a despolarização das fibras do músculo esquelético causada pela ligação dos neurotransmissores à membrana pós-sináptica na junção neuromuscular . Eles são chamados de "placas terminais" porque os terminais pós-sinápticos das fibras musculares têm uma grande aparência de disco. Quando um potencial de ação atinge o terminal axônio de um neurônio motor , vesículas que carregam neurotransmissores (principalmente acetilcolina ) são exocitadas e o conteúdo é liberado na junção neuromuscular. Esses neurotransmissores se ligam a receptores na membrana pós-sináptica e levam à sua despolarização. Na ausência de um potencial de ação, as vesículas de acetilcolina vazam espontaneamente para a junção neuromuscular e causam despolarizações muito pequenas na membrana pós-sináptica. Esta pequena resposta (~ 0,4mV) é chamada de potencial de placa terminal em miniatura (MEPP) e é gerada por uma vesícula contendo acetilcolina. Representa a menor despolarização possível que pode ser induzida em um músculo.
Junção neuromuscular
A junção neuromuscular é a sinapse que se forma entre um neurônio motor alfa (α-MN) e a fibra muscular esquelética. Para que um músculo se contraia, um potencial de ação é primeiro propagado por um nervo até atingir o terminal do axônio do neurônio motor. O neurônio motor então inerva as fibras musculares para a contração, causando um potencial de ação na membrana pós-sináptica da junção neuromuscular.
Acetilcolina
Os potenciais da placa terminal são produzidos quase inteiramente pelo neurotransmissor acetilcolina no músculo esquelético. A acetilcolina é o segundo neurotransmissor excitatório mais importante do corpo, depois do glutamato . Ele controla o sistema somatossensorial, que inclui os sentidos do tato, visão e audição. Foi o primeiro neurotransmissor a ser identificado em 1914 por Henry Dale . A acetilcolina é sintetizada no citoplasma do neurônio a partir da colina e da acetil-CoA . A colina aciltransferase é a enzima que sintetiza a acetilcolina e é freqüentemente usada como um marcador em pesquisas relacionadas à produção de acetilcolina. Os neurônios que utilizam acetilcolina são chamados de neurônios colinérgicos e são muito importantes na contração muscular, memória e aprendizagem.
Canais Ion
A polarização das membranas é controlada pelos canais iônicos de sódio , potássio , cálcio e cloreto . Existem dois tipos de canais iónicos envolvidos na junção neuromuscular e potenciais de placa final: canal de iões dependentes da voltagem e do canal iónico ligando-fechado . Os canais de íons dependentes de voltagem respondem a mudanças na voltagem da membrana, que fazem com que o canal de íons com controle de voltagem se abra e permita a passagem de certos íons. Os canais iônicos controlados por ligantes respondem a certas moléculas, como os neurotransmissores. A ligação de um ligante ao receptor na proteína do canal iônico causa uma mudança conformacional que permite a passagem de certos íons.
Membrana pré-sináptica
Normalmente, o potencial de membrana em repouso de um neurônio motor é mantido em -70mV a -50 com uma concentração mais alta de sódio no exterior e uma concentração mais elevada de potássio no interior. Quando um potencial de ação se propaga ao longo de um nervo e atinge o terminal do axônio do neurônio motor, a mudança na voltagem da membrana faz com que os canais iônicos bloqueados pela voltagem do cálcio se abram, permitindo um influxo de íons de cálcio. Esses íons de cálcio fazem com que as vesículas de acetilcolina ligadas à membrana pré-sináptica liberem acetilcolina por exocitose na fenda sináptica.
Membrana pós-sináptica
A PPE é causada principalmente pela ligação da acetilcolina aos receptores na membrana pós-sináptica. Existem dois tipos diferentes de receptores de acetilcolina: nicotínicos e muscarínicos. Os receptores nicotínicos são canais iônicos controlados por ligante para transmissão rápida. Todos os receptores de acetilcolina na junção neuromuscular são nicotínicos. Os receptores muscarínicos são receptores acoplados à proteína G que usam um segundo mensageiro. Esses receptores são lentos e, portanto, incapazes de medir um potencial de placa terminal em miniatura (MEPP). Eles estão localizados no sistema nervoso parassimpático , como no nervo vago e no trato gastrointestinal . Durante o desenvolvimento fetal, os receptores de acetilcolina estão concentrados na membrana pós-sináptica e toda a superfície do terminal nervoso no embrião em crescimento é coberta antes mesmo de um sinal ser disparado. Cinco subunidades consistindo em quatro proteínas diferentes de quatro genes diferentes compreendem os receptores nicotínicos de acetilcolina, portanto, seu empacotamento e montagem é um processo muito complicado com muitos fatores diferentes. A enzima quinase muscular específica (MuSK) inicia processos de sinalização na célula muscular pós-sináptica em desenvolvimento. Ele estabiliza os aglomerados de receptores pós-sinápticos de acetilcolina, facilita a transcrição de genes sinápticos pelos núcleos das fibras musculares e dispara a diferenciação do cone de crescimento do axônio para formar um terminal nervoso diferenciado. A laminina do substrato induz a maturação avançada dos aglomerados de receptores de acetilcolina nas superfícies dos miotubos.
Iniciação
Vesículas sinápticas
Todos os neurotransmissores são liberados na fenda sináptica via exocitose das vesículas sinápticas . Existem dois tipos de vesículas neurotransmissoras: grandes vesículas densas e pequenas vesículas claras . Grandes vesículas densas contêm neuropeptídeos e grandes neurotransmissores que são criados no corpo celular do neurônio e depois transportados por meio de transporte axonal rápido até o terminal do axônio. Pequenas vesículas de núcleo claro transportam neurotransmissores de pequenas moléculas que são sintetizados localmente nos terminais pré-sinápticos. As vesículas do neurotransmissor finalizadas são ligadas à membrana pré-sináptica. Quando um potencial de ação se propaga pelo axônio do neurônio motor e chega ao terminal do axônio, ele causa uma despolarização do terminal do axônio e abre os canais de cálcio. Isso causa a liberação dos neurotransmissores por meio da exocitose da vesícula.
Após a exocitose, as vesículas são recicladas durante um processo conhecido como ciclo das vesículas sinápticas. As membranas vesiculares recuperadas são passadas por vários compartimentos intracelulares onde são modificadas para formar novas vesículas sinápticas. Eles são então armazenados em um pool de reserva até que sejam necessários novamente para o transporte e liberação de neurotransmissores.
Ao contrário do pool de reserva, o pool de vesículas sinápticas prontamente liberável está pronto para ser ativado. A depleção da vesícula da piscina prontamente liberável ocorre durante a estimulação de alta frequência de longa duração e o tamanho da PPE evocada reduz. Essa depressão neuromuscular se deve à menor liberação de neurotransmissores durante a estimulação. Para que a depleção não ocorra, deve haver um equilíbrio entre a plenitude e a depleção, que pode ocorrer em frequências de estimulação baixas de menos de 30 Hz.
Quando uma vesícula libera seus neurotransmissores via exocitose, ela esvazia todo o seu conteúdo na fenda sináptica. A liberação de neurotransmissores de vesículas é, portanto, considerada quantal porque apenas um número inteiro de vesículas pode ser liberado. Em 1970, Bernard Katz, da Universidade de Londres, ganhou o Prêmio Nobel de Fisiologia ou Medicina por determinar estatisticamente o tamanho quantal das vesículas de acetilcolina com base na análise de ruído na junção neuromuscular. Usando um livro sobre estatística mecânica, ele foi capaz de inferir o tamanho dos eventos individuais que aconteciam ao mesmo tempo.
As vesículas sinápticas de acetilcolina são vesículas sinápticas de núcleo claro com um diâmetro de 30 nm. Cada vesícula de acetilcolina contém aproximadamente 5.000 moléculas de acetilcolina. As vesículas liberam toda a sua quantidade de acetilcolina e isso faz com que ocorram potenciais de placa terminal em miniatura (MEPPs), que são menores que 1mV de amplitude e não o suficiente para atingir o limiar.
Potenciais de placa terminal em miniatura (MEPPs)
Os potenciais de placa terminal em miniatura são as pequenas despolarizações (~ 0,4 mV) do terminal pós-sináptico causadas pela liberação de uma única vesícula na fenda sináptica. Vesículas neurotransmissoras contendo acetilcolina colidem espontaneamente com o terminal nervoso e liberam acetilcolina na junção neuromuscular, mesmo sem um sinal do axônio. Essas pequenas despolarizações não são suficientes para atingir o limiar e, portanto, não ocorre um potencial de ação na membrana pós-sináptica. Durante a experimentação com MEPPs, notou-se que muitas vezes ocorriam potenciais de ação espontâneos, chamados picos de placa terminal no músculo estriado normal sem qualquer estímulo. Acreditava-se que esses picos da placa terminal ocorriam como resultado de lesão ou irritação das fibras musculares devido aos eletrodos . Experimentos recentes mostraram que esses espinhos da placa terminal são na verdade causados por fusos musculares e têm dois padrões distintos: pequenos e grandes. Os pequenos picos da placa final têm um início negativo sem propagação de sinal e os grandes picos da placa final se assemelham aos potenciais da unidade do motor (MUPs). Os fusos musculares são receptores sensoriais que medem o alongamento ou alongamento muscular e transmitem a informação à medula espinhal ou ao cérebro para a resposta apropriada.
Potencial de limite ("Todos ou Nenhum")
Quando um potencial de ação causa a liberação de muitas vesículas de acetilcolina, a acetilcolina se difunde pela junção neuromuscular e se liga a receptores nicotínicos controlados por ligante (canais catiônicos não seletivos) na fibra muscular. Isso permite o aumento do fluxo de íons sódio e potássio, causando despolarização do sarcolema (membrana da célula muscular). A pequena despolarização associada à liberação de acetilcolina de uma vesícula sináptica individual é chamada de potencial de placa terminal em miniatura (MEPP) e tem uma magnitude de cerca de + 0,4mV. Os MEPPs são aditivos, eventualmente aumentando o potencial de placa final (EPPs) de cerca de -100mV até o potencial limite de -60mV, nível em que os canais iônicos dependentes de voltagem na membrana pós-sináptica se abrem, permitindo um fluxo repentino de íons de sódio de a sinapse e um pico acentuado na despolarização. Este pico de voltagem de despolarização dispara um potencial de ação que se propaga pela membrana pós-sináptica levando à contração muscular. É importante observar que os PPEs não são potenciais de ação, mas desencadeiam potenciais de ação. Em uma contração muscular normal, aproximadamente 100-200 vesículas de acetilcolina são liberadas causando uma despolarização que é 100 vezes maior em magnitude do que um MEPP. Isso faz com que o potencial de membrana despolarize + 40mV (100 x 0,4mV = 40mV) de -100mV a -60mV onde atinge o limite.
Fases do potencial de ação
Uma vez que o potencial de membrana atinge o limiar, ocorre um potencial de ação e causa um aumento acentuado na polaridade da membrana. Existem cinco fases de um potencial de ação: limiar, despolarização, pico, repolarização e hiperpolarização.
Limiar é quando a soma de MEPPs atinge um certo potencial e induz a abertura dos canais iônicos dependentes de voltagem. O rápido influxo de íons de sódio faz com que o potencial de membrana alcance uma carga positiva. Os canais de íons de potássio têm ação mais lenta do que os canais de íons de sódio e, assim, quando o potencial da membrana começa a atingir o pico, os canais de íons de potássio se abrem e causam um fluxo de saída de potássio para neutralizar o influxo de sódio. No pico, o fluxo de saída de potássio é igual ao fluxo de sódio, e a membrana não muda de polaridade.
Durante a repolarização, os canais de sódio começam a se tornar inativados, causando um efluxo líquido de íons de potássio. Isso faz com que o potencial de membrana caia para seu potencial de membrana em repouso de -100mV. A hiperpolarização ocorre porque os canais de potássio de ação lenta demoram mais para desativar, então a membrana ultrapassa o potencial de repouso. Ele retorna gradualmente ao potencial de repouso e está pronto para que outro potencial de ação ocorra.
Durante o potencial de ação antes da fase de hiperpolarização, a membrana não responde a qualquer estimulação. Essa incapacidade de induzir outro potencial de ação é conhecida como período refratário absoluto. Durante o período de hiperpolarização, a membrana responde novamente aos estímulos, mas requer uma entrada muito maior para induzir um potencial de ação. Esta fase é conhecida como período refratário relativo.
Uma vez que o potencial de ação tenha terminado na junção neuromuscular, a acetilcolina usada é eliminada da fenda sináptica pela enzima acetilcolinesterase . Várias doenças e problemas podem ser causados pela incapacidade das enzimas de limpar os neurotransmissores da fenda sináptica, levando à propagação do potencial de ação contínua.
Aplicações clínicas
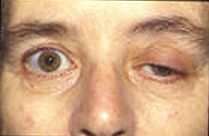
A pesquisa atual está tentando aprender mais sobre os potenciais da placa terminal e seus efeitos na atividade muscular. Muitas doenças atuais envolvem atividade potencial interrompida da placa terminal. Em pacientes com Alzheimer, a beta amilóide se liga aos receptores de acetilcolina e inibe a ligação da acetilcolina. Isso causa menos propagação de sinal e pequenos EPPs que não atingem o limite. Ao analisar os processos cerebrais com acetilcolina, os médicos podem medir a quantidade de beta amilóide existente e usá-la para avaliar seus efeitos no Alzheimer. A miastenia gravis é uma doença autoimune, em que o corpo produz anticorpos direcionados contra o receptor de acetilcolina na membrana pós-sináptica da junção neuromuscular. A fadiga e a fraqueza muscular, agravadas com o uso e melhoradas com o repouso, são a marca registrada da doença. Devido à quantidade limitada de receptores de acetilcolina que estão disponíveis para ligação, o tratamento sintomático consiste no uso de um inibidor de acetilcolinesterase para reduzir a degradação da acetilcolina na junção neuromuscular, de modo que uma quantidade suficiente de acetilcolina esteja presente para o pequeno número de receptores desbloqueados. Uma anormalidade congênita causada por uma deficiência na placa terminal da acetilcolina esterase (AChE) pode ser um mecanismo fisiopatológico para gravis miastênico. Em um estudo com um paciente com deficiência de AChE, os médicos observaram que ele havia desenvolvido fraqueza muscular proximal e troncular severa com tremores em outros músculos. Verificou-se que uma combinação de jitter e taxa de bloqueio dos receptores de acetilcolina causou um potencial de placa terminal reduzido semelhante ao que é visto em casos de miastenia gravis. A pesquisa de potenciais da unidade motora (MUPs) tem levado a possíveis aplicações clínicas na avaliação da progressão de doenças patológicas para origens miogênicas ou neurogênicas por meio da medição da constante de irregularidade relacionada. Os potenciais da unidade motora são os sinais elétricos produzidos por unidades motoras que podem ser caracterizados por amplitude, duração, fase e pico, e o coeficiente de irregularidade (IR) é calculado com base nos números de pico e amplitudes. A síndrome miastênica de Lambert-Eaton é um distúrbio em que os canais de cálcio pré-sinápticos são submetidos à destruição autoimune, o que faz com que menos vesículas de neurotransmissores sejam exocitadas. Isso causa EPPs menores devido à liberação de menos vesículas. Freqüentemente, os EPPs menores não atingem o limiar, o que causa fraqueza muscular e fadiga nos pacientes. Muitos animais usam neurotoxinas para se defender e matar presas. A tetrodotoxina é um veneno encontrado em certos peixes venenosos, como o baiacu e o peixe - porco, que bloqueia os canais de íons de sódio e impede um potencial de ação na membrana pós-sináptica. O tetraetilamônio encontrado em insetos bloqueia os canais de potássio. A neurotoxina alfa encontrada em cobras se liga aos receptores de acetilcolina e evita que a acetilcolina se ligue. A alfa-latrotoxina encontrada em aranhas viúva negra causa um influxo maciço de cálcio no terminal do axônio e leva a um excesso de liberação de neurotransmissor. A toxina botulínica produzida pela bactéria Clostridium botulinum é a proteína tóxica mais poderosa. Impede a liberação de acetilcolina na junção neuromuscular ao inibir a ancoragem das vesículas do neurotransmissor.
Veja também
- Acetilcolina
- Potencial de acção
- Alfa-latrotoxina
- doença de Alzheimer
- Toxina botulínica
- Neurônio motor
- Receptores muscarínicos
- Miastenia grave
- Junção neuromuscular
- Neurotransmissor
- Receptores nicotínicos
- Músculo esquelético
- Vesícula sináptica
- Tetraetilamônio
- Tetrodotoxina