Enolate - Enolate
Enolatos são ânions orgânicos derivados da desprotonação de compostos carbonílicos. Raramente isolados, são amplamente utilizados como reagentes na síntese de compostos orgânicos.
Ligação e estrutura
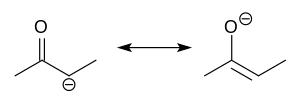
Os ânions enolatos estão eletronicamente relacionados aos ânions alil. A carga aniônica é deslocalizada sobre o oxigênio e os dois sítios de carbono. Assim, eles têm o caráter de um alcóxido e de um carbânion .
Embora sejam frequentemente desenhados como sais simples, na verdade eles adotam estruturas complicadas, muitas vezes apresentando agregados.
Preparação
A desprotonação de cetonas enolizáveis, aldeídos e ésteres dá enolatos. Com bases fortes, a desprotonação é quantitativa. Normalmente os enolatos são gerados a partir do uso de diisopropilamida de lítio (LDA).
Freqüentemente, como nas condensações de Claisen convencionais , reações de Mannich e condensações de aldol , os enolatos são gerados em baixas concentrações com bases alcóxidas. Sob tais condições, eles existem em baixas concentrações, mas ainda sofrem reações com os eletrófilos. Muitos fatores afetam o comportamento dos enolatos, especialmente o solvente, os aditivos (por exemplo, diaminas) e o contra-cátion (Li + vs Na + , etc.). Para cetonas assimétricas, existem métodos para controlar a regioquímica da desprotonação.
A desprotonação de ácidos de carbono pode prosseguir com o controle da reação cinética ou termodinâmica . Por exemplo, no caso da fenilacetona , a desprotonação pode produzir dois enolatos diferentes. Foi demonstrado que o LDA desprotona o grupo metil, que é o curso cinético da desprotonação. Para garantir a produção do produto cinético, um ligeiro excesso (1,1 equiv) de diisopropilamida de lítio é usado e a cetona é adicionada à base a -78 ° C. Como a cetona é rápida e quantitativamente convertida em enolato e a base está presente em excesso o tempo todo, a cetona é incapaz de atuar como um lançador de prótons para catalisar a formação gradual do produto termodinâmico. Uma base mais fraca, como um alcóxido , que desprotona reversivelmente o substrato, fornece o enolato benzílico mais termodinamicamente estável.
Os enolatos podem ser capturados por acilação e sililação , que ocorrem no oxigênio. Éteres sililenólicos são reagentes comuns na síntese orgânica, conforme ilustrado pela reação aldólica de Mukaiyama :
Reações
Como nucleófilos poderosos, os enolatos reagem prontamente com uma variedade de eletrófilos. Os eletrófilos usuais são haletos de alquila, aldeídos e cetonas e aceitadores de Michael . Essas reações geram novas ligações CC e frequentemente novos estereocentros. A estereosseletividade é influenciada por aditivos.
Aza enolates
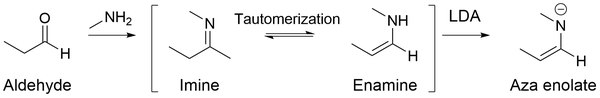
Aza enolatos (também conhecidos como ânions imina, enamidas, bases de Schiff metaladas e metaloenaminas) são nitrogênio análogos aos enolatos. Quando as iminas são tratadas com bases fortes, como LDA , aza enolatos altamente nucleofílicos são gerados.
O principal benefício de usar aza enolatos é que eles não sofrem autocondensação (isto é, reação aldólica para aldeídos ) em uma solução básica ou neutra, mas favorecem a alquilação no carbono alfa. Isso ocorre principalmente porque as iminas contêm ligações duplas carbono-nitrogênio, ao contrário dos aldeídos, que contêm ligações duplas oxigênio-carbono. Como o oxigênio é mais eletronegativo do que o nitrogênio, ele retira mais densidade de elétrons do carbono da carbonila, induzindo uma carga parcialmente positiva maior no carbono. Portanto, com mais carbono eletrofílico, os aldeídos permitem uma melhor adição nucleofílica ao carbono na ligação dupla carbono-oxigênio.
Por outro lado, a imina tem menos nitrogênio eletronegativo, o que induz uma carga parcialmente positiva mais fraca no carbono carbonílico. Como resultado, embora as iminas ainda possam reagir com os organolíticos, elas não reagem com outros nucleófilos (incluindo aza enolatos) para sofrer adições nucleofílicas .
Em vez disso, os aza enolatos reagem de forma semelhante aos enolatos, formando produtos SN2 alquilados. Através da conjugação de um par de nitrogênio, o β-carbono se torna um sítio nucleofílico, permitindo que os aza enolatos passem por reações de alquilação. Assim, aza enolatos podem reagir com vários eletrófilos como epóxidos e halogenetos de alquila para formar uma nova ligação carbono-carbono em β-carbono.
Dois potenciais mecanismos de reação são mostrados abaixo:
Como o epóxido é uma molécula de anel de três membros, ele tem um alto grau de deformação do anel . Embora os carbonos no sistema de anéis sejam tetraédricos , preferindo 109,5 graus entre cada átomo, o epóxido tensiona os ângulos do anel em 60 graus. Para combater esse efeito, os aza enolatos nucleofílicos reagem facilmente com os epóxidos para reduzir suas cepas de anel.
Além de reagir com epóxidos, aza enolatos também podem reagir com halogenetos de alquil (ou halogenetos de alil como representado acima) para formar uma nova ligação carbono-carbono sigma . Essa reação é uma das etapas principais na síntese do feromônio de agressão masculina, Oulema melanopus. O aza-enolato é gerado pela reação de LDA com o pivaldeído, que então reage com um halogeneto de alquila para formar um intermediário Oulema melanopus.
Os enolatos de Aza também podem ser formados com reagentes de Grignard e reagir com outros eletrófilos suaves, incluindo receptores de Michael .