Dapivirina - Dapivirine
 | |
| Dados clínicos | |
|---|---|
| Código ATC | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Dados químicos e físicos | |
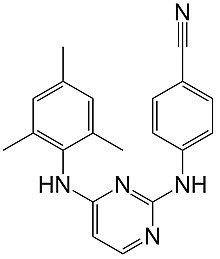
| Fórmula | C 20 H 19 N 5 |
| Massa molar | 329.398 |
| Modelo 3D ( JSmol ) | |
| |
| |
A dapivirina é um inibidor da transcriptase reversa não nucleosídeo desenvolvido na Janssen Therapeutics (anteriormente Tibotec Therapeutics ). A Parceria Internacional para Microbicidas detém direitos exclusivos mundiais da dapivirina desde 2014, com base em uma licença livre de royalties de 2004 para desenvolver microbicidas à base de dapivirina para mulheres em países com poucos recursos.
Um anel intravaginal mensal contendo dapivirina foi desenvolvido como forma de prevenir a infecção pelo vírus da imunodeficiência humana em mulheres. Dois ensaios clínicos de fase 3 de anéis de dapivirina intravaginais para prevenção do HIV foram concluídos em 2015 e os resultados foram anunciados na Conferência de Retrovírus e Infecções Oportunistas de 2016 . O estudo ASPIRE (MTN-020) relatou uma redução de 27% na aquisição do HIV-1 (IC 95% 12-57%, p = 0,007), com uma tendência de maior proteção em mulheres com mais de 21 anos e nenhuma proteção significativa para mulheres com menos de 21 anos. O estudo Ring (IPM-027) relatou uma redução de 31% na aquisição de HIV (IC 95% 0,9-51,5%, p = 0,040) também com uma tendência de maior eficácia em mulheres com mais de 21 anos. Em ambos os ensaios, mais mais de 80% dos anéis devolvidos mostraram sinais de depleção da droga, indicando pelo menos algum uso, e mais de 80% das amostras de sangue dos participantes no braço ativo tinham níveis de dapivirina consistentes de pelo menos 8 horas de uso contínuo antes do exame de sangue. Nenhum ensaio pôde avaliar se o produto foi usado de forma consistente entre as visitas do estudo.
Em dezembro de 2019, tornou-se o primeiro do tipo a ser submetido à aprovação regulamentar. O anel está atualmente em revisão pela Agência Europeia de Medicamentos com um parecer esperado em 2020. Submissões regulatórias adicionais estão planejadas para a Administração de Alimentos e Medicamentos dos EUA, a Autoridade Reguladora de Produtos de Saúde da África do Sul e outros reguladores na África, onde as mulheres enfrentam o maior risco para o HIV.
links externos
Referências
