2,5-Dimetilfurano - 2,5-Dimethylfuran

|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
2,5-Dimetilfurano |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard |
100,009,923 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 6 H 8 O | |
| Massa molar | 96,13 |
| Aparência | Líquido |
| Densidade | 0,8897 g / cm 3 |
| Ponto de fusão | −62 ° C (−80 ° F; 211 K) |
| Ponto de ebulição | 92 a 94 ° C (198 a 201 ° F; 365 a 367 K) |
| Insolúvel | |
| -66,37 · 10 −6 cm 3 / mol | |
|
Índice de refração ( n D )
|
1,44 - 1,442 |
| Perigos | |
| Riscos principais | Muito inflamável, prejudicial |
| Ponto de inflamação | -1 ° C (30 ° F; 272 K) |
| 285,85 ° C (546,53 ° F; 559,00 K) | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
2,5-Dimetilfurano é um composto heterocíclico com a fórmula (CH 3 ) 2 C 4 H 2 O. Embora frequentemente abreviado como DMF , não deve ser confundido com dimetilformamida . Derivado do furano , esse composto simples é um biocombustível em potencial , podendo ser derivado da celulose.
Produção
A frutose pode ser convertida em 2,5-dimetilfurano em um processo catalítico de biomassa para líquido . A conversão de frutose em DMF ocorre via hidroximetilfurfural .
A frutose pode ser obtida a partir da glicose, um elemento fundamental da celulose.
Potencial como biocombustível
O DMF tem uma série de atrações como biocombustível . Possui densidade de energia 40% maior que a do etanol , o que o torna comparável à gasolina (gasolina). Também é quimicamente estável e, sendo insolúvel em água, não absorve umidade da atmosfera. A evaporação do dimetilfurano durante o processo de produção também requer cerca de um terço a menos de energia do que a evaporação do etanol, embora tenha um ponto de ebulição cerca de 14 ° C superior, a 92 ° C, contra 78 ° C do etanol.
A capacidade de produzir dimetilfurano com eficiência e rapidez a partir da frutose, encontrada em frutas e alguns vegetais de raiz , ou a partir da glicose, que pode ser derivada de amido e celulose - todos amplamente disponíveis na natureza - aumenta a atração do dimetilfurano, embora as questões de segurança devam ser examinado. Bioetanol e biodiesel são atualmente os principais biocombustíveis líquidos.
A razão estequiométrica ar / combustível do dimetilfurano é 10,72, em comparação com o etanol a 8,95 e a gasolina a 14,56. Isso significa que a queima do dimetilfurano requer aproximadamente 33% menos ar do que a mesma quantidade de gasolina, mas aproximadamente 20% mais ar do que a mesma quantidade de etanol.
O valor calorífico do dimetilfurano líquido é de 33,7 MJ / kg, em comparação com 26,9 MJ / kg para o etanol e 43,2 MJ / kg para a gasolina. O índice de octanagem de pesquisa (RON) do dimetilfurano é 119. O calor latente de vaporização a 20 ° C é 31,91 kJ / mol. Testes recentes em um motor a gasolina de cilindro único descobriram que a eficiência térmica da queima de dimetilfurano é semelhante à da gasolina.
Outros usos
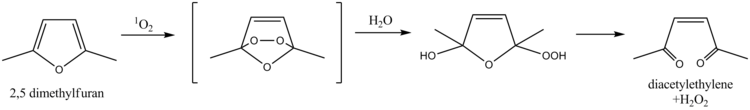
O 2,5-Dimetilfurano atua como um limpador de oxigênio singlete , uma propriedade que tem sido explorada para a determinação de oxigênio singlete em águas naturais. O mecanismo envolve uma reação de Diels-Alder seguida por hidrólise , resultando em diacetiletileno e peróxido de hidrogênio como produtos. Mais recentemente, o álcool furfurílico tem sido usado para o mesmo propósito.
2,5-Dimetilfurano também foi proposto como um padrão interno para espectroscopia de RMN . 2,5-Dimetilfurano tem singletes no seu espectro de RMN de 1 H em δ 2,2 e 5,8; os singlets fornecem integrações confiáveis, enquanto as posições dos picos não interferem com muitos analitos. O composto também tem um ponto de ebulição apropriado de 92 ° C que evita perdas por evaporação, embora seja facilmente removido.
Papel na química alimentar
O 2,5-dimetilfurano se forma na degradação térmica de alguns açúcares e foi identificado em pequenas quantidades como um componente de açúcares caramelizados .
Toxicologia
O 2,5-Dimetilfurano desempenha um papel no mecanismo de neurotoxicidade do hexano em humanos. Junto com hexano-2,5-diona e 4,5-di-hidroxi-2-hexanona, é um dos principais metabólitos do hexano .
O 2,5-dimetilfurano foi identificado como um dos componentes da fumaça do charuto com baixa toxicidade ciliar (capacidade de afetar adversamente os cílios no trato respiratório, que são responsáveis pela remoção de partículas estranhas). Sua concentração sangüínea pode ser usada como biomarcador para o tabagismo .
A comparação das Fichas de Dados de Segurança mostra que o manuseio humano de 2,5-dimetilfurano é aproximadamente tão perigoso quanto o manuseio de gasolina.
