X-inativação - X-inactivation
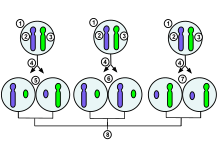
1. Célula embrionária em estágio inicial de uma fêmea humana
2. Cromossomo X materno 3. Cromossomo
X
paterno 4. Mitose e evento aleatório de inativação do cromossomo X
5. O cromossomo paterno é inativado aleatoriamente em uma célula filha, o cromossomo materno é inativado nas outras
6 . O cromossomo materno é inativado aleatoriamente em ambas as células filhas
7. O cromossomo materno é inativado aleatoriamente em ambas as células filhas
8. Três resultados de combinação aleatória possíveis
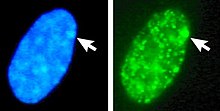
Esquerda: núcleo corado com DNA (DAPI). A seta indica a localização do corpo de Barr (Xi). À direita: proteína histona associada ao DNA detectada
A inativação do X (também chamada de Lyonização , em homenagem à geneticista inglesa Mary Lyon ) é um processo pelo qual uma das cópias do cromossomo X é inativada em mamíferos fêmeas Therian . O cromossomo X inativo é silenciado por ser empacotado em uma estrutura transcricionalmente inativa chamada heterocromatina . Como quase todas as fêmeas de mamíferos têm dois cromossomos X, a inativação de X impede que tenham duas vezes mais produtos do gene do cromossomo X do que os machos , que possuem apenas uma única cópia do cromossomo X (ver compensação de dosagem ).
A escolha de qual cromossomo X será inativado é aleatória em mamíferos placentários , como humanos , mas uma vez que um cromossomo X é inativado, ele permanecerá inativo durante toda a vida da célula e seus descendentes no organismo (sua linha celular). A inativação do X que é distribuída de maneira desigual pelas linhas celulares dentro de um organismo ( inativação do X distorcida ) geralmente ocorre.
Ao contrário da inativação X aleatória em mamíferos placentários, a inativação em marsupiais aplica-se exclusivamente ao cromossomo X derivado do pai.
Mecanismo
Ciclo de ativação do cromossomo X em roedores
Os parágrafos abaixo referem-se apenas a roedores e não refletem XI na maioria dos mamíferos. A inativação do X faz parte do ciclo de ativação do cromossomo X ao longo da vida feminina. O ovo e o zigoto fertilizado inicialmente usam transcritos maternos, e todo o genoma embrionário é silenciado até a ativação do genoma zigótico. Posteriormente, todas as células de camundongo sofrem uma inativação impressa precoce do cromossomo X derivado paternalmente em embriões em estágio de célula de 4-8 . Os tecidos extraembrionários (que dão origem à placenta e outros tecidos que sustentam o embrião) retêm essa inativação inicial impressa e, portanto, apenas o cromossomo X materno está ativo nesses tecidos.
No blastocisto inicial , essa inativação inicial impressa do X é revertida nas células da massa celular interna (que dão origem ao embrião) e, nessas células, os dois cromossomos X tornam-se ativos novamente. Cada uma dessas células, então, inativa de forma independente e aleatória uma cópia do cromossomo X. Este evento de inativação é irreversível durante a vida do indivíduo, com exceção da linha germinativa. Na linha germinal feminina, antes da entrada meiótica, a inativação do X é revertida, de modo que, após a meiose, todos os oócitos haplóides contêm um único cromossomo X ativo.
Visão geral
O Xi marca o cromossomo X inativo, Xa o cromossomo X ativo. X P denota o cromossomo paterno e X M denota o cromossomo X materno. Quando o óvulo (carregando X M ) é fertilizado por um espermatozóide (carregando um Y ou X P ), um zigoto diplóide se forma. Do zigoto, passando pelo estágio adulto, até a próxima geração de ovos, o cromossomo X sofre as seguintes mudanças:
- Zigoto Xi P Xi M → passando por ativação do genoma zigótico , levando a:
- Xa P Xa M → passando por imprinted (paternal) X-inativação , levando a:
- Xi P Xa M → passando por X-ativação no estágio inicial de blastocisto , levando a:
- Xa P Xa M → passando por X-inativação aleatória na linhagem embrionária (massa celular interna) no estágio de blastocisto, levando a:
- Xi P Xa M OR Xa P Xi M → passando por X-reativação em células germinativas primordiais antes da meiose , levando a:
- Células germinativas diplóides Xa M Xa P em parada meiótica. Como a meiose I só termina com a ovulação , as células germinativas humanas existem neste estágio desde as primeiras semanas de desenvolvimento até a puberdade. A conclusão da meiose leva a:
- Células germinativas haplóides (ovos) Xa M E Xa P.
O ciclo de ativação X foi melhor estudado em camundongos, mas existem vários estudos em humanos. Como a maioria das evidências vem de ratos, o esquema acima representa os eventos em ratos. A conclusão da meiose é simplificada aqui para maior clareza. As etapas 1 a 4 podem ser estudadas em embriões fertilizados in vitro e em células-tronco de diferenciação; A reativação do X ocorre no embrião em desenvolvimento e as etapas subsequentes (6–7) dentro do corpo feminino, portanto, muito mais difíceis de estudar.
Cronometragem
O tempo de cada processo depende da espécie e, em muitos casos, o tempo exato é debatido ativamente. [Toda a parte do tempo humano de inativação do X nesta tabela é altamente questionável e deve ser removida até que seja devidamente fundamentada por dados empíricos]
| Processo | Mouse | Humano | |
| 1 | Ativação do genoma zigótico | Estágio de 2–4 células | Estágio de 2 a 8 células |
| 2 | Inativação do X impressa (paterna) | Estágio de 4-8 células | Não está claro se ocorre em humanos |
| 3 | X-ativação | Estágio inicial de blastocisto | Estágio inicial de blastocisto |
| 4 | Inativação aleatória do X na linhagem embrionária (massa celular interna) | Estágio de blastocisto tardio | Estágio de blastocisto tardio, após implantação |
| 5 | Reativação de X em células germinativas primordiais antes da meiose | De antes da semana de desenvolvimento 4 até a semana 14 |
Herança do status de inativação ao longo das gerações de células
Os descendentes de cada célula que inativou um determinado cromossomo X também inativarão esse mesmo cromossomo. Esse fenômeno, que pode ser observado na coloração de gatos tartaruga quando as fêmeas são heterozigotas para o gene ligado ao X , não deve ser confundido com mosaicismo , termo que se refere especificamente a diferenças no genótipo de várias populações celulares nos mesmos. Individual; A inativação do X, que é uma alteração epigenética que resulta em um fenótipo diferente, não é uma alteração no nível genotípico . Para uma célula ou linhagem individual, a inativação é, portanto, distorcida ou ' não aleatória ', e isso pode dar origem a sintomas leves em mulheres 'portadoras' de distúrbios genéticos ligados ao X.
Seleção de um cromossomo X ativo
Mulheres normais possuem dois cromossomos X e, em qualquer célula, um cromossomo estará ativo (designado como Xa) e o outro será inativo (Xi). No entanto, estudos de indivíduos com cópias extras do cromossomo X mostram que em células com mais de dois cromossomos X ainda há apenas um Xa, e todos os cromossomos X restantes estão inativados. Isso indica que o estado padrão do cromossomo X nas mulheres é a inativação, mas um cromossomo X é sempre selecionado para permanecer ativo.
Entende-se que a inativação do cromossomo X é um processo aleatório, ocorrendo mais ou menos no momento da gastrulação no epiblasto (células que darão origem ao embrião). Os cromossomos X materno e paterno têm igual probabilidade de inativação. Isso sugere que se espera que as mulheres sofram de distúrbios ligados ao X aproximadamente 50% mais que os homens (porque as mulheres têm dois cromossomos X, enquanto os homens têm apenas um); no entanto, na realidade, a ocorrência desses distúrbios em mulheres é muito menor do que isso. Uma explicação para essa disparidade é que 12–20% dos genes no cromossomo X inativado permanecem expressos, proporcionando às mulheres proteção adicional contra genes defeituosos codificados pelo cromossomo X. Alguns sugerem que essa disparidade deve ser evidência de inativação preferencial (não aleatória). A inativação preferencial do cromossomo X paterno ocorre em ambos os marsupiais e em linhagens celulares que formam as membranas que envolvem o embrião, enquanto que em mamíferos placentários o cromossomo X materno ou paterno pode ser inativado em diferentes linhas celulares.
O período de inativação do cromossomo X explica essa disparidade. A inativação ocorre no epiblasto durante a gastrulação, que dá origem ao embrião. A inativação ocorre em um nível celular, resultando em uma expressão em mosaico, na qual manchas de células têm um cromossomo X materno inativo, enquanto outras manchas têm um cromossomo X paterno inativo. Por exemplo, uma mulher heterozigótica para hemofilia (uma doença ligada ao X) teria cerca de metade de suas células hepáticas funcionando corretamente, o que normalmente é o suficiente para garantir a coagulação normal do sangue. O acaso pode resultar em um número significativamente maior de células disfuncionais; entretanto, tais extremos estatísticos são improváveis. As diferenças genéticas no cromossomo também podem tornar um cromossomo X mais provável de sofrer inativação. Além disso, se um cromossomo X tem uma mutação que impede seu crescimento ou o torna inviável, as células que inativaram esse X aleatoriamente terão uma vantagem seletiva sobre as células que inativaram aleatoriamente o alelo normal. Assim, embora a inativação seja inicialmente aleatória, as células que inativam um alelo normal (deixando o alelo mutado ativo) acabarão crescendo e sendo substituídas por células funcionalmente normais nas quais quase todas têm o mesmo cromossomo X ativado.
É hipotetizado que existe um 'fator de bloqueio' codificado de forma autossômica que se liga ao cromossomo X e impede sua inativação. O modelo postula que existe um fator de bloqueio limitante, portanto, uma vez que a molécula do fator de bloqueio disponível se liga a um cromossomo X, o (s) cromossomo (s) X restante (s) não são protegidos da inativação. Este modelo é apoiado pela existência de um único Xa em células com muitos cromossomos X e pela existência de dois cromossomos X ativos em linhas celulares com o dobro do número normal de autossomos.
Sequências no centro de inativação X ( XIC ), presentes no cromossomo X, controlam o silenciamento do cromossomo X. Prevê-se que o fator de bloqueio hipotético se ligue a sequências dentro do XIC.
Expressão de distúrbios ligados ao X em mulheres heterozigotas
O efeito da heterozigosidade X fêmea é aparente em alguns traços localizados, como o padrão de pelagem exclusivo de um gato malhado. Pode ser mais difícil, entretanto, entender completamente a expressão de traços não localizados nessas mulheres, como a expressão de doenças.
Como os homens têm apenas uma cópia do cromossomo X, todos os genes do cromossomo X expressos (ou alelos , no caso de formas variantes múltiplas para um determinado gene na população) estão localizados nessa cópia do cromossomo. As mulheres, no entanto, expressam principalmente os genes ou alelos localizados na cópia do cromossomo X que permanece ativa. Considerando a situação para um gene ou múltiplos genes causando diferenças individuais em um fenótipo particular (ou seja, causando variação observada na população para aquele fenótipo), em mulheres homozigotas não importa particularmente qual cópia do cromossomo está inativada, pois os alelos em ambas as cópias são iguais. No entanto, em mulheres que são heterozigotas nos genes causais, a inativação de uma cópia do cromossomo sobre a outra pode ter um impacto direto em seu valor fenotípico. Por causa desse fenômeno, há um aumento observado na variação fenotípica em mulheres que são heterozigotas no gene ou genes envolvidos do que em mulheres que são homozigotas nesse gene ou genes. Existem muitas maneiras diferentes pelas quais a variação fenotípica pode se manifestar. Em muitos casos, as mulheres heterozigotas podem ser assintomáticas ou apresentar apenas sintomas menores de um determinado distúrbio, como a adrenoleucodistrofia ligada ao X.
A diferenciação do fenótipo em mulheres heterozigotas é promovida pela presença de enviesamento de inativação do X. Normalmente, cada cromossomo X é silenciado em metade das células, mas esse processo é distorcido quando ocorre a inativação preferencial de um cromossomo. Pensa-se que a distorção ocorre por acaso ou por uma característica física de um cromossomo que pode fazer com que ele seja silenciado com mais ou menos frequência, como uma mutação desfavorável.
Em média, cada cromossomo X é inativado em metade das células, no entanto, 5-20% das mulheres "aparentemente normais" apresentam distorção da inativação X. Nos casos em que a distorção está presente, uma ampla gama de expressão de sintomas pode ocorrer, resultando em uma expressão que varia de leve a grave, dependendo da proporção da distorção. Um caso extremo disso foi visto onde gêmeas monozigóticas tinham variação extrema na expressão da doença de Menkes (um distúrbio ligado ao X), resultando na morte de um gêmeo enquanto o outro permanecia assintomático.
Pensa-se que a distorção da inativação do X pode ser causada por problemas no mecanismo que causa a inativação ou por problemas no próprio cromossomo. No entanto, a ligação entre fenótipo e distorção ainda está sendo questionada e deve ser examinada caso a caso. Um estudo que examinou mulheres sintomáticas e assintomáticas que eram heterozigotas para distrofias musculares de Duchenne e Becker (DMD) não encontrou nenhuma ligação aparente entre a expressão do transcrito e a distorção do X-inativação. O estudo sugere que ambos os mecanismos são regulados de forma independente e que existem outros fatores desconhecidos em jogo.
Componente cromossômico
O centro de inativação do X (ou simplesmente XIC) no cromossomo X é necessário e suficiente para causar a inativação do X. As translocações cromossômicas que colocam o XIC em um autossomo levam à inativação do autossomo, e os cromossomos X sem o XIC não são inativados.
O XIC contém quatro genes de RNA não traduzidos , Xist , Tsix , Jpx e Ftx , que estão envolvidos na inativação do X. O XIC também contém locais de ligação para proteínas regulatórias conhecidas e desconhecidas .
RNAs de Xist e Tsix
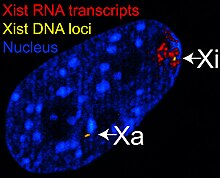
O gene transcrito específico inativo X ( Xist ) codifica um grande RNA não codificador que é responsável por mediar o silenciamento específico do cromossomo X a partir do qual é transcrito. O cromossomo X inativo é revestido por RNA Xist, enquanto o Xa não (veja a figura à direita). Os cromossomos X sem o gene Xist não podem ser inativados. Colocar e expressar artificialmente o gene Xist em outro cromossomo leva ao silenciamento desse cromossomo.
Antes da inativação, ambos os cromossomos X expressam fracamente o RNA Xist do gene Xist. Durante o processo de inativação, o futuro Xa deixa de expressar Xist, enquanto o futuro Xi aumenta drasticamente a produção de RNA de Xist. No futuro Xi, o RNA Xist reveste progressivamente o cromossomo, espalhando-se a partir do XIC; o RNA Xist não se localiza no Xa. O silenciamento de genes ao longo do Xi ocorre logo após o revestimento pelo RNA Xist.
Como Xist, o gene Tsix codifica um grande RNA que não se acredita codificar uma proteína. O RNA de Tsix é transcrito antisense para Xist, o que significa que o gene Tsix se sobrepõe ao gene Xist e é transcrito na fita oposta do DNA do gene Xist. Tsix é um regulador negativo de Xist; Os cromossomos X sem expressão de Tsix (e, portanto, com altos níveis de transcrição de Xist) são inativados com muito mais frequência do que os cromossomos normais.
Como o Xist, antes da inativação, os dois cromossomos X expressam fracamente o RNA de Tsix do gene de Tsix. Após o início da inativação de X, o futuro Xi deixa de expressar o RNA de Tsix (e aumenta a expressão de Xist), enquanto Xa continua a expressar Tsix por vários dias.
Rep A é um RNA não codificador longo que funciona com outro RNA não codificador longo, Xist, para a inativação de X. Rep A inibe a função de Tsix, o antisense de Xist, em conjunto com a eliminação da expressão de Xite. Ele promove a metilação da região de Tsix, atraindo PRC2 e, assim, inativando um dos cromossomos X.
Silenciando
O cromossomo X inativo não expressa a maioria de seus genes, ao contrário do cromossomo X ativo. Isso se deve ao silenciamento do Xi pela heterocromatina repressiva , que compacta o DNA do Xi e impede a expressão da maioria dos genes.
Em comparação com a Xa, o Xi tem elevados níveis de metilação do DNA , os baixos níveis de acetilação da histona , baixos níveis de histona H3 lisina-4 metilação , e elevados níveis de histona H3 lisina-9 metilação e H3 lisina-27 marca de metilação que é colocado pelo complexo PRC2 recrutado por Xist , todos associados ao silenciamento de genes. PRC2 regula a compactação da cromatina e a remodelação da cromatina em vários processos, incluindo a resposta a danos no DNA . Além disso, uma variante da histona chamada macroH2A ( H2AFY ) é encontrada exclusivamente nos nucleossomos ao longo do Xi.
Corpos Barr
O DNA empacotado em heterocromatina, como o Xi, é mais condensado do que o DNA empacotado em eucromatina , como o Xa. O X inativo forma um corpo discreto dentro do núcleo denominado corpo de Barr . O corpo de Barr está geralmente localizado na periferia do núcleo , está se replicando tardiamente no ciclo celular e, como contém o Xi, contém modificações de heterocromatina e o RNA Xist.
Genes expressos no cromossomo X inativo
Uma fração dos genes ao longo do cromossomo X escapa da inativação no Xi. O gene Xist é expresso em níveis elevados no Xi e não é expresso no Xa. Muitos outros genes escapam à inativação; alguns são expressos igualmente de Xa e Xi, e outros, embora expressos de ambos os cromossomos, ainda são predominantemente expressos de Xa. Até um quarto dos genes do Xi humano são capazes de escapar. Estudos em camundongos sugerem que, em qualquer tipo de célula, 3% a 15% dos genes escapam da inativação e que a identidade genética escapada varia entre os tecidos.
Muitos dos genes que o escape de inactivação estão presentes ao longo das regiões do cromossoma X, que, ao contrário da maioria do cromossoma X, contêm genes também presente no cromossoma Y . Essas regiões são chamadas de regiões pseudoautossômicas , pois os indivíduos de ambos os sexos receberão duas cópias de cada gene nessas regiões (como um autossomo), ao contrário da maioria dos genes ao longo dos cromossomos sexuais. Uma vez que indivíduos de ambos os sexos receberão duas cópias de cada gene em uma região pseudo - autossômica , nenhuma compensação de dosagem é necessária para as mulheres, portanto, postula-se que essas regiões do DNA desenvolveram mecanismos para escapar da inativação do X. Os genes das regiões pseudo-autossômicas do Xi não têm as modificações típicas do Xi e têm pouco RNA de Xist ligado.
A existência de genes ao longo do X inativo que não são silenciados explica os defeitos em humanos com números anormais do cromossomo X, como a síndrome de Turner (X0) ou a síndrome de Klinefelter (XXY). Teoricamente, a inativação do X deveria eliminar as diferenças na dosagem do gene entre indivíduos afetados e indivíduos com complemento cromossômico normal. Em indivíduos afetados, entretanto, a inativação do X é incompleta e a dosagem desses genes não silenciados será diferente à medida que eles escapam da inativação do X, semelhante a uma aneuploidia autossômica .
Os mecanismos precisos que controlam o escape da inativação do X não são conhecidos, mas as regiões silenciadas e de escape mostraram ter marcas de cromatina distintas. Foi sugerido que o escape da inativação do X pode ser mediado pela expressão de RNA não codificante longo (lncRNA) dentro dos domínios cromossômicos de escape.
Usos em biologia experimental
Stanley Michael Gartler usou a inativação do cromossomo X para demonstrar a origem clonal dos cânceres. O exame de tecidos normais e tumores de mulheres heterozigotas para isoenzimas do gene G6PD ligado ao sexo demonstrou que as células tumorais de tais indivíduos expressam apenas uma forma de G6PD, enquanto os tecidos normais são compostos por uma mistura quase igual de células que expressam os dois fenótipos diferentes. Esse padrão sugere que uma única célula, e não uma população, se transforma em câncer. No entanto, esse padrão foi provado errado para muitos tipos de câncer, sugerindo que alguns tipos de câncer podem ser de origem policlonal.
Além disso, medir o status de metilação (inativação) do receptor de androgênio humano polimórfico (HUMARA) localizado no cromossomo X é considerado o método mais preciso para avaliar a clonalidade em biópsias de câncer feminino. Uma grande variedade de tumores foi testada por este método, alguns, como o carcinoma de células renais, encontrados monoclonais enquanto outros (por exemplo, mesotelioma) foram relatados como policlonais.
Os pesquisadores também investigaram o uso da inativação do cromossomo X para silenciar a atividade dos cromossomos autossômicos. Por exemplo, Jiang et al. inseriu uma cópia do gene Xist em uma cópia do cromossomo 21 em células-tronco derivadas de um indivíduo com trissomia 21 ( síndrome de Down ). O gene Xist inserido induz a formação do corpo de Barr, desencadeia modificações estáveis de heterocromatina e silencia a maioria dos genes na cópia extra do cromossomo 21. Nessas células-tronco modificadas, o silenciamento do gene mediado por Xist parece reverter alguns dos defeitos associados a Down síndrome.
História
Em 1959, Susumu Ohno mostrou que os dois cromossomos X dos mamíferos eram diferentes: um parecia semelhante aos autossomos ; o outro era condensado e heterocromático. Esse achado sugeriu, independentemente para dois grupos de pesquisadores, que um dos cromossomos X foi inativado.
Em 1961, Mary Lyon propôs a inativação aleatória de um cromossomo X feminino para explicar o fenótipo mosqueado de camundongos fêmeas heterozigotos para genes de cor de pelagem . A hipótese de Lyon também foi responsável pelas descobertas de que uma cópia do cromossomo X em células femininas era altamente condensada e que ratos com apenas uma cópia do cromossomo X desenvolveram-se como mulheres inférteis. Isso sugeriu a Ernest Beutler , estudando mulheres heterozigotas para deficiência de glicose-6-fosfato desidrogenase (G6PD), que havia duas populações de eritrócitos em tais heterozigotos: células deficientes e células normais, dependendo se o cromossomo X inativado (no núcleo da célula precursora da hemácia) contém o alelo G6PD normal ou defeituoso.
Veja também
- Sistema de determinação de sexo
- Compensação de dosagem
- Corpo Barr
- Heterocromatina
- Epigenética
- Inativação de X distorcida
- Transtornos do desenvolvimento que se acredita estarem relacionados à inativação do X:
Referências
Leitura adicional
- Huynh KD, Lee JT (maio de 2005). "Inativação do cromossomo X: uma hipótese que liga a ontogenia e a filogenia". Nature Reviews. Genética . 6 (5): 410–8. doi : 10.1038 / nrg1604 . PMID 15818384 . S2CID 19245310 .
- Goto T, Monk M (junho de 1998). "Regulação da inativação do cromossomo X no desenvolvimento em camundongos e humanos" (Artigo de Revisão) . Revisões de Microbiologia e Biologia Molecular . 62 (2): 362–78. doi : 10.1128 / MMBR.62.2.362-378.1998 . PMC 98919 . PMID 9618446 .
- Lyon MF (dezembro de 2003). "A hipótese Lyon e a LINHA". Seminars in Cell & Developmental Biology (artigo de revisão). 14 (6): 313–8. doi : 10.1016 / j.semcdb.2003.09.015 . PMID 15015738 .
- Ng K, Pullirsch D, Leeb M, Wutz A (janeiro de 2007). “Xist e a ordem do silenciamento” (Artigo de Revisão) . Relatórios EMBO . 8 (1): 34–9. doi : 10.1038 / sj.embor.7400871 . PMC 1796754 . PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (agosto de 2015). "Localização e função Xist: novos insights de vários níveis" . Genome Biology . 16 : 166. doi : 10.1186 / s13059-015-0733-y . PMC 4539689 . PMID 26282267 .
links externos
-
 Mídia relacionada à inativação do cromossomo X no Wikimedia Commons
Mídia relacionada à inativação do cromossomo X no Wikimedia Commons - Kruszelnicki K (11/02/2004). "Hybrid Auto-Immune Women 3" . ABC Science .


