TRPV6 - TRPV6
TRPV6 é uma proteína do canal de cálcio da membrana (Ca 2+ ) que está particularmente envolvida na primeira etapa da absorção de Ca 2+ no intestino .
Classificação
O potencial receptor transiente da subfamília vaniloide 6 (TRPV6) é um canal epitelial de Ca 2+ que pertence à família do potencial receptor transiente (TRP) de proteínas. A família TRP é um grupo de proteínas de canal críticas para a homeostase iônica e a percepção de vários estímulos físicos e químicos. Os canais TRP podem detectar temperatura , pressão osmótica , olfato , sabor e forças mecânicas. O genoma humano codifica 28 canais TRP, que incluem seis canais TRPV . A alta seletividade de Ca 2+ de TRPV5 e TRPV6 torna esses canais distintos dos outros quatro canais de TRPV (TRPV1-TRPV4). TRPV5 e TRPV6 estão envolvidos no transporte de Ca 2+ , enquanto TRPV1 a TRPV3 são sensores de calor com diferentes limiares de temperatura para ativação, e TRPV4 está envolvido na detecção da osmolaridade . Defeitos genéticos no gene TRPV6 estão ligados ao hiperparatireoidismo neonatal transitório e pancreatite crônica de início precoce . A desregulação do TRPV6 também está envolvida na hipercalciúria , formação de cálculos renais , distúrbios ósseos, defeitos na diferenciação dos queratinócitos , deformidades esqueléticas, osteoartrite , esterilidade masculina , síndrome de Pendred e certos subtipos de câncer .
Identificação
Peng et al identificaram TRPV6 em 1999 de duodeno de rato em um esforço para pesquisar proteínas transportadoras de Ca 2+ envolvidas na absorção de Ca 2+ . O TRPV6 também foi chamado de proteína transportadora de cálcio 1 (CaT1) inicialmente, embora os nomes canal de cálcio epitelial 2 (ECaC2) e CaT1-like (CaT-L) também tenham sido usados nos primeiros estudos para descrever o canal. Os ortólogos humanos e de camundongo de TRPV6 foram clonados por Peng et al e Weber et al, respectivamente. O nome TRPV6 foi confirmado em 2005.
Localização do gene, localização cromossômica e filogenia
O gene TRPV6 humano está localizado no locus cromossômico 7q33-34 em estreita proximidade com seu homólogo TRPV5 em 7q35. O gene TRPV6 em humanos codifica para mRNA de 2906 bp de comprimento . Em contraste com a maioria das outras proteínas, que iniciam a tradução com um códon AUG , a tradução do TRPV6 é iniciada por leitura não mediada por códon AUG. A proteína TRPV6 carrega uma extensão N-terminal de 40 aa na placenta e em alguns ambientes fisiológicos em comparação com a versão anotada da proteína usada em estudos biológicos. No entanto, ainda não foi determinado se a versão longa da proteína TRPV6 é a forma dominante em diferentes tecidos.
| Espécies | Humano | Rato | Mouse |
| Localização cromossômica | 7q33-q34 | 4q22 | 6B2 |
| Comprimento aa anotado | 725 | 727 | 727 |
| In vivo aa comprimento a | 765 | 767 | 767 |
| Nucleotídeo RefSeq | NM_018646 | NM_053686 | NM_022413 |
| Proteína RefSeq | NP_061116 | NP_446138 | NP_071858 |
a A verificar em diferentes tecidos.
Postula-se que TRPV5 e TRPV6 genes foram geradas a partir de um gene ancestral comum por duplicao de genes eventos. Filogenética análise mostrou que TRPV6 paralogs em mamíferos , sauropsídeos , anfíbios e Chondrichthyes surgiu de eventos de duplicação independentes no ancestral de cada grupo. Especula-se que dois homólogos Trpv seletivos de Ca 2+ especializados surgiram como uma adaptação para alcançar um maior grau de especialização funcional para navegar em desafios renais distintos de animais terrestres.
Dois alelos do gene TRPV6 foram identificados em humanos (originalmente conhecidos como CaT-La e CaT-Lb). Esses alelos exibem polimorfismos acoplados, gerando duas versões do mesmo gene. Os polimorfismos dão origem a uma “variante ancestral” e uma “variante derivada” que se diferenciam em cinco bases e três aminoácidos. Os códigos de alelo ancestral para C197 (157, entre parênteses são numeração de aminoácidos anotada), M418 (378) e M721 (681), enquanto o alelo derivado codifica para R197 (157), V418 (378) e T721 (681). A frequência do alelo ancestral TRPV6 varia entre diferentes grupos populacionais. É hipotetizado que as pressões de seleção que poderiam ter mudado a distribuição do alelo TRPV6 incluem mudanças nos padrões de consumo de leite, domesticação de animais, mudança na exposição à luz ultravioleta devido à migração transequatorial, adaptações genômicas fornecendo vantagens imunológicas para populações que encontram novos patógenos.
Distribuição de tecido
A proteína TRPV6 é expressa em tecidos epiteliais , como intestino , rim , placenta , epidídimo e glândulas exócrinas , como pâncreas , próstata e glândulas salivares , sudoríparas e mamárias . A expressão da proteína TRPV6 em humanos foi demonstrada no esôfago , estômago , intestino delgado , cólon , pâncreas, glândulas mamárias, ovário , tireóide e próstata por abordagens de imunohistoquímica . A expressão do TRPV6 confina principalmente na membrana apical das células epiteliais. No intestino, a proteína é expressa na membrana da borda em escova do enterócito .
Diferenças no perfil de expressão de TRPV6 foram relatadas, possivelmente devido à variação no desenho de primer dependente do ensaio , sondas de hibridização , PCR vs. Northern blotting , PCR semiquantitativo vs. RT-PCR e anticorpos usados para imunodetecção. O perfil de expressão do TRPV6 também é influenciado pela idade, sexo, níveis de Ca 2+ e vitamina D 3 nos alimentos, estado hormonal, localização dentro do tecido, localização celular, estado reprodutivo e estado de desmame (consulte a Seção de Regulamentação ).
Em humanos, os transcritos do TRPV6 foram detectados na placenta, pâncreas, câncer de próstata e duodeno e próstata por Northern blotting; e no duodeno, jejuno, placenta, pâncreas, testículos, rim, cérebro e cólon por PCR semiquantitativo. Em roedores, a expressão do TRPV6 foi validada no duodeno, ceco, intestino delgado, cólon, placenta, pâncreas, próstata e epidídimo por Northern Blotting. Em camundongos, a abundância do transcrito TRPV6 medida por RT-PCR é a seguinte: próstata> estômago, cérebro> pulmão> duodeno, ceco, coração, rim, osso> cólon> músculo esquelético> pâncreas.
Dados do Human Protein Atlas e baseados em RNA-Seq sugerem que o mRNA do TRPV6 é baixo na maioria dos tecidos, exceto na placenta, glândula salivar, pâncreas e próstata. O mRNA de TRPV6 é expresso no domínio apical de osteoclastos murinos do osso cortical. Osteócitos corticais e trabeculares não expressam o mRNA de TRPV6, enquanto os osteoblastos apresentam expressão fraca.
Estrutura e propriedades biofísicas
Estrutura primária e secundária
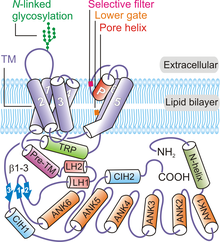
No geral, quatro subunidades de TRPV6 se organizam para formar um canal tetramérico exibindo uma simetria quádrupla . Começando do terminal N e movendo-se em direção ao terminal C da proteína, cada polipeptídeo TRPV6 contém: uma hélice N-terminal, um domínio de repetição de anquirina (ARD) contendo seis repetições de anquirina, um domínio ligante de estrutura em gancho de β composto por dois β -strands , um motivo de hélice-volta-hélice, uma hélice pré-SI, domínio TM composto de seis hélices TM (S1 a S6), uma alça de poro (também chamada de alça P), hélice TRP anfipática , C-terminal gancho e uma cadeia β de seis resíduos (β3) ( Figura 1 ).
Estrutura terciária e quaternária

A proteína do canal TRPV6 apresenta simetria quádrupla e contém dois compartimentos principais: um domínio transmembrana de 30 Å de altura com um poro de canal de íon central e uma saia intracelular de ~ 70 Å de altura e ~ 110 Å de largura envolvendo uma saia intracelular de 50 Å × 50 Å cavidade ampla cavidade abaixo do canal de íons. O agrupamento de quatro subunidades TRPV6 forma um poro aquoso exibindo uma simetria quádrupla ( Figura 2 ). Uma hélice pré-SI liga a porção intracelular da proteína ao domínio TM através de um domínio ligante constituído de estrutura em gancho β e um motivo de hélice-volta-hélice. As hélices S1 a S4 formam um feixe helicoidal transmembrana ou domínio TM que é inserido quase perpendicularmente ao plano da membrana plasmática.
Os elementos do módulo de poro são constituídos por S5, S6 e o P-loop nos domínios TM. O módulo de poro de cada polipeptídeo TRPV6 participa de interações entre subunidades para formar um poro de íon central ( Figura 1 ). Os elementos formadores de poros de cada subunidade TRPV6 também interagem com os domínios S1-S4 do polipeptídeo adjacente em um arranjo de domínio trocado. As interações entre subunidades também ocorrem entre os loops extracelulares S1-S2 e os loops S5-P e S6-P das subunidades TRPV6 vizinhas. O local de glicosilação ligado a N conservado no loop S1-S2 é necessário para a ativação mediada por Klotho . A porção da saia intracelular da proteína TRPV6 é composta principalmente de repetições de anquirina. O domínio TRP é orientado paralelamente à membrana e participa das interações hidrofóbicas com o domínio TM e das interações hidrofílicas na saia intracelular. A hélice N-terminal, o gancho C-terminal e as folhas β (formadas pela estrutura em gancho β no domínio do ligante) no canal participam de interações intersubunidades com os ARDs para fornecer uma estrutura para manter os elementos da saia intracelular juntos.
Arquitetura de poros e sítios de ligação de cátions
O poro TRPV6 possui quatro elementos principais, a saber, o vestíbulo extracelular, um filtro de seletividade, uma cavidade hidrofóbica e uma porta inferior. De frente para o lúmen central do canal, um filtro de seletividade de quatro resíduos ( 538 TIID 541 ) contendo quatro cadeias laterais de Aspartato 541 (D541) (uma de cada protômero) é crítico para a seletividade de Ca 2+ e outras propriedades biofísicas do canal. Este filtro forma um anel com carga negativa que discrimina os íons com base em seu tamanho e carga. Mutações no resíduo crítico formador de poros do TRPV6 bloqueia a captação de Ca 2+ , uma estratégia tem sido usada para gerar modelos de perda de função do TRPV6 para examinar o papel do canal na fisiologia animal. Acredita-se que quatro tipos diferentes de sítios de ligação de cátions existam no canal TRPV6. O local 1 está localizado no poro central e compartilha o mesmo plano que é ocupado pelos resíduos seletivos chave D541. O local 2 está presente cerca de 6-8 Å abaixo do local 1 seguido pelo local 3, que está localizado no eixo central do poro cerca de 6,8 Å abaixo do local 2. Os locais 2 e 3 são pensados para interagir com parcialmente hidratado a equatorialmente hidratado Íons Ca 2+ . Finalmente, quatro sítios simétricos de ligação a cátions no vestíbulo extracelular medeiam o recrutamento de cátions em direção ao vestíbulo extracelular de TRPV6 e são referidos como sítios de recrutamento.
Permeação de íons
A condutância do TRPV6 para cátions divalentes segue a preferência: Ca 2+ > Ba 2+ > Sr 2+ > Mn 2 . O Mg 2+ intracelular inibe o TRPV6 e contribui para a forte retificação interna exibida pelo canal. A atividade de captação de TRPV6 é inibida por Pb 2 divalente , Cu 2+ , Cd 2+ , Zn 2 , Co 2+ , Fe 2+ e cátions trivalentes La 3+ , Fe 3+ , Gd 3+ . A concentração de íons para atingir a inibição varia de 1 a 10 μM. A proteína TRPV6 é constitutiva com uma condutância de canal único de 42-58 ps. Em baixas concentrações de Ca 2+ , um único íon Ca 2+ se liga ao filtro de seletividade formado por D541 e permite a permeação de Na + . Em alta Ca 2+ concentração, Ca 2+ permeação ocorre por um knock-off mecanismo que envolve a formação de conformações de vida curta que envolvem a ligação de três Ca 2+ iões para D541 resíduo.
Canal gating

As mudanças conformacionais envolvidas na abertura do canal são articuladas em torno do resíduo Alanina 566 (A566) e ocorrem na hélice S6 de revestimento dos poros ( Figura 3 ). A porção superior da hélice S6 sofre uma transição helicoidal α-para-π que força a porção inferior da hélice a girar 100 graus e inclinar-se para longe do eixo dos poros em 11 graus. Esta mudança conformacional move a porção inferior da hélice bloqueando o poro e, assim, amplia o tamanho do poro. A mudança conformacional altera os resíduos voltados para o eixo dos poros e desencadeia a formação de novas subunidades de ligações eletrostáticas e pontes de sal que compensam o alto custo energético da transição helicoidal α-para-π desfavorável que ocorre durante a abertura do canal.
Regulação por fosfatidilinositol 4,5-bifosfato (PIP 2 ) e calmodulina (CaM)
O influxo de Ca 2+ dentro da célula desencadeia mecanismos de feedback negativo para suprimir a atividade do TRPV6 e prevenir a sobrecarga de Ca 2+ . A atividade do canal TRPV6 é regulada pelo nível intracelular de fosfolipídeo fosfatidilinositol 4,5-bifosfato (PIP 2 ) e pelas interações com o complexo Ca 2+ - Calmodulina (CaM). A depleção de PIP 2 ou ligação de CaM inativa TRPV6. O influxo de Ca 2+ nas células que expressam TRPV6 ativa a fosfolipase C (PLC) que, por sua vez, hidrolisa a PIP 2 . O esgotamento dos níveis de PIP 2 resulta em um declínio na atividade do canal, uma vez que a maioria dos canais TRP requer este lipídio para ativação. O lipídio PIP 2 pode substituir a inibição mediada por Ca 2+ -CaM de TRPV6. No geral, a inativação do TRPV6 pela calmodulina é orquestrada por um equilíbrio da concentração intracelular de Ca 2+ e PIP 2 .
Proteínas em interação
Entre os 20+ interagentes de TRPV6 identificados até agora, as consequências funcionais da proteína Calmodulina de ligação ao Ca 2+ (CaM) e da Glucuronidase Klotho foram caracterizadas de forma mais extensa [36, 37, 41, 42]. As consequências funcionais da ativação do canal TRPV6 estão resumidas na tabela abaixo).
| Interator | Consequência |
| BSPRY | N / D |
| Calbindin-D 28k | N / D |
| Calmodulin | Inibição |
| Ciclofilina B | Ativação |
| FYN | PO 4 lação |
| I-MFA | N / D |
| Klotho | Ativação, glicosilação (Asn-357) |
| NHERF4 | Ativação |
| NIPSNAP1 | Inibição |
| ENTORPECIDO | Inibição |
| PTEN | N / D |
| PTP1B | DePO 4 lação
(Tyr-161 e Tyr-162) |
| RAB11A | Ativação,
Aumento no nível da membrana plasmática |
| RGS2 | N / D |
| RYR1 | N / D |
| S100A10 | Ativação,
Aumento no nível da membrana plasmática |
| SRC | PO 4 litação (Tyr-161, 162) |
| TRPC1 | Retém em ER, inibição |
| TRPML3 | N / D |
| TRPV5 | Formação de tetrâmero,
Criação de novo canal |
Abreviações
Interator Proteico
BSPRY: Proteína Contendo Domínio B-Box e Spry; FYN: Fyn Kinase Belonging Src Family of Kinases; I-MFA: Inibidor da família Myo D; NHERF: fator regulador do trocador de Na; Domínio NIPSNAP14-nitrofenilfosfatase e proteína homóloga não neuronal semelhante a SNAP25 1; Dormência: mutação da drosófila que remove a maioria dos neurônios sensoriais no sistema nervoso periférico em desenvolvimento; PTP: Proteína Tirosina Fosfatase; Rab11a: Membro RAS Oncogene Family; RGS2: Regulador da Sinalização da Proteína G 2; RyR1: Receptor 1 de Ryanodine; TRPC1: Potencial transiente do receptor canônico 1; TRPML3: potencial receptor transiente Mucolipina-3.
Funções fisiológicas
As proteínas do canal seletivo de Ca 2+ , TRPV6 e TRPV5, cooperam para manter a concentração de cálcio em órgãos específicos. O TRPV6 funciona como canais apicais de entrada de Ca 2+ mediando o transporte transcelular desse íon no intestino, placenta e possivelmente alguns outros órgãos exócrinos. O TRPV6 também desempenha papéis importantes no transporte materno-fetal de cálcio, na diferenciação dos queratinócitos e na homeostase do Ca 2+ no sistema endolinfático do sistema vestibular e na manutenção da fertilidade masculina.
Absorção de C a 2+ no intestino
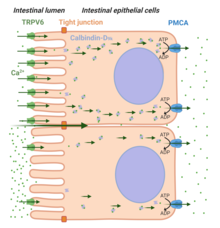
Duas rotas de absorção de Ca 2+ são reconhecidas: transporte paracelular e transporte transcelular (ver Figura 4 ). Uma dieta rica em Ca 2+ favorece o transporte paracelular do íon ao longo do intestino, permitindo que eles passem entre as junções estreitas intercelulares que conectam as células epiteliais. Em contraste, sob condições em que [Ca 2+ ] no lúmen do intestino é menor em comparação com sua concentração no plasma (por exemplo, durante dieta baixa em Ca 2+ ), a via transcelular é necessária para a absorção adequada de Ca 2+ . Três etapas importantes no transporte transcelular de Ca 2+ são reconhecidas: entrada celular do íon Ca 2+ no lado apical via TRPV6 (Etapa 1), a ligação do íon Ca 2+ com calbindina -D 9k (Etapa 2) , e saída de Ca 2+ do lado basolateral através da membrana plasmática Ca 2+ ATPase (PMCA1b). O hormônio vitamina D 3 (ou 1,25 (OH) 2 D 3 ) desempenha um papel importante na absorção intestinal de Ca 2+ mediada pelo TRPV6 .
Reabsorção de Ca 2+ no rim
Em contraste com o intestino, onde o TRPV6 é o guardião da absorção de Ca 2+ , a reabsorção transcelular desse íon no rim ocorre por meio do TRPV5. Embora o TRPV5 seja um porteiro reconhecido para a reabsorção transcelular do íon Ca 2+ no rim, os camundongos knockout para TRPV6 (KO) também lutam para concentrar sua urina e apresentam hipercalciúria. TRPV6 é conhecido por co-localizar com TRPV5 Calbindin-D 28K em domínios apicais de túbulos contorcidos distais e túbulos de conexão [20]. Camundongos TRPV5 KO compensam a perda de Ca 2+ aumentando a expressão de TRPV6 no duodeno. Além disso, um estudo recente analisando genes responsivos à vitamina D em rins ovinos , caninos e equinos sugeriu que TRPV6, calD 9k / calD 28k e PMCA poderiam ser as principais vias orquestrando o transporte transcelular de Ca 2+ no rim de ovelhas, cães e cavalos.
Transporte materno-fetal de Ca 2+
O TRPV6 desempenha um papel indispensável no transporte placentário de Ca 2+ . A mineralização óssea fetal atinge o pico durante o final da gravidez. Nesta fase, o sangue fetal tem uma concentração mais elevada de Ca 2+ em comparação com o sangue materno, criando assim condições que requerem o transporte transcelular ativo de Ca 2+ da mãe para o feto. Esse processo é muito importante, uma vez que defeitos no transporte placentário de cálcio podem ser precursores de síndromes de deficiência de Ca 2+ e restrições de crescimento intra - uterino . A expressão do TRPV6 aumenta 14 vezes durante os últimos 4 dias do período gestacional murino e coincide com a fase de pico da mineralização óssea fetal. A proteína TRPV6 é abundantemente expressa nos tecidos placentários de mamíferos. Na verdade, a expressão de TRPV6 é ~ 1000 vezes maior em comparação com TRPV5. Na placenta, o TRPV6 é expresso em trofoblastos e sincitiotrofoblastos . Em camundongos, o mRNA e a proteína do TRPV6 são expressos no saco vitelino intraplacentário e na camada visceral do saco vitelino extraplacentário. Mais importante ainda, os fetos TRPV6 KO exibem uma redução de 40% na atividade de transporte de 45 Ca 2+ e uma redução dramática no peso das cinzas (uma medida da saúde óssea fetal). Em humanos, o estresse de cisalhamento de fluido de trofoblastos (FSS) é conhecido por induzir um influxo de Ca 2+ mediado por TRPV6 e promover a formação de microvilosidades por meio de um mecanismo que envolve a fosforilação de Ezrin e Akt.
Regulação do Ca 2+ epididimário e implicações na fertilidade masculina
A regulação da concentração de cálcio no lúmen do epidídimo é crítica para a motilidade dos espermatozoides . A redução da concentração luminal de Ca 2+ mediada por TRPV6 no epidídimo é crítica para a fertilidade masculina em camundongos. Camundongos TRPV6 KO ou camundongos que expressam a versão de perda de função do canal TRPV6 ( camundongos homozigotos Trpv6 D541A ) têm uma fertilidade gravemente prejudicada . Os camundongos que expressam TRPV6 não funcional têm uma concentração 10 vezes maior de Ca 2+ no lúmen do epidídimo e a captação de Ca 2+ neste espaço é reduzida em 7 a 8 vezes. O aumento do íon Ca 2+ na concentração do lúmen epididimal leva a defeitos significativos na motilidade, capacidade de fertilização e viabilidade dos espermatozoides em camundongos TRPV6 D541A . Parece que o TRPV6 e a forma transmembrana do canal de cloreto 16 A ( TMEM16A ) atuam cooperativamente para reduzir a concentração luminal de Ca 2+ no lúmen epididimal.
Saúde óssea
Em condições de Ca 2+ dietético abaixo do ideal , os níveis normais de cálcio sérico em camundongos KO TRPV6 são mantidos às custas do osso. O TRPV6 desempenha um papel importante nos osteoclastos, mas não nos osteoblastos. Em camundongos, a depleção de TRPV6 resulta em diferenciação aumentada de osteoclastos, enquanto TRPV5 é essencial para a reabsorção óssea osteoclástica adequada.
Diferenciação de queratinócitos
A diferenciação dos queratinócitos é orquestrada pela troca de cálcio, um processo que acarreta um influxo de Ca 2+ nos queratinócitos que induz amplas mudanças transcricionais necessárias para a formação, estratificação e cornificação dos desmossomos . Os camundongos TRPV6 KO apresentam camadas mais finas de estrato córneo e 20% dos camundongos também apresentam alopecia e dermatite . O silenciamento do TRPV6 prejudica a diferenciação mediada por Ca 2+ dos queratinócitos primários humanos e diminui a regulação dos marcadores de diferenciação, como involucrina , transglutaminase-1 e citoqueratina-10 . O hormônio 1,25-diidroxivitamina-D3 regula positivamente o TRPV6 nos queratinócitos e desencadeia um influxo de Ca 2+ . Isso, por sua vez, induz a expressão de vias específicas de diferenciação de queratinócitos.
Papel no ouvido interno
As proteínas TRPV5 e TRPV6 são expressas em várias regiões do ouvido interno , bem como em culturas primárias do epitélio do ducto do canal semicircular (SCCD). Alguns estudos indicam que o TRPV5 e o TRPV6 são necessários para diminuir a concentração de Ca 2+ no lúmen da endolinfa de mamíferos , requisito essencial para a audição normal e o equilíbrio.
Expressão uterina e placentária de TRPV6 e implicações na gravidez
A expressão endometrial e uterina de TRPV6 foi relatada em mamíferos. Acredita-se que a expressão do TRPV6 no útero seja regulada hormonalmente pelo 17β-estradiol e pela progesterona em roedores. Em roedores, o mRNA do TRPV6 é expresso no labirinto e na zona esponjosa, bem como nas áreas não aderidas à placenta do útero. O estágio da gravidez é um importante regulador da expressão do TRPV6. Acredita-se que a regulação negativa da expressão de TRPV5 / 6 e um declínio resultante no transporte de Ca 2+ alterem o perfil proliferativo dos trofoblastos humanos; um processo que, por sua vez, está ligado ao desenvolvimento da pré-eclâmpsia . Essa justaposição da expressão do TRPV6 e sua regulação rigorosa pelos hormônios sexuais durante a gravidez sugere que a proteína pode ser importante para a implantação do embrião , no entanto, não existem evidências conclusivas para essa conexão.
Implicações em doenças humanas
Hiperparatireoidismo Neonatal Transitório
A perda de TRPV6 na placenta murina prejudica gravemente o transporte de Ca 2+ através do trofoblasto e reduz o crescimento do embrião, induz calcificação óssea e prejudica o desenvolvimento ósseo. Em humanos, o transporte materno-fetal insuficiente causado por variantes genômicas patogênicas do TRPV6 é considerado a causa de defeitos esqueléticos observados em relatos de casos selecionados de casos de hiperparatireoidismo neonatal transitório (TNHP). Acredita-se que essas variantes comprometam a localização da proteína na membrana plasmática. O sequenciamento do exoma de um lactente com insuficiência torácica de início pré-natal grave, acompanhada de anormalidades esqueléticas fetais, indica o papel crítico do TRPV6 no transporte materno-fetal. O estudo indicou que variantes heterozigóticas compostas de TRPV6 resultam em grave submineralização e displasia grave do esqueleto fetal.
Pancreatite Crônica
Evidências recentes indicam que as variantes de perda de função do TRPV6 de ocorrência natural predispõem certos dados demográficos à pancreatite crônica (PC) ao desregular a homeostase do cálcio nas células pancreáticas. Estudos de sequenciamento entre pacientes com pancreatite crônica revelaram a presença de 33 variantes missense e 2 variantes sem sentido , predispondo os pacientes japoneses , alemães e franceses a um risco maior de PC. De modo geral, esses estudos demonstraram que as variantes genômicas com perda de função do TRPV6 que induzem a doença estão sobre-representadas em pacientes com PC alemães, franceses, chineses e japoneses em comparação com os controles em seus respectivos grupos. Acredita-se que as variantes de perda de função comprometam o transporte de cálcio no pâncreas ao reduzir o nível de proteína total e / ou comprometer a atividade de captação de Ca 2+ pelo canal.
Formação de pedra nos rins
O papel do TRPV6 na formação do cálculo renal foi sugerido por meio de estudos de sequenciamento conduzidos em uma coorte de 170 pacientes na Suíça . Os estudos revelaram que a frequência do haplótipo de ganho de função do TRPV6 é significativamente maior nos formadores de cálculos de Ca 2 + ( nefrolitíase ) em comparação com os não formadores. Os fenótipos de hipercalciúria observados em estudos em animais e estudos em polimorfismos de nucleotídeo único (SNPs) do TRPV6 sugerem que o haplótipo do TRPV6 pode ser um fator de risco importante para hipercalciúria absortiva e renal (cálculos renais devido à absorção intestinal prejudicada e reabsorção renal, respectivamente). A menor incidência de doenças de cálculos renais em afro-americanos e uma prevalência relativamente maior de haplótipos ancestrais sugerem a teoria segundo a qual esse haplótipo confere uma vantagem de aumento da reabsorção de Ca 2+ nesse grupo demográfico e reduz a incidência de cálculos renais.
Doenças de reabsorção óssea
Os camundongos TRPV6 KO exibem sintomas semelhantes aos da osteoporose, como densidade mineral óssea reduzida e hipercalciúria. O hormônio estrogênio , cuja deficiência está ligada à osteoporose pós-menopausa , também regula a expressão do TRPV6 em humanos. De fato, uma absorção mais baixa de cálcio observada em mulheres na pós-menopausa é atribuída à redução do TRPV6. A porção C-terminal da Soricidina é uma droga que inibe a atividade de captação de Ca 2+ ao se ligar ao TRPV6. Estudos pré- clínicos com essa droga têm se mostrado muito promissores no tratamento de doenças de reabsorção óssea.
O alto grau de semelhança entre os sintomas da doença hereditária do raquitismo resistente à vitamina D (HVDRR) e os fenótipos observados em camundongos KO TRPV6 levou alguns especialistas a postular conexões patológicas entre a doença e a disfunção do TRPV6. O TRPV6 desempenha um papel condroprotetor importante ao regular vários aspectos da função dos condrócitos , como a secreção da matriz extracelular , a liberação de enzimas degradantes da matriz, a proliferação celular e a apoptose . Além disso, os camundongos knockout para TRPV6 exibem múltiplos fenótipos de osteoartrite (OA), como fibrilação da cartilagem , eburnação e perda de proteoglicanos .
Síndrome Pendred
O gene de disfunção Slc26a4 foi associado à síndrome de Pendred - um distúrbio genético que resulta em surdez sindrômica em crianças. A doença é causada por mutações que comprometem a função da proteína codificada pendrin - um ânion Cl - / HCO3 - trocador expresso na orelha interna. Acredita-se que a perda de função neste gene reduza o valor do pH da endolinfa de mamíferos e prejudique a absorção de Ca 2+ via TRPV5 e TRPV6. Isso, por sua vez, poderia impedir a captação de Ca 2+ e prejudicar a redução luminal da concentração de Ca 2+ no sistema endolinfático do ouvido.
Câncer
A superexpressão de TRPV6 foi validada no câncer de cólon, paratireoide , pancreático e tireoidiano, enquanto sua expressão é supostamente regulada para baixo no câncer de esôfago , câncer de pulmão de células não pequenas e câncer renal . O TRPV6 é considerado um oncocanal que supostamente medeia a progressão do câncer ao desencadear aberrações induzidas pela entrada de Ca 2+ em condutores moleculares que regulam processos como ciclo celular , apoptose e migração ; conferindo assim vantagens proliferativas e de sobrevivência às células cancerosas. A superexpressão de TRPV6 está fortemente correlacionada com o estágio patológico , grau do tumor , invasão extra-prostática, metástase de linfonodo e resistência a terapias direcionadas a andrógenos no câncer de próstata . A expressão TRPV6 tem sido apontada como um marcador prognóstico para câncer de próstata avançado, uma vez que sua expressão é fortemente dependente do grau do tumor. A expressão de TRPV6 é significativamente elevada no tecido de adenocarcinoma da mama em comparação com o tecido normal da mama. A expressão de TRPV6 foi relatada em várias linhas de células de câncer de mama e linhas de células de câncer de próstata. As linhas de células de câncer de próstata PC-3 e LnCAP superexpressam TRPV6 em relação às células epiteliais benignas PrEC e BPH-1. O silenciamento de TRPV6 em células de câncer de próstata diminui a taxa de proliferação, o acúmulo de fase S e a expressão do antígeno nuclear de células em proliferação de marcadores tumorais (PCNA). Acredita-se que a superexpressão de TRPV6 induz a captação aberrante de Ca 2 + - na linha de câncer de próstata e ativa o fator de transcrição do fator nuclear de células T ativadas (NFAT).
A expressão de TRPV6 é regulada positivamente por estrogênio, progesterona e estradiol na linha celular de câncer de mama T47D . De acordo com essas observações, o antagonista do receptor de estrogênio Tamoxifeno reduz a expressão de TRPV6 em células T47D e suprime a captação de Ca 2+ do canal em linhas de células de câncer de mama ER-positivas e ER-negativas . A superexpressão de TRPV6 está associada ao câncer de cólon em estágio inicial e seu silenciamento no câncer de cólon induz a apoptose e inibe a proliferação de células cancerígenas. Em termos de mecanismo, as mutações nos domínios de ligação à calmodulina dos canais TRPV6 conferem propriedades invasivas às células de adenocarcinoma do cólon. As proteínas p38 e GADD45α Acredita-se que regulam positivamente a sinalização expressão TRPV6 em células de cancro do con SW480, aumentando a sinalização de vitamina D. Foi relatado que TRPV6 amplifica a sinalização de PI3K - PDK1 - Akt induzida por fatores de crescimento semelhantes à insulina (IGF) no câncer de cólon humano e promove o câncer de cólon.
O TRPV6 é regulado positivamente em tecidos de câncer primário de pacientes com câncer de pâncreas e promove a proliferação de tumores neuroendócrinos pancreáticos com mecanismos dependentes de NFAT. O silenciamento de TRPV6 induz apoptose e parada do ciclo celular em células de câncer pancreático e inibe sua invasão, proliferação e migração. A expressão forçada de TRPV6 em células de câncer gástrico aumenta sua sensibilidade à apoptose induzida por capsaicina, enquanto o silenciamento do canal mediado por siRNA suprime essa sensibilidade. A regulação negativa do TRPV6 no carcinoma de esôfago foi sugerida como um marcador prognóstico de sobrevida específica da doença em pacientes que sofrem de câncer de esôfago . A baixa coexpressão de TRPV5 e TRPV6 tem sugerido como marcadores preditivos para baixa sobrevida livre de recorrência em câncer de pulmão de células não pequenas .
Direcionamento Farmacológico
Vários inibidores químicos são conhecidos por inibir TRPV6. Alguns compostos que demonstraram atividade inibitória para TRPV6 incluem TH-1177, 2-aminoetoxidifenil borato (2-APB), 2-APB derivado 22b, Econazol , Miconazol , Piperazina derivado Cis-22a, Capsaicina , Δ 9 - tetrahidrocanabivarina , Xestospongin C, Lidocaína , nanopartícula engaiolada em ouro (PTX-PP @ Au NPs) e peptídeo sintético Sorcidina C-13 (SOR-C13). Entre as diferentes estratégias de inibição testadas até agora, o peptídeo de 13 aminoácidos SOR-C13 mostrou-se mais promissor. Este peptídeo de 13 aminoácidos derivado de um peptídeo de 54 aminoácidos encontrado no veneno paralítico do musaranho de cauda curta do norte ( Blarina brevicauda ) reduz o crescimento do câncer em modelos celulares e animais. Este agente anticâncer concluiu recentemente um ensaio clínico de segurança de Fase I que envolveu 23 pacientes com tumores sólidos avançados de origem epitelial não responsivos a todos os tratamentos padrão .
Regulamento
A regulação do TRPV6 pode ser examinada principalmente no contexto de seus fatores fisiológicos, hormonais e moleculares. A regulação hormonal do TRPV6 foi caracterizada de forma mais extensa. A este respeito, a sua regulação pelos D hormona vitamina 3 e hormonas sexuais foi examinado em detalhe considerável. Estudos com roedores sugerem que o canal TRPV6 é regulado por uma ampla gama de fatores fisiológicos, como dieta, idade, sexo, gravidez, lactação, hormônios sexuais, exercícios, idade e sexo. Alguns agentes biológicos e farmacológicos que regulam o TRPV6 incluem glicocorticóides , drogas imunossupressoras e diuréticos .
Vitamina D
Múltiplas doses-resposta e experimentos de curso de tempo em roedores e linhas de células de câncer de cólon mostraram conclusivamente TRPV6 mRNA é fortemente induzido por esta vitamina D em concentrações extremamente baixas. Pelo menos cinco elementos de resposta da vitamina D (VDREs) nas posições −1.2, −2.1, −3.5, −4.3 e −5.5 kb em relação ao local de início da transcrição (TSS) foram identificados nas transcrições de TRPV6. Entre esses cinco locais, VDREs nas posições −1.2, −2.1 e −4.3 kb são significativamente mais responsivos a 1,25- (OH) 2 D 3 em comparação com VDREs localizados em −3,5 e −5,5 kb que não parecem contribuem substancialmente para a regulação da transcrição mediada pela vitamina D no intestino. Em termos de mecanismo, a transcrição do TRPV6 é iniciada em resposta à sinalização mediada pelo receptor da vitamina D (VDR), embora outros mecanismos não diretos não possam ser excluídos. Etapas importantes na regulação da transcrição mediada pela vitamina D incluem 1) ligação da vitamina D em seu receptor de vitamina D cognato (VDR), 2) a translocação do receptor de vitamina D (VDR) - complexo de heterodímero do receptor de retinoide X no núcleo , 3) ligação de VDR Complexo -RXR no promotor do gene TRPV6 , 4) recrutamento do coativador do receptor de esteróide 1 e RNA polimerase II no promotor, e 5) ativação transcricional mediada por eventos de acetilação da histona H4 .
Dieta
O nível de Ca 2+ e vitamina D na dieta são os reguladores mais importantes da expressão do TRPV6. Acredita-se que a expressão de TRPV6 seja fortemente modulada para ajustar a absorção de Ca 2+ da dieta, especialmente sob condições em que a disponibilidade de Ca 2+ na dieta é baixa. Em roedores, a restrição da disponibilidade de Ca 2+ na dieta induz à regulação positiva dramática da expressão duodenal do TRPV6. O influxo de cálcio da dieta e sua subsequente ligação à calbindina-D 9k podem ser a etapa limitante da taxa que modula a regulação dependente da vitamina D, TRPV6. Quando o Ca 2+ na dieta é insuficiente, os níveis normais de cálcio no sangue em camundongos TRPV6 KO são mantidos às custas do osso. Em muitas linhagens de roedores, variações genéticas em TRPV6, calbindina-D 9k , mRNA de PMCA1b influenciam a absorção intestinal de Ca e seu impacto na densidade da medula óssea.
Gravidez e lactação
A expressão duodenal de transcritos de TRPV6 é regulada positivamente em camundongos WT e VDR KO durante a gravidez e lactação . O hormônio prolactina regula positivamente a transcrição do TRPV6 e facilita um aumento na absorção intestinal de Ca 2+ em ratas lactantes e grávidas, possivelmente como um mecanismo adaptativo para superar a perda no conteúdo de mineralização óssea durante a lactação.
Envelhecimento
A expressão intestinal de TRPV6 em camundongos varia dramaticamente com a idade e a localização relativa do tecido. A expressão duodenal de TRPV6 é indetectável em P1 e aumenta 6 vezes à medida que os camundongos envelhecem até P14. Da mesma forma, a expressão também varia com a idade no jejuno , onde os níveis de TRPV6 aumentam de P1 a P14, tornam-se fracos com 1 mês de idade e tornam-se indetectáveis em camundongos mais velhos. A expressão do TRPV6 em ratos mais velhos (12 meses) é pelo menos 50% menor em comparação com os mais jovens (2 meses). Em ambos os camundongos WT e VDR KO, o declínio associado à idade na absorção intestinal de Ca 2+ é acompanhado por um declínio na expressão duodenal de TRPV6.
Hormônios sexuais
Os hormônios sexuais desempenham um papel importante na regulação do TRPV6. Em comparação com camundongos machos, camundongos fêmeas exibem um aumento 2 vezes maior na expressão duodenal de mRNA de TRPV6 após o tratamento com vitamina D. Acredita-se que a regulação diferencial associada ao hormônio sexual do TRPV6 entre os gêneros esteja correlacionada às diferenças no risco relativo de osteoporose em mulheres pós-menopáusicas mais velhas, que foram relatadas como tendo expressão de TRPV6 e VDR mais baixa em comparação com os homens.
O tratamento com estrogênio regula positivamente os transcritos de TRPV6 em 8 vezes em camundongos VDR KO e em 4 vezes em camundongos ovariectomizados . Foi observada redução superior a 50% no mRNA do TRPV6 em camundongos α KO do receptor de estrogênio . Acredita-se que o estrogênio possa estar regulando diferencialmente a absorção de Ca 2+ no duodeno, aumentando a expressão de TRPV6 por meio do ERα. O agente antiprogesterona RU486 e o agente antiestrogênio ICI 182,780 suprimem a expressão de TRPV6 em roedores por sua respectiva ação antagonista nos receptores de progesterona e estrogênio . Estrogênio, progesterona e dexametasona são conhecidos por regular positivamente a expressão de TRPV6 no córtex cerebral e hipotálamo de camundongos, sugerindo um envolvimento potencial de TRPV6 na absorção de cálcio no cérebro .
Glicocorticóides
A administração subcutânea de glicocorticóides dexametasona induz a expressão renal e intestinal de TRPV6 em camundongos dentro de 24 horas, enquanto a aplicação oral de redução de prednisolona em TRPV6 que também é acompanhada por absorção reduzida de Ca 2+ no duodeno. A regulação intestinal do TRPV6 em resposta aos glicocorticóides parece ser dependente do VDR. A enzima sérica e quinase 1 regulada por glicocorticóides ( SKG1 ) regula a expressão de TRPV6 aumentando o fosfatidilinositol-3-fosfato-5-quinase PIKfyve (PIP5K3). Esta quinase é crítica para a geração do mensageiro secundário PIP 2 , um conhecido ativador lipídico do TRPV6.
- TRPV
- TRPV5
- canais de cálcio
- absorção de cálcio
- via transcelular
- mecanismo de bloqueio
- calmodulina
- transporte materno-fetal
- hiperparatireoidismo neonatal transitório
- pancreatite crônica
- pedras nos rins
- Câncer
Referências
Leitura adicional
- Heiner I, Eisfeld J, Lückhoff A (2004). "Papel e regulação dos canais TRP em granulócitos neutrófilos". Cell Calcium . 33 (5–6): 533–40. doi : 10.1016 / S0143-4160 (03) 00058-7 . PMID 12765698 .
- Clapham DE, Julius D, Montell C, Schultz G (dezembro de 2005). "União Internacional de Farmacologia. XLIX. Nomenclatura e relações estrutura-função de canais potenciais de receptor transiente". Revisões farmacológicas . 57 (4): 427–50. doi : 10.1124 / pr.57.4.6 . PMID 16382100 . S2CID 17936350 .
- Wissenbach U, Niemeyer BA (2007). "TRPV6". Canais de potencial de receptor transiente (TRP) . Handbook of Experimental Pharmacology. 179 . pp. 221–34. doi : 10.1007 / 978-3-540-34891-7_13 . ISBN 978-3-540-34889-4. PMID 17217060 .
- Schoeber JP, Hoenderop JG, Bindels RJ (fevereiro de 2007). "Ação combinada de proteínas associadas na regulação de TRPV5 e TRPV6". Biochemical Society Transactions . 35 (Pt 1): 115–9. doi : 10.1042 / BST0350115 . PMID 17233615 .
links externos
- TRPV + cátion + canais na Biblioteca Nacional de Medicina dos Estados Unidos. Cabeçalhos de assuntos médicos (MeSH)
- TRPV6 + proteína + humana na Biblioteca Nacional de Medicina dos EUA Medical Subject Headings (MeSH)





