Hexafluoreto de enxofre - Sulfur hexafluoride
|
|
|||

|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Hexafluoreto de enxofre
|
|||
|
Nome IUPAC sistemático
Hexafluoro-λ 6 -sulfano |
|||
| Outros nomes
Elagas
Esaflon |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard |
100.018.050 |
||
| Número EC | |||
| 2752 | |||
| KEGG | |||
| Malha | Enxofre + hexafluoreto | ||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
| Número ONU | 1080 | ||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| SF 6 | |||
| Massa molar | 146,06 g / mol | ||
| Aparência | Gás incolor | ||
| Odor | inodoro | ||
| Densidade | 6,17 g / L | ||
| Ponto de fusão | -64 ° C; -83 ° F; 209 K | ||
| Ponto de ebulição | −50,8 ° C (−59,4 ° F; 222,3 K) | ||
| Ponto crítico ( T , P ) | 45,51 ± 0,1 ° C ,3,749 ± 0,01 MPa | ||
| 0,003% (25 ° C) | |||
| Solubilidade | ligeiramente solúvel em água, muito solúvel em etanol, hexano, benzeno | ||
| Pressão de vapor | 2,9 MPa (a 21,1 ° C) | ||
| −44,0 × 10 −6 cm 3 / mol | |||
| Condutividade térmica | |||
| Viscosidade | 15,23 μPa · s | ||
| Estrutura | |||
| Ortorrômbico , oP28 | |||
| O h | |||
| Hexagonal ortogonal | |||
| Octaédrico | |||
| 0 D | |||
| Termoquímica | |||
|
Capacidade de calor ( C )
|
0,097 kJ / (mol · K) (pressão constante) | ||
|
Entropia molar padrão ( S |
292 J · mol −1 · K −1 | ||
| −1209 kJ · mol −1 | |||
| Farmacologia | |||
| V08DA05 ( OMS ) | |||
| Dados de licença | |||
| Perigos | |||
| Ficha de dados de segurança | MSDS externo | ||
| Frases S (desatualizado) | S38 | ||
| NFPA 704 (diamante de fogo) | |||
| NIOSH (limites de exposição à saúde dos EUA): | |||
|
PEL (permitido)
|
TWA 1000 ppm (6000 mg / m 3 ) | ||
|
REL (recomendado)
|
TWA 1000 ppm (6000 mg / m 3 ) | ||
|
IDLH (perigo imediato)
|
WL | ||
| Compostos relacionados | |||
|
Fluoretos de enxofre relacionados
|
Decafluoreto de dissulfur |
||
|
Compostos relacionados
|
Hexafluoreto de selênio Fluoreto de sulfuril |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O hexafluoreto de enxofre (SF 6 ) ou hexafluoreto de enxofre ( grafia britânica ) é um gás de efeito estufa extremamente potente e persistente, utilizado principalmente como isolante elétrico e supressor de arco . É inorgânico , incolor, inodoro, não inflamável e não tóxico. SF
6tem uma geometria octaédrica , consistindo de seis átomos de flúor ligados a um átomo de enxofre central . É uma molécula hipervalente .
Típico para um gás não polar , SF
6é pouco solúvel em água, mas bastante solúvel em solventes orgânicos não polares. Tem uma densidade de 6,12 g / L em condições ao nível do mar, consideravelmente superior à densidade do ar (1,225 g / L). Geralmente é transportado como um gás comprimido liquefeito .
A concentração de SF
6na troposfera da Terra atingiu 10 partes por trilhão (ppt) no ano de 2019, aumentando em 0,35 ppt / ano. O aumento nos 40 anos anteriores foi impulsionado em grande parte pela expansão do setor de energia elétrica, incluindo emissões fugitivas de bancos de SF
6gás contido em seu quadro de distribuição de média e alta tensão . Os usos na fabricação de magnésio, alumínio e eletrônicos também aceleraram o crescimento atmosférico.
Síntese e reações
O hexafluoreto de enxofre na Terra existe principalmente como um gás industrial feito pelo homem e também foi encontrado para ocorrer naturalmente.
SF
6pode ser preparado a partir dos elementos por meio da exposição de S
8para F
2. Este também foi o método usado pelos descobridores Henri Moissan e Paul Lebeau em 1901. Alguns outros fluoretos de enxofre são cogerados, mas são removidos por aquecimento da mistura para desproporcionalmente qualquer S
2F
10(que é altamente tóxico) e, em seguida, esfregar o produto com NaOH para destruir SF restante
4.
Alternativamente, utilizando bromo , hexafluoreto de enxofre pode ser sintetizado a partir de SF 4 e CoF 3 em temperaturas mais baixas (por exemplo, 100 ° C), como segue:
Praticamente não há química de reação para SF
6. Uma contribuição principal para a inércia do SF 6 é o impedimento estérico do átomo de enxofre, enquanto suas contrapartes do grupo 16 mais pesadas, como SeF 6, são mais reativas do que o SF 6 como resultado de menor impedimento estérico (ver exemplo de hidrólise). Não reage com o sódio fundido abaixo de seu ponto de ebulição, mas reage exotermicamente com o lítio .
Formulários
A indústria de energia elétrica utilizou cerca de 80% do hexafluoreto de enxofre produzido no ano 2000, principalmente como meio dielétrico gasoso . Outros usos principais a partir do ano de 2015 incluíam um condicionador de silício para a fabricação de semicondutores e um gás inerte para a fundição de magnésio .
Meio dielétrico
SF
6 é usado na indústria elétrica como um meio dielétrico gasoso para disjuntores de hexafluoreto de enxofre de alta tensão , painéis de manobra e outros equipamentos elétricos , muitas vezes substituindo disjuntores cheios de óleo (OCBs) que podem conter bifenilos policlorados (PCBs) prejudiciais . SF
6o gás sob pressão é usado como isolante em disjuntores isolados a gás (GIS) porque tem uma rigidez dielétrica muito maior do que o ar ou nitrogênio seco . A alta rigidez dielétrica é resultado da alta eletronegatividade e densidade do gás . Esta propriedade permite reduzir significativamente o tamanho do equipamento elétrico. Isso torna o GIS mais adequado para determinados fins, como colocação em ambientes internos, em oposição a equipamentos elétricos isolados a ar, que ocupam muito mais espaço.
Os equipamentos elétricos isolados a gás também são mais resistentes aos efeitos da poluição e do clima, além de serem mais confiáveis em operações de longo prazo devido ao seu ambiente operacional controlado. A exposição a um arco quebra quimicamente o SF
6embora a maioria dos produtos de decomposição tendam a reformar rapidamente o SF
6, um processo denominado "autocura". Arco ou corona pode produzir dissulfureto decafluoreto ( S
2F
10), um gás altamente tóxico , com toxicidade semelhante ao fosgênio . S
2F
10foi considerado um potencial agente de guerra química na Segunda Guerra Mundial porque não produz lacrimejamento ou irritação na pele, fornecendo assim poucos avisos de exposição.
SF
6também é comumente encontrado como um dielétrico de alta tensão em fontes de alta tensão de aceleradores de partículas , como geradores Van de Graaff e Pelletrons e microscópios eletrônicos de transmissão de alta tensão .
Alternativas para SF
6como um gás dielétrico incluem várias fluorocetonas. A tecnologia GIS compacta que combina a comutação de vácuo com isolamento de ar limpo foi introduzida para um subconjunto de aplicações de até 420 kV .
Uso médico
SF
6é usado para fornecer um tamponamento ou tampão de um orifício da retina em operações de reparo do descolamento da retina na forma de uma bolha de gás. É inerte na câmara vítrea e inicialmente dobra seu volume em 36 horas antes de ser absorvido pelo sangue em 10–14 dias.
SF
6é usado como agente de contraste para imagens de ultrassom . Microbolhas de hexafluoreto de enxofre são administradas em solução por meio de injeção em uma veia periférica. Essas microbolhas aumentam a visibilidade dos vasos sanguíneos ao ultrassom. Este aplicativo tem sido usado para examinar a vascularização de tumores. Ele permanece visível no sangue por 3 a 8 minutos e é exalado pelos pulmões.
Composto traçador
O hexafluoreto de enxofre foi o gás traçador usado na primeira calibração do modelo de dispersão de ar em rodovias ; este programa de pesquisa foi patrocinado pela Agência de Proteção Ambiental dos Estados Unidos e conduzido em Sunnyvale, Califórnia, na rodovia 101 dos Estados Unidos . SF gasoso
6é usado como um gás traçador em experimentos de curto prazo de eficiência de ventilação em edifícios e recintos fechados e para determinar as taxas de infiltração . Dois fatores principais recomendam seu uso: sua concentração pode ser medida com precisão satisfatória em concentrações muito baixas, e a atmosfera da Terra tem uma concentração desprezível de SF
6.
O hexafluoreto de enxofre foi usado como um gás de teste não tóxico em um experimento na estação de tubo de St. John's Wood em Londres , Reino Unido, em 25 de março de 2007. O gás foi liberado por toda a estação e monitorado enquanto circulava. O objetivo do experimento, que havia sido anunciado no início de março pelo Secretário de Estado dos Transportes Douglas Alexander , era investigar como o gás tóxico pode se espalhar pelas estações e prédios do metrô de Londres durante um ataque terrorista.
O hexafluoreto de enxofre também é usado rotineiramente como gás traçador em testes de contenção de capelas de exaustão de laboratório. O gás é utilizado na etapa final de qualificação da coifa ASHRAE 110. Uma pluma de gás é gerada dentro da coifa e uma bateria de testes é realizada enquanto um analisador de gás disposto fora da coifa coleta amostras de SF 6 para verificar as propriedades de contenção da coifa.
Tem sido usado com sucesso como um traçador em oceanografia para estudar a mistura diapycnal e as trocas gasosas ar-mar.
Outros usos
- A indústria de magnésio usa SF
6como um "gás de cobertura" inerte para evitar a oxidação durante a fundição . Outrora o maior usuário, o consumo diminuiu muito com a captura e a reciclagem. - As janelas de vidros isolados o utilizam como enchimento para melhorar seu desempenho de isolamento térmico e acústico.
-
SF
6 o plasma é usado na indústria de semicondutores como um decapante em processos como o ataque profundo de íons reativos . Uma pequena fração do SF
6 decompõe-se no plasma em enxofre e flúor, com os íons de flúor realizando uma reação química com o silício. - Pneus cheios com ele demoram mais para esvaziar da difusão através da borracha devido ao tamanho maior da molécula.
- Da mesma forma, a Nike o usou para obter uma patente e para encher os sacos de almofada em todos os seus sapatos com a marca "Air" de 1992 a 2006. 277 toneladas foram usadas durante o pico em 1997.
- A Marinha dos Estados Unidos 's Mark 50 torpedo fechado de Rankine-ciclo sistema de propulsão é alimentado por hexafluoreto de enxofre numa reacção exotérmica com sólido de lítio .
- Os guias de ondas em sistemas de micro - ondas de alta potência são pressurizados com ele. O gás isola eletricamente o guia de ondas, evitando o arco interno.
- Alto-falantes eletrostáticos o têm usado por causa de sua alta rigidez dielétrica e alto peso molecular.
- O decafluoreto de dissulfur, arma química, é produzido com ele como matéria - prima .
- Para fins de entretenimento, quando respirado, SF
6faz com que a voz se torne significativamente mais profunda, devido à sua densidade ser muito maior do que o ar, como pode ser visto neste vídeo . Isso está relacionado ao efeito mais conhecido de respirar hélio de baixa densidade , que faz com que a voz de alguém fique muito mais alta. Ambos os efeitos devem ser tentados com cautela, pois esses gases deslocam o oxigênio que os pulmões estão tentando extrair do ar. O hexafluoreto de enxofre também é levemente anestésico. - Para demonstrações de ciência / magia como "água invisível", já que um barco leve pode flutuar em um tanque, assim como um balão cheio de ar.
Gás de efeito estufa
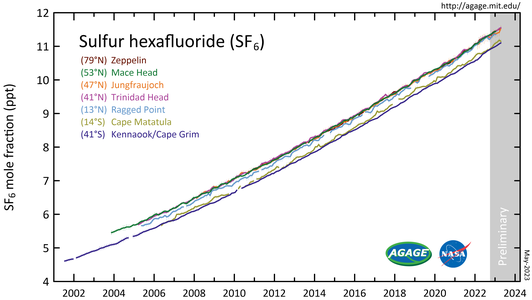
Hexafluoreto de enxofre (SF 6 ) medido pelo Experimento Avançado de Gases Atmosféricos Globais ( AGAGE ) na baixa atmosfera ( troposfera ) em estações ao redor do mundo. Abundâncias são dadas como frações molares médias mensais livres de poluição em partes por trilhão .
De acordo com o Painel Intergovernamental sobre Mudanças Climáticas , SF
6é o gás de efeito estufa mais potente que já foi avaliado, com um potencial de aquecimento global 23.900 vezes maior do que o CO
2quando comparado ao longo de um período de 100 anos. O hexafluoreto de enxofre é inerte na troposfera e estratosfera e tem uma vida extremamente longa, com uma vida útil atmosférica estimada de 800–3.200 anos.
As medições de SF 6 mostram que sua taxa de mistura média global aumentou de uma base estável de cerca de 54 partes por quatrilhão antes da industrialização, para mais de 10 partes por trilhão (ppt) em abril de 2020, e está aumentando em cerca de 0,35 ppt (3,5 por cento) por ano. As concentrações médias globais de SF 6 aumentaram cerca de sete por cento ao ano durante as décadas de 1980 e 1990, principalmente como resultado de seu uso na produção de magnésio e por empresas de eletricidade e fabricantes de eletrônicos. Dadas as pequenas quantidades de SF 6 liberadas em comparação com o dióxido de carbono , sua contribuição individual geral para o aquecimento global é estimada em menos de 0,2 por cento, no entanto, a contribuição coletiva dele e de gases halogenados artificiais semelhantes atingiu cerca de 10 por cento no ano 2020. Alternativas estão sendo testadas.
Na Europa, SF
6se enquadra na diretriz de gases fluorados que proíbe ou controla seu uso para várias aplicações. Desde 1 de janeiro de 2006, SF
6é proibido como gás traçador e em todas as aplicações, exceto aparelhagem de alta tensão . Foi relatado em 2013 que um esforço de três anos do Departamento de Energia dos Estados Unidos para identificar e corrigir vazamentos em seus laboratórios nos Estados Unidos, como o Laboratório de Física de Plasma de Princeton , onde o gás é usado como isolante de alta tensão, teve foi produtivo, reduzindo os vazamentos anuais em 1.030 kg (2.280 libras). Isso foi feito comparando as compras com o estoque, presumindo que a diferença havia vazado e, em seguida, localizando e consertando os vazamentos.
Efeitos fisiológicos e precauções
O hexafluoreto de enxofre é um gás não tóxico, mas, ao deslocar o oxigênio nos pulmões, também apresenta o risco de asfixia se for inalado em excesso. Por ser mais denso que o ar, uma quantidade substancial de gás, quando liberada, se estabelecerá em áreas baixas e apresentará um risco significativo de asfixia se a área for penetrada. Isso é particularmente relevante para seu uso como isolante em equipamentos elétricos, uma vez que os trabalhadores podem estar em trincheiras ou fossos abaixo de equipamentos contendo SF
6.
Tal como acontece com todos os gases, a densidade de SF
6afeta as frequências de ressonância do trato vocal, alterando drasticamente as qualidades do som vocal, ou timbre , de quem o inspira. Não afeta as vibrações das pregas vocais. A densidade do hexafluoreto de enxofre é relativamente alta em temperatura e pressão ambientes devido à grande massa molar do gás . Ao contrário do hélio , que tem uma massa molar de cerca de 4 g / mol e aumenta a voz, SF
6tem uma massa molar de cerca de 146 g / mol e a velocidade do som através do gás é de cerca de 134 m / s à temperatura ambiente, diminuindo a voz. Para comparação, a massa molar do ar, que é cerca de 80% de nitrogênio e 20% de oxigênio, é de aproximadamente 30 g / mol, o que leva a uma velocidade do som de 343 m / s.
O hexafluoreto de enxofre tem uma potência anestésica ligeiramente inferior à do óxido nitroso ; é classificado como um anestésico suave.
Veja também
- Hexafluoreto de selênio
- Hexafluoreto de telúrio
- Hexafluoreto de urânio
- Molécula hipervalente
- Halocarbon - outro grupo dos principais gases de efeito estufa
- Pentafluoreto trifluorometilsulfur , um gás semelhante
Referências
Leitura adicional
- "Hexafluoreto de enxofre" . Air Liquide Gas Encyclopedia. Arquivado do original em 31 de março de 2012 . Retirado em 22 de fevereiro de 2013 .
- Christophorou, Loucas G .; Isidor Sauers , eds. (1991). Gasous Dielectrics VI . Plenum Press. ISBN 978-0-306-43894-3.
- Holleman, AF; Wiberg, E. (2001). Química Inorgânica . San Diego: Academic Press. ISBN 0-12-352651-5.
- Khalifa, Mohammad (1990). Engenharia de alta tensão: teoria e prática . Nova York: Marcel Dekker. ISBN 978-0-8247-8128-6. OCLC 20595838 .
- Maller, VN; Naidu, MS (1981). Vantagens em Isolamento de Alta Tensão e Interrupção de Arco em SF 6 e Vácuo . Oxford; Nova York: Pergamon Press. ISBN 978-0-08-024726-7. OCLC 7866855 .
- Parceria de redução de SF 6 para sistemas de energia elétrica
- Matt McGrath (13 de setembro de 2019). "Mudanças climáticas: 'segredo sujo' da indústria elétrica aumenta o aquecimento" . BBC News . Recuperado em 14 de setembro de 2019 .