Risdiplam - Risdiplam
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Evrysdi |
| Outros nomes | RG7916; RO7034067 |
| AHFS / Drugs.com | Monografia |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Pela boca |
| Código ATC | |
| Status legal | |
| Status legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Dados químicos e físicos | |
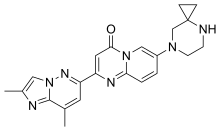
| Fórmula | C 22 H 23 N 7 O |
| Massa molar | 401,474 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
Risdiplam , vendido sob a marca Evrysdi , é um medicamento usado para tratar a atrofia muscular espinhal (SMA) e o primeiro medicamento oral aprovado para tratar esta doença.
Risdiplam é uma sobrevivência do modificador de splicing de RNA dirigido por neurônio motor 2 .
Em estudos clínicos, os eventos adversos mais comuns incluíram febre, diarreia, erupção cutânea, úlceras na área da boca, dor nas articulações (artralgia) e infecções do trato urinário. Os eventos adversos adicionais observados na população de início infantil incluíram infecção do trato respiratório superior, pneumonia, constipação e vômitos.
O Risdiplam foi aprovado pela Food and Drug Administration (FDA) dos Estados Unidos em agosto de 2020, para o tratamento de adultos e crianças com dois meses de idade ou mais. Desenvolvido em associação com a PTC Therapeutics e a SMA Foundation , é comercializado nos Estados Unidos pela Genentech , uma subsidiária da Roche .
Usos médicos
Nos Estados Unidos, o risdiplam é indicado para tratar pessoas com dois meses de idade ou mais com atrofia muscular espinhal.
Efeitos adversos
Em dois ensaios clínicos, os seguintes eventos adversos ocorreram pelo menos 5% mais frequentemente em pacientes tratados com risdiplam do que no grupo de placebo: febre, diarreia, erupção cutânea, úlceras na área da boca, dor nas articulações (artralgia) e infecções do trato urinário. Os eventos adversos adicionais para a população de início infantil incluíram infecção do trato respiratório superior, pneumonia, constipação e vômitos.
Risdiplam não deve ser tomado junto com medicamentos que são substratos multifármacos e de extrusão de toxina (MATE) porque o risdiplam pode aumentar as concentrações plasmáticas desses medicamentos.
Farmacologia
Mecanismo de ação
Risdiplam aborda a causa subjacente da SMA: uma quantidade reduzida de proteína do neurônio motor de sobrevivência (SMN). A proteína é codificada pelos genes SMN1 e SMN2 . A SMA é causada por mutações no SMN1 que codificam as formas inativas da proteína. A atividade do gene SMN2 , que produz quantidades muito menores de SMN, tende a determinar a gravidade da doença.
O composto é um derivado de piridazina que modifica o splicing do RNA mensageiro de SMN2 para incluir o exon 7, resultando em um aumento na concentração da proteína SMN funcional in vivo .
Nusinersen , o primeiro medicamento aprovado para tratar SMA, um oligonucleotídeo anti-sentido direcionado ao silenciador de splicing intrônico N1 (ISS-N1), também altera o splicing de mRNA de SMN2 .
Eficácia
A segurança e eficácia do risdiplam em SMA infantil e de início tardio foram avaliadas em ensaios clínicos em curso .
No estudo SMA de início infantil, um ensaio aberto com 41 participantes, a eficácia foi estabelecida com base na capacidade de sentar sem apoio por pelo menos cinco segundos. Após 12 meses de tratamento, 29% dos participantes conseguiram sentar-se independentemente por mais de cinco segundos. Após 23 ou mais meses de tratamento, 81% dos participantes estavam vivos sem ventilação permanente. Embora o estudo não tenha feito comparações diretas com crianças que receberam placebo (tratamento inativo), esses resultados se comparam favoravelmente com o curso típico da doença não tratada.
O estudo de SMA de início tardio foi um ensaio randomizado controlado que envolveu 180 participantes, com idades entre 2 e 25 anos, com formas menos graves da doença. Os participantes tratados com risdiplam por 12 meses mostraram melhorias na função motora em comparação com os participantes que receberam um placebo.
Um estudo aberto de fase II-III envolveu 21 bebês com idade de 1 mês a 7 meses e concluiu sua determinação de dose e fase inicial de segurança em 2021. Retinotoxicidade, um efeito colateral observado em modelos animais, não foi observada na população do estudo. Ele também mostrou um aumento nos níveis sanguíneos da proteína SMN funcional.
Sociedade e cultura
Status legal
A Food and Drug Administration (FDA) dos EUA concedeu a aprovação de marketing à Genentech em 7 de agosto de 2020. A FDA concedeu anteriormente o pedido de risdiplam fast track , revisão de prioridade e designações de medicamentos órfãos . A Genentech também recebeu um voucher de revisão prioritária para doenças pediátricas raras .
A Agência Europeia de Medicamentos (EMA) concedeu ao risdiplam uma designação de medicamento prioritário em 2018 e uma designação de medicamento órfão em 2019.
Em agosto de 2020, a Roche solicitou autorização de comercialização no Brasil, Chile, China, União Europeia, Indonésia, Rússia, Coréia do Sul e Taiwan.
Nomes
Risdiplam é o nome não proprietário internacional (DCI).
Uso compassivo
Desde o final de 2019, a Roche oferece o medicamento globalmente de graça para pessoas qualificadas por meio de um programa de acesso expandido .
Referências
Leitura adicional
- Dhillon S (novembro de 2020). "Risdiplam: Primeira aprovação". Drogas . Berlim , Alemanha / Heidelberg , Alemanha / Cham , Suíça : Adis International / Springer Nature Switzerland AG (Springer Nature) . 80 (17): 1853–1858. doi : 10.1007 / s40265-020-01410-z . OCLC 01566990 . PMID 33044711 . S2CID 222279898 .
- Ratni H, Scalco RS, Stephan AH (28 de janeiro de 2021). "Risdiplam, o primeiro medicamento modificador de splicing de moléculas pequenas aprovado como um projeto para medicamentos transformadores futuros". ACS Medicinal Chemistry Letters . Washington, DC : Publicações ACS ( American Chemical Society ). 12 (6): 11021-11036. doi : 10.1021 / acsmedchemlett.0c00659 . ISSN 1948-5875 . OCLC 643819990 . PMC 8201486. PMID 34141064 .
links externos
- "Risdiplam" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- Número do ensaio clínico NCT02913482 para "Investigar Segurança, Tolerabilidade, PK, PD e Eficácia de Risdiplam (RO7034067) em bebês com atrofia muscular espinhal tipo 1 (FIREFISH)" em ClinicalTrials.gov
- Número do ensaio clínico NCT02908685 para "Um Estudo para Investigar a Segurança, Tolerabilidade, Farmacocinética, Farmacodinâmica e Eficácia do Risdiplam (RO7034067) em Participantes da Atrofia Muscular Espinhal (SMA) Tipo 2 e 3 (SUNFISH)" em ClinicalTrials.gov
