Quinazoline - Quinazoline
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Quinazoline |
|||
| Outros nomes
1,3-diazanaphthalene
benzopirimidina fenmiazina benzo-1,3-diazina |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100,005,424 |
||
| Número EC | |||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 8 H 6 N 2 | |||
| Massa molar | 130,150 g · mol −1 | ||
| Aparência | cristais amarelos claros | ||
| Densidade | 1,351 g / cm 3 , sólido | ||
| Ponto de fusão | 48 ° C (118 ° F; 321 K) | ||
| Ponto de ebulição | 243 ° C (469 ° F; 516 K) | ||
| Solúvel | |||
| Acidez (p K a ) | 3,51 | ||
| Estrutura | |||
| 2,2 D | |||
| Perigos | |||
| Riscos principais | Irritante | ||
| Ficha de dados de segurança | MSDS externo | ||
| Pictogramas GHS |

|
||
| Palavra-sinal GHS | Aviso | ||
| H315 , H319 , H335 | |||
| P261 , P264 , P271 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |||
| Ponto de inflamação | 106 ° C (223 ° F; 379 K) | ||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
A quinazolina é um composto orgânico com a fórmula C 8 H 6 N 2 . É um heterociclo aromático com uma estrutura bicíclica que consiste em dois anéis aromáticos fundidos de seis membros, um anel de benzeno e um anel de pirimidina . É um sólido cristalino amarelo claro que é solúvel em água. Também conhecida como 1,3-diazanaphthalene, quinazoline recebeu seu nome por ser um derivado aza da quinolina . Embora a molécula original de quinazolina seja raramente mencionada por si mesma na literatura técnica, derivados substituídos foram sintetizados para fins medicinais, como agentes antimaláricos e anticâncer. A quinazolina é uma molécula plana. É isomérico com os outros diazanaftalenos do subgrupo das benzodiazinas : cinolina , quinoxalina e ftalazina . Mais de 200 alcalóides de quinazolina e quinolina biologicamente ativos são identificados.
Síntese
A síntese da quinazolina foi relatada pela primeira vez em 1895 por August Bischler e Lang por meio da descarboxilação do derivado 2-carboxi (ácido quinazolina-2-carboxílico). Em 1903, Siegmund Gabriel relatou a síntese da quinazolina original a partir de o- nitrobenzilamina, que foi reduzida com iodeto de hidrogênio e fósforo vermelho a 2-amino benzilamina . O intermediário reduzido condensa-se com ácido fórmico para produzir diidroquinazolina, que foi oxidada a quinazolina.
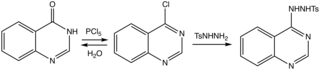
Os métodos foram revisados. Uma rota eficiente para o heterociclo parental prossegue através do derivado 4-cloro para a tosilhidrazida, que é removida pela base.
Reações
Reações de hidratação e adição
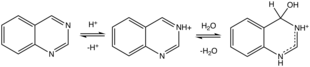
Protonatos de quinazolina (e metilatos) em N3. A protonação induz hidratação. Muitos substratos levemente ácidos são adicionados através da ligação C = N3, incluindo cianeto de hidrogênio , bissulfito de sódio e metil cetonas.
Hidrólise
Em solução quente, a quinazolina hidrolisa sob condições ácidas e alcalinas em 2-aminobenzaldeído (ou os produtos de sua autocondensação) e ácido fórmico e amônia / amônio.
Substituição eletrofílica e nucleofílica
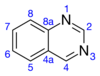
O anel de pirimidina resiste à substituição eletrofílica, embora a posição 4 seja mais reativa do que a posição 2. Em comparação, o anel benzênico é mais suscetível à substituição eletrofílica. A ordem de reatividade da posição do anel é 8> 6> 5> 7. Os derivados 2- e 4-halo da quinazolina sofrem deslocamento por nucleófilos, como a piperidina.
Significado biológico e farmacológico
Gefitinib
Em maio de 2003, a Food and Drug Administration (FDA) dos EUA aprovou a quinazolina gefitinibe . A droga, produzida pela AstraZeneca , é um inibidor da proteína quinase do receptor do fator de crescimento epidérmico (EGFR). Ele se liga ao sítio de ligação de ATP do EGFR, inativando assim a cascata de transdução de sinal Ras anti-apoptótica, evitando o crescimento adicional de células cancerosas.
Lapatinib
Em Março de 2007, GlaxoSmithKline 's drogas lapatinib foi aprovado pelo FDA dos Estados Unidos para o tratamento de estádio avançado ou do cancro da mama metastático em combinação com Roche ' s capecitabina . O lapatinib elimina o crescimento das células-tronco do câncer de mama que causam o crescimento do tumor. A ligação do lapatinib ao local de ligação do ATP no EGFR e nos domínios da proteína quinase do receptor do fator de crescimento epidérmico humano (HER2) inibe a ativação do mecanismo de sinal (por meio de inibição competitiva reversível).
Erlotinib
Em maio de 2013, o erlotinibe , um medicamento fabricado pela Astellas , foi aprovado pelo FDA dos EUA para tratar pacientes com NSCLC com tumores causados por mutações de EGFR. A ligação do erlotinibe aos locais de ligação do ATP dos receptores EGFR impede que o EGFR produza resíduos de fosfotirosina (devido à inibição competitiva), tornando o receptor incapaz de gerar cascatas de sinal para promover o crescimento celular.
Afatinib
Em julho de 2013, o FDA dos EUA aprovou o afatinibe , um medicamento desenvolvido pela Boehringer Ingelheim , como um inibidor competitivo irreversível das quinases HER2 e EGFR. Embora o afatinibe demonstre um mecanismo semelhante ao laptinibe no qual atua como um inibidor irreversível de HER2 e EGFR, o afatinibe também demonstrou atividade contra tirosina quinases que se tornaram resistentes a gefinitibe e erlotinibe.
- Medicamentos contendo quinazolina
Gefitinibe para o tratamento de carcinoma pulmonar de células não pequenas .
Lapatinibe para tratamento de câncer de mama em estágio avançado ou metastático.
Erlotinib , um agente antitumoral.
Afatinibe para o tratamento de cânceres resistentes a gefinitibe e erlotinibe.