Constante de Planck - Planck constant
| Constante de Planck | |
|---|---|
 Placa na Universidade Humboldt de Berlim : "Max Planck, que descobriu o quantum elementar da ação , ensinou aqui de 1889 a 1928."
| |
Símbolos comuns |
, ou para a constante de Planck reduzida |
| Dimensão | |
A constante de Planck , ou constante de Planck , é uma constante física fundamental denotada e é de importância fundamental na mecânica quântica . A energia de um fóton é igual à sua frequência multiplicada pela constante de Planck. Devido à equivalência massa-energia , a constante de Planck também relaciona a massa à frequência.
Em metrologia , é usado, junto com outras constantes, para definir o quilograma , uma unidade SI . As unidades SI são definidas de tal forma que, quando a constante de Planck é expressa em unidades SI, ela tem o valor exato =6,626 070 15 × 10 −34 J⋅Hz −1 .
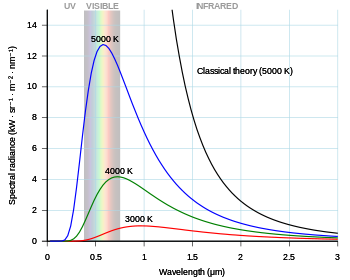
No final do século 19, existiam medições precisas do espectro da radiação do corpo negro, mas as previsões da distribuição de frequência da radiação pelas teorias então existentes divergiam significativamente nas frequências mais altas. Em 1900, Max Planck derivou empiricamente uma fórmula para o espectro observado. Ele presumiu que um hipotético oscilador eletricamente carregado em uma cavidade que continha radiação de corpo negro só poderia alterar sua energia em um incremento mínimo, que fosse proporcional à frequência de sua onda eletromagnética associada . Ele foi capaz de calcular a constante de proporcionalidade a partir das medições experimentais, e essa constante é nomeada em sua homenagem. Em 1905, Albert Einstein determinou um "quantum" ou elemento mínimo da energia da própria onda eletromagnética. O quantum de luz se comportou em alguns aspectos como uma partícula eletricamente neutra e acabou sendo chamado de fóton . Max Planck recebeu o Prêmio Nobel de Física em 1918 "em reconhecimento aos serviços que prestou ao avanço da Física por sua descoberta dos quanta de energia".
A confusão pode surgir ao lidar com a frequência ou a constante de Planck porque as unidades de medida angular (ciclo ou radiano) são omitidas no SI. Na linguagem do cálculo de quantidade , a expressão para o valor da constante de Planck, ou uma frequência, é o produto de um valor numérico e uma unidade de medida. O símbolo f (ou ν ), quando usado para o valor de uma frequência, implica ciclos por segundo ou hertz como unidade. Quando o símbolo ω é usado para o valor da frequência, ele implica radianos por segundo como unidade. Os valores numéricos dessas duas formas de expressar a frequência têm uma relação de 2 π . A omissão das unidades de medida angular "ciclo" e "radiano" pode levar a um erro de 2 π . Um estado de coisas semelhante ocorre para a constante de Planck. O símbolo h é usado para expressar o valor da constante de Planck em J⋅s / ciclo, e o símbolo ħ ("h-bar") é usado para expressar seu valor em J⋅s / rad. Ambos representam o valor da constante de Planck, mas, como discutido acima, seus valores numéricos têm uma razão de 2 π . Neste artigo, a palavra "valor", conforme usada nas tabelas, significa "valor numérico" e as equações que envolvem a constante e / ou frequência de Planck envolvem realmente seus valores numéricos usando as unidades implícitas apropriadas.
| Constante | Unidades SI | Unidades com eV |
|---|---|---|
| h | 6,626 070 15 × 10 −34 J⋅Hz −1 | 4.135 667 696 ... × 10 −15 eV⋅Hz −1 |
| ħ | 1.054 571 817 ... × 10 −34 J⋅s | 6,582 119 569 ... × 10 −16 eV⋅s |
| hc | 1,986 445 86 ... × 10 −25 J ⋅ m | 1.239 841 98 ... eV ⋅ μm |
| ħc | 3,161 526 77 ... × 10 −26 J ⋅ m | 0,197 326 9804 ... eV ⋅ μm |
Origem da constante

A constante de Planck foi formulada como parte do esforço bem-sucedido de Max Planck para produzir uma expressão matemática que predisse com precisão a distribuição espectral observada da radiação térmica de um forno fechado ( radiação de corpo negro ). Essa expressão matemática agora é conhecida como lei de Planck.
Nos últimos anos do século 19, Max Planck estava investigando o problema da radiação de corpo negro apresentado pela primeira vez por Kirchhoff cerca de 40 anos antes. Todo corpo físico emite espontânea e continuamente radiação eletromagnética . Não houve expressão ou explicação para a forma geral do espectro de emissão observado. Na época, a lei de Wien ajustava os dados para comprimentos de onda curtos e altas temperaturas, mas falhou para comprimentos de onda longos. Também nessa época, mas sem o conhecimento de Planck, Lord Rayleigh derivou teoricamente uma fórmula, agora conhecida como a lei de Rayleigh-Jeans , que poderia prever razoavelmente comprimentos de onda longos, mas falhou dramaticamente em comprimentos de onda curtos.
Abordando esse problema, Planck formulou a hipótese de que as equações de movimento da luz descrevem um conjunto de osciladores harmônicos , um para cada frequência possível. Ele examinou como a entropia dos osciladores variava com a temperatura do corpo, tentando corresponder à lei de Wien, e foi capaz de derivar uma função matemática aproximada para o espectro do corpo negro, o que deu uma fórmula empírica simples para comprimentos de onda longos.
Planck tentou encontrar uma expressão matemática que pudesse reproduzir a lei de Wien (para comprimentos de onda curtos) e a fórmula empírica (para comprimentos de onda longos). Essa expressão incluía uma constante, que se pensa ser de Hilfsgrösse (variável auxiliar) e, posteriormente, tornou-se conhecida como a constante de Planck. A expressão formulada por Planck mostrou que a radiância espectral de um corpo para a frequência ν à temperatura absoluta T é dada por
onde está a constante de Boltzmann , é a constante de Planck e é a velocidade da luz no meio, seja material ou vácuo.
A radiância espectral de um corpo descreve a quantidade de energia que ele emite em diferentes frequências de radiação. É a potência emitida por unidade de área do corpo, por unidade de ângulo sólido de emissão, por unidade de frequência. A radiância espectral também pode ser expressa por unidade de comprimento de onda em vez de por unidade de frequência. Neste caso, é dado por
mostrando como a energia irradiada emitida em comprimentos de onda mais curtos aumenta mais rapidamente com a temperatura do que a energia emitida em comprimentos de onda mais longos.
A lei de Planck também pode ser expressa em outros termos, como o número de fótons emitidos em um determinado comprimento de onda ou a densidade de energia em um volume de radiação. As unidades SI de são W · sr −1 · m −2 · Hz −1 , enquanto as de são W · sr −1 · m −3 .
Planck logo percebeu que sua solução não era única. Havia várias soluções diferentes, cada uma das quais deu um valor diferente para a entropia dos osciladores. Para salvar sua teoria, Planck recorreu ao uso da então controversa teoria da mecânica estatística , que ele descreveu como "um ato de desespero ... Eu estava pronto para sacrificar qualquer uma de minhas convicções anteriores sobre a física". Uma de suas novas condições de limite era
interpretar U N [ a energia vibracional de N osciladores ] não como uma quantidade contínua e infinitamente divisível, mas como uma quantidade discreta composta de um número inteiro de partes finitas iguais. Vamos chamar cada uma dessas partes de elemento de energia ε;
- Planck, Sobre a Lei da Distribuição de Energia no Espectro Normal
Com essa nova condição, Planck havia imposto a quantização da energia dos osciladores, "uma suposição puramente formal ... na verdade não pensei muito nisso ..." em suas próprias palavras, mas que revolucionaria a física. A aplicação desta nova abordagem à lei de deslocamento de Wien mostrou que o "elemento de energia" deve ser proporcional à frequência do oscilador, a primeira versão do que agora é algumas vezes denominado "relação de Planck-Einstein ":
Planck foi capaz de calcular o valor de a partir de dados experimentais sobre a radiação de corpo negro: seu resultado,6,55 × 10 −34 J⋅s , está dentro de 1,2% do valor atualmente aceito. Ele também fez a primeira determinação da constante de Boltzmann a partir dos mesmos dados e teoria.
Desenvolvimento e aplicação
O problema do corpo negro foi revisitado em 1905, quando Rayleigh e Jeans (por um lado) e Einstein (por outro) provaram independentemente que o eletromagnetismo clássico nunca poderia explicar o espectro observado. Essas provas são comumente conhecidas como a " catástrofe ultravioleta ", um nome cunhado por Paul Ehrenfest em 1911. Elas contribuíram muito (junto com o trabalho de Einstein sobre o efeito fotoelétrico ) para convencer os físicos de que o postulado de Planck dos níveis de energia quantizados era mais do que um mero aspecto matemático formalismo. A primeira Conferência Solvay em 1911 foi dedicada à "teoria da radiação e dos quanta".
Efeito fotoelétrico
O efeito fotoelétrico é a emissão de elétrons (chamados de "fotoelétrons") de uma superfície quando a luz incide sobre ela. Foi observada pela primeira vez por Alexandre Edmond Becquerel em 1839, embora o crédito seja normalmente reservado para Heinrich Hertz , que publicou a primeira investigação completa em 1887. Outra investigação particularmente completa foi publicada por Philipp Lenard (Lénárd Fülöp) em 1902. O artigo de Einstein de 1905 discutindo o efeito em termos de quanta de luz lhe valeria o Prêmio Nobel em 1921, depois que suas previsões foram confirmadas pelo trabalho experimental de Robert Andrews Millikan . O comitê do Nobel concedeu o prêmio por seu trabalho sobre o efeito fotoelétrico, ao invés da relatividade, tanto por causa de um preconceito contra a física puramente teórica não fundamentada em descobertas ou experimentos, quanto por divergência entre seus membros quanto à prova real de que a relatividade era real .
Antes do artigo de Einstein, a radiação eletromagnética, como a luz visível, era considerada como uma onda: daí o uso dos termos "frequência" e "comprimento de onda" para caracterizar diferentes tipos de radiação. A energia transferida por uma onda em um determinado momento é chamada de intensidade . A luz de um holofote de teatro é mais intensa do que a luz de uma lâmpada doméstica; ou seja, o holofote distribui mais energia por unidade de tempo e por unidade de espaço (e, portanto, consome mais eletricidade) do que a lâmpada comum, embora a cor da luz possa ser muito semelhante. Outras ondas, como o som ou as ondas batendo contra a orla marítima, também têm sua intensidade. No entanto, a conta de energia do efeito fotoelétrico não parecia concordar com a descrição de onda da luz.
Os "fotoelétrons" emitidos como resultado do efeito fotoelétrico possuem uma certa energia cinética , que pode ser medida. Essa energia cinética (para cada fotoelétron) é independente da intensidade da luz, mas depende linearmente da frequência; e se a frequência for muito baixa (correspondendo a uma energia de fóton que é menor que a função de trabalho do material), nenhum fotoelétron é emitido, a menos que uma pluralidade de fótons, cuja soma energética seja maior que a energia dos fotoelétrons, atua virtualmente simultaneamente (efeito multifotônico). Assumindo que a frequência é alta o suficiente para causar o efeito fotoelétrico, um aumento na intensidade da fonte de luz faz com que mais fotoelétrons sejam emitidos com a mesma energia cinética, ao invés do mesmo número de fotoelétrons sendo emitidos com energia cinética mais alta.
A explicação de Einstein para essas observações foi que a própria luz é quantizada; que a energia da luz não é transferida continuamente como em uma onda clássica, mas apenas em pequenos "pacotes" ou quanta. O tamanho desses "pacotes" de energia, que mais tarde seriam chamados de fótons , seria o mesmo do "elemento de energia" de Planck, dando a versão moderna da relação Planck-Einstein:
O postulado de Einstein foi posteriormente comprovado experimentalmente: a constante de proporcionalidade entre a frequência da luz incidente e a energia cinética dos fotoelétrons mostrou ser igual à constante de Planck .
Estrutura atômica
Niels Bohr introduziu o primeiro modelo quantizado do átomo em 1913, em uma tentativa de superar uma grande lacuna do modelo clássico de Rutherford . Na eletrodinâmica clássica, uma carga que se move em um círculo deve irradiar radiação eletromagnética. Se essa carga fosse um elétron orbitando um núcleo , a radiação faria com que ele perdesse energia e espiralasse para dentro do núcleo. Bohr resolveu este paradoxo com referência explícita ao trabalho de Planck: um elétron em um átomo de Bohr só poderia ter certas energias definidas
onde é a velocidade da luz no vácuo, é uma constante determinada experimentalmente (a constante de Rydberg ) e . Uma vez que o elétron atingiu o nível de energia mais baixo ( ), ele não poderia se aproximar mais do núcleo (energia mais baixa). Essa abordagem também permitiu que Bohr explicasse a fórmula de Rydberg , uma descrição empírica do espectro atômico do hidrogênio, e explicasse o valor da constante de Rydberg em termos de outras constantes fundamentais.
Bohr também introduziu a quantidade , agora conhecida como constante de Planck reduzida , como o quantum do momento angular . A princípio, Bohr pensou que este era o momento angular de cada elétron em um átomo: isso se mostrou incorreto e, apesar dos desenvolvimentos de Sommerfeld e outros, uma descrição precisa do momento angular do elétron provou estar além do modelo de Bohr. As regras de quantização corretas para elétrons - em que a energia se reduz à equação do modelo de Bohr no caso do átomo de hidrogênio - foram dadas pela mecânica da matriz de Heisenberg em 1925 e a equação de onda de Schrödinger em 1926: a constante de Planck reduzida permanece o quantum fundamental de momento angular. Em termos modernos, se é o momento angular total de um sistema com invariância rotacional, e o momento angular medido ao longo de qualquer direção, essas quantidades só podem assumir os valores
Princípio da incerteza
A constante de Planck também ocorre em declarações do princípio da incerteza de Werner Heisenberg . Dadas inúmeras partículas preparadas no mesmo estado, a incerteza em sua posição , e a incerteza em seu momento , obedecem
onde a incerteza é dada como o desvio padrão do valor medido de seu valor esperado . Existem vários outros pares de variáveis conjugadas mensuráveis fisicamente que obedecem a uma regra semelhante. Um exemplo é tempo vs. energia. A relação inversa entre a incerteza das duas variáveis conjugadas força uma compensação em experimentos quânticos, pois medir uma quantidade com mais precisão resulta na outra quantidade se tornar imprecisa.
Além de algumas suposições subjacentes à interpretação de certos valores na formulação da mecânica quântica, um dos pilares fundamentais para toda a teoria reside na relação do comutador entre o operador de posição e o operador de momento :
onde fica o delta de Kronecker .
Energia de fóton
A relação de Planck-Einstein conecta a energia do fóton particular E com sua frequência de onda associada f :
Essa energia é extremamente pequena em termos de objetos cotidianos normalmente percebidos.
Uma vez que a frequência f , comprimento de onda λ e velocidade da luz c estão relacionados por , a relação também pode ser expressa como
O comprimento de onda de de Broglie λ da partícula é dado por
onde p denota o momento linear de uma partícula, como um fóton, ou qualquer outra partícula elementar .
Em aplicações onde é natural usar a frequência angular (isto é, onde a frequência é expressa em radianos por segundo em vez de ciclos por segundo ou hertz ), é frequentemente útil absorver um fator de 2 π na constante de Planck. A constante resultante é chamada de constante de Planck reduzida . É igual à constante de Planck dividida por 2 π , e é denotada ħ (pronuncia-se "h-bar"):
A energia de um fóton com frequência angular ω = 2 πf é dada por
enquanto seu momento linear se relaciona com
onde k é um número de onda angular . Em 1923, Louis de Broglie generalizou a relação de Planck-Einstein postulando que a constante de Planck representa a proporcionalidade entre o momento e o comprimento de onda quântico não apenas do fóton, mas o comprimento de onda quântico de qualquer partícula. Isso foi confirmado por experimentos logo depois. Isso é válido em toda a teoria quântica, incluindo a eletrodinâmica .
Essas duas relações são as partes temporais e espaciais da expressão relativística especial usando 4 vetores .
A mecânica estatística clássica requer a existência de h (mas não define seu valor). Eventualmente, após a descoberta de Planck, foi especulado que a ação física não poderia assumir um valor arbitrário, mas em vez disso, estava restrita a múltiplos inteiros de uma quantidade muito pequena, o " quantum [elementar] de ação", agora chamado de constante de Planck . Essa foi uma parte conceitual significativa da chamada " velha teoria quântica " desenvolvida por físicos como Bohr , Sommerfeld e Ishiwara , na qual as trajetórias das partículas existem, mas estão ocultas , mas as leis quânticas as restringem com base em sua ação. Essa visão foi substituída pela teoria quântica totalmente moderna, na qual trajetórias definidas de movimento nem mesmo existem; em vez disso, a partícula é representada por uma função de onda espalhada no espaço e no tempo. Portanto, não há valor para a ação como classicamente definida. Relacionado a isso está o conceito de quantização de energia que existia na velha teoria quântica e também existe em forma alterada na física quântica moderna. A física clássica não pode explicar a quantização da energia ou a falta de movimento clássico das partículas.
Em muitos casos, como para a luz monocromática ou para os átomos, a quantização da energia também implica que apenas certos níveis de energia são permitidos e os valores intermediários são proibidos.
Valor
A constante de Planck tem dimensões de momento angular . Em unidades SI , a constante de Planck é expressa em joules por hertz (J⋅Hz −1 ou kg ⋅m 2 ⋅s −1 ). Implícito nas dimensões da constante de Planck está o fato de que a unidade de frequência do SI, o hertz , representa um ciclo completo, 360 graus ou 2 π radianos, por segundo. Uma frequência angular em radianos por segundo é frequentemente mais natural em matemática e física e muitas fórmulas usam uma constante de Planck reduzida (pronuncia -se h-bar ).
Os valores acima foram adotados como fixados na redefinição de 2019 das unidades de base do SI .
Compreendendo a 'fixação' do valor de h
Desde 2019, o valor numérico da constante de Planck foi fixado, com uma representação decimal finita . De acordo com a presente definição de quilograma , que afirma que "O quilograma é [...] definido considerando o valor numérico fixo de h como6,626 070 15 × 10 −34 quando expresso na unidade J⋅s, que é igual a kg⋅m 2 ⋅s −1 , onde o metro e o segundo são definidos em termos de velocidade da luz ce duração da transição hiperfina de o estado fundamental de um imperturbável de césio-133 átomo ô vmax Cs ." Isto implica que a massa de metrologia está agora voltado para encontrar o valor de um quilograma, e assim é quilo que está compensando . Cada experimento com o objetivo de medir o quilograma (como o equilíbrio de Kibble e o método de densidade de cristal de raios-X), irão essencialmente refinar o valor de um quilograma.
A título de ilustração, suponha que a decisão de tornar h mais exato tenha sido tomada em 2010, quando seu valor medido era6,626 069 57 × 10 −34 J⋅s , portanto, a definição atual de quilograma também foi aplicada. No futuro, o valor de um quilograma deve ser refinado para 6,626 070 15/6,626 069 57 ≈ 1.000 0001 vezes a massa do protótipo internacional do quilograma (IPK), negligenciando share o medidor e segunda unidades, por razões de simplicidade.
Significado do valor
A constante de Planck está relacionada à quantização da luz e da matéria. Pode ser visto como uma constante da escala subatômica . Em um sistema de unidades adaptado a escalas subatômicas, o elétron - volt é a unidade apropriada de energia e o petahertz a unidade apropriada de frequência. Os sistemas de unidades atômicas são baseados (em parte) na constante de Planck. O significado físico da constante de Planck pode sugerir algumas características básicas de nosso mundo físico. Esses recursos básicos incluem as propriedades das constantes de vácuo e . A constante de Planck pode ser identificada como
- ,
onde Q é o fator de qualidade e é a área integrada do potencial vetorial no centro do pacote de ondas que representa uma partícula.
A constante de Planck é uma das menores constantes usadas em física. Isso reflete o fato de que em uma escala adaptada aos humanos, onde as energias são típicas da ordem dos quilojoules e os tempos são típicos da ordem dos segundos ou minutos, a constante de Planck é muito pequena. Pode-se considerar que a constante de Planck é relevante apenas para a escala microscópica em vez da escala macroscópica em nossa experiência cotidiana.
De forma equivalente, a ordem da constante de Planck reflete o fato de que os objetos e sistemas do dia-a-dia são feitos de um grande número de partículas microscópicas. Por exemplo, a luz verde com um comprimento de onda de 555 nanômetros (um comprimento de onda que pode ser percebido pelo olho humano como verde ) tem uma frequência de540 THz (540 × 10 12 Hz ). Cada fóton tem uma energia E = hf =3,58 × 10 -19 J . Essa é uma quantidade muito pequena de energia em termos de experiência cotidiana, mas a experiência cotidiana não está preocupada com fótons individuais mais do que com átomos ou moléculas individuais. Uma quantidade de luz mais típica na experiência cotidiana (embora muito maior do que a menor quantidade perceptível pelo olho humano) é a energia de um mol de fótons; sua energia pode ser calculada multiplicando a energia do fóton pela constante de Avogadro , N A =6.022 140 76 × 10 23 mol −1 , com o resultado de216 kJ / mol , sobre a energia alimentar em três maçãs.
Determinação
Em princípio, a constante de Planck pode ser determinada examinando o espectro de um radiador de corpo negro ou a energia cinética dos fotoelétrons, e é assim que seu valor foi calculado pela primeira vez no início do século XX. Na prática, esses métodos não são mais os mais precisos.
Como o valor da constante de Planck é fixo agora, ele não é mais determinado ou calculado em laboratórios. Algumas das práticas fornecidas abaixo para determinar a constante de Planck agora são usadas para determinar a massa do quilograma. Os métodos fornecidos abaixo, exceto o método de densidade de cristal de raios-X, baseiam-se na base teórica do efeito Josephson e do efeito Hall quântico .
Josephson constante
A constante Josephson K J relaciona a diferença de potencial U gerada pelo efeito Josephson em uma "junção Josephson" com a frequência ν da radiação de microondas. O tratamento teórico do efeito Josephson sugere fortemente que K J = 2 e / h .
A constante de Josephson pode ser medida comparando a diferença de potencial gerada por uma série de junções de Josephson com uma diferença de potencial que é conhecida em volts SI . A medição da diferença potencial em unidades SI é feita permitindo que uma força eletrostática cancele uma força gravitacional mensurável, em uma balança Kibble. Assumindo a validade do tratamento teórico do efeito Josephson, K J está relacionado à constante de Planck por
Equilíbrio de croquetes
Uma balança Kibble (anteriormente conhecida como balança de watt) é um instrumento para comparar duas potências , uma das quais é medida em watts SI e a outra é medida em unidades elétricas convencionais . Da definição do watt convencional W 90 , isso dá uma medida do produto K J 2 R K em unidades SI, onde R K é a constante de von Klitzing que aparece no efeito Hall quântico . Se os tratamentos teóricos do efeito Josephson e do efeito Hall quântico forem válidos, e em particular assumindo que R K = h / e 2 , a medição de K J 2 R K é uma determinação direta da constante de Planck.
Ressonância magnética
A razão giromagnética γ é a constante de proporcionalidade entre a frequência ν de ressonância magnética nuclear (ou ressonância paramagnética de elétrons para elétrons) e o campo magnético aplicado B : ν = γB . É difícil medir as razões giromagnéticas precisamente por causa das dificuldades em medir com precisão B , mas o valor para prótons na água em25 ° C é conhecido melhor do que uma parte por milhão . Diz-se que os prótons são "protegidos" do campo magnético aplicado pelos elétrons na molécula de água, o mesmo efeito que dá origem à mudança química na espectroscopia de NMR, e isso é indicado por um primo no símbolo da razão giromagnética, γ ′ p . A razão giromagnética está relacionada ao momento magnético do próton blindado μ ′ p , ao número de spin I ( I = 1 ⁄ 2 para prótons) e à constante de Planck reduzida.
A razão do momento magnético do próton blindado μ ′ p para o momento magnético do elétron μ e pode ser medida separadamente e com alta precisão, pois o valor imprecisamente conhecido do campo magnético aplicado se cancela ao tomar a razão. O valor de μ e em magnetons de Bohr também é conhecido: é a metade do fator g do elétron g e . Portanto
Uma complicação adicional é que a medição de γ ′ p envolve a medição de uma corrente elétrica: isso é invariavelmente medido em amperes convencionais em vez de em amperes SI , portanto, um fator de conversão é necessário. O símbolo Γ ′ p-90 é usado para a razão giromagnética medida usando unidades elétricas convencionais. Além disso, existem dois métodos de medição do valor, um método de "campo baixo" e um método de "campo alto", e os fatores de conversão são diferentes nos dois casos. Apenas o valor de campo alto Γ ′ p-90 (hi) é de interesse para determinar a constante de Planck.
A substituição dá a expressão para a constante de Planck em termos de Γ ′ p-90 (hi):
Constante de Faraday
A constante de Faraday F é a carga de um mol de elétrons, igual à constante de Avogadro N A multiplicada pela carga elementar e . Ele pode ser determinado por experimentos cuidadosos de eletrólise , medindo a quantidade de prata dissolvida de um eletrodo em um determinado tempo e para uma determinada corrente elétrica. Substituindo as definições de N A e e dá a relação com a constante de Planck.
Densidade de cristal de raio-x
O método da densidade do cristal de raios X é principalmente um método para determinar a constante de Avogadro N A, mas como a constante de Avogadro está relacionada à constante de Planck, ela também determina um valor para h . O princípio por trás do método é determinar N A como a razão entre o volume da célula unitária de um cristal, medido por cristalografia de raios-X , e o volume molar da substância. São utilizados cristais de silício , pois estão disponíveis em alta qualidade e pureza pela tecnologia desenvolvida para a indústria de semicondutores . O volume da célula unitária é calculado a partir do espaçamento entre dois planos de cristal referidos como d 220 . O volume molar V m (Si) requer um conhecimento da densidade do cristal e do peso atômico do silício usado. A constante de Planck é dada por
Acelerador de partículas
A medição experimental da constante de Planck no laboratório do Large Hadron Collider foi realizada em 2011. O estudo denominado PCC usando um acelerador de partículas gigante ajudou a compreender melhor as relações entre a constante de Planck e a medição de distâncias no espaço.
Veja também
- CODATA 2018
- Sistema Internacional de Unidades
- Introdução à mecânica quântica
- Unidades Planck
- Dualidade onda-partícula






























![[{\ hat {p}} _ {i}, {\ hat {x}} _ {j}] = - i \ hbar \ delta _ {ij},](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6de152aa445b7ca6653b9dd087ad604c2b8bf0e)
























