Não disjunção - Nondisjunction
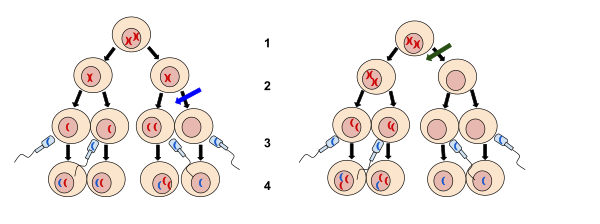
2. Meiose II
3. Fertilização
4. Zigoto
A imagem à esquerda na seta azul é a não disjunção ocorrendo durante a meiose II. A imagem certa na seta verde é a não disjunção ocorrendo durante a meiose I. A não disjunção ocorre quando os cromossomos não se separam normalmente, resultando em ganho ou perda de cromossomos.
A não disjunção é a falha dos cromossomos homólogos ou cromátides irmãs em se separarem adequadamente durante a divisão celular . Existem três formas de não disjunção: falha de um par de cromossomos homólogos em se separar na meiose I , falha nas cromátides irmãs em se separarem durante a meiose II e falha nas cromátides irmãs em se separar durante a mitose . A não disjunção resulta em células-filhas com números cromossômicos anormais ( aneuploidia ).
Calvin Bridges e Thomas Hunt Morgan são creditados com a descoberta da não disjunção nos cromossomos sexuais de Drosophila melanogaster na primavera de 1910, enquanto trabalhavam no Laboratório Zoológico da Universidade de Columbia.
Tipos
Em geral, a não disjunção pode ocorrer em qualquer forma de divisão celular que envolva distribuição ordenada de material cromossômico. Animais superiores têm três formas distintas de tais divisões celulares: Meiose I e meiose II são formas especializadas de divisão celular que ocorrem durante a geração de gametas (óvulos e espermatozoides) para a reprodução sexual, a mitose é a forma de divisão celular usada por todas as outras células do corpo.
Meiose II
Os óvulos ovulados ficam presos na metáfase II até que a fertilização desencadeie a segunda divisão meiótica. Semelhante aos eventos de segregação da mitose , os pares de cromátides irmãs resultantes da separação de bivalentes na meiose I são posteriormente separados na anáfase da meiose II . Nos oócitos, uma cromátide irmã é segregada no segundo corpo polar, enquanto a outra permanece dentro do ovo. Durante a espermatogênese , cada divisão meiótica é simétrica, de modo que cada espermatócito primário dá origem a 2 espermatócitos secundários após a meiose I e, eventualmente, 4 espermátides após a meiose II.
A não disjunção da meiose II também pode resultar em síndromes de aneuploidia , mas apenas em uma extensão muito menor do que as falhas de segregação na meiose I.

Esquerda: Metáfase da mitose. Os cromossomos se alinham no plano médio, o fuso mitótico se forma e os cinetocoros das cromátides irmãs se fixam aos microtúbulos.
À direita: Anáfase da mitose, onde as cromátides irmãs se separam e os microtúbulos as puxam em direções opostas.
O cromossomo mostrado em vermelho não consegue se separar adequadamente, suas cromátides irmãs se unem e são puxadas para o mesmo lado, resultando na não disjunção mitótica desse cromossomo.
Mitose
Divisão de somáticas células através de mitose é precedida pela replicação do material genético em fase S . Como resultado, cada cromossomo consiste em duas cromátides irmãs mantidas juntas no centrômero . Na anáfase da mitose , as cromátides irmãs se separam e migram para pólos celulares opostos antes da divisão celular. A não disjunção durante a mitose faz com que uma filha receba ambas as cromátides irmãs do cromossomo afetado, enquanto a outra não recebe nenhuma. Isso é conhecido como ponte de cromatina ou ponte de anáfase. A não disjunção mitótica resulta em mosaicismo somático , uma vez que apenas as células-filhas originadas da célula onde ocorreu o evento de não disjunção terão um número anormal de cromossomos . A não disjunção durante a mitose pode contribuir para o desenvolvimento de algumas formas de câncer , por exemplo, retinoblastoma (ver abaixo). A não disjunção cromossômica na mitose pode ser atribuída à inativação da topoisomerase II , condensina ou separase . A não disjunção meiótica foi bem estudada em Saccharomyces cerevisiae . Esta levedura sofre mitose de forma semelhante a outros eucariotos . As pontes cromossômicas ocorrem quando as cromátides irmãs são mantidas juntas após a replicação pelo emaranhamento topológico DNA-DNA e o complexo de coesão . Durante a anáfase, a coesina é clivada pela separase. A topoisomerase II e a condensina são responsáveis pela remoção das catenações .
Mecanismos moleculares
Função central do ponto de verificação da montagem do fuso
O ponto de verificação de montagem do fuso (SAC) é um mecanismo de proteção molecular que governa a segregação cromossômica adequada em células eucarióticas. O SAC inibe a progressão para a anáfase até que todos os cromossomos homólogos (bivalentes ou tétrades) estejam devidamente alinhados ao aparelho do fuso . Só então, o SAC libera sua inibição do complexo promotor da anáfase (APC), que por sua vez desencadeia irreversivelmente a progressão através da anáfase.
Diferenças específicas do sexo na meiose
Pesquisas de casos de síndromes de aneuploidia humana mostraram que a maioria delas são de origem materna. Isso levanta a questão: por que a meiose feminina é mais sujeita a erros? A diferença mais óbvia entre a oogênese feminina e a espermatogênese masculina é a parada prolongada de oócitos nos estágios finais da prófase I por muitos anos até várias décadas. Os gametas masculinos, por outro lado, passam rapidamente por todos os estágios da meiose I e II. Outra diferença importante entre a meiose masculina e feminina diz respeito à frequência de recombinação entre cromossomos homólogos: no homem, quase todos os pares de cromossomos são unidos por pelo menos um cruzamento , enquanto mais de 10% dos oócitos humanos contêm pelo menos um bivalente sem qualquer evento de cruzamento . Falhas de recombinação ou cruzamentos inadequadamente localizados foram bem documentados como contribuintes para a ocorrência de não disjunção em humanos.
Devido à parada prolongada de oócitos humanos, o enfraquecimento dos laços coesivos que mantêm os cromossomos unidos e a atividade reduzida do SAC podem contribuir para erros maternos relacionados à idade no controle da segregação . O complexo de coesina é responsável por manter juntas as cromátides irmãs e fornece locais de ligação para a fixação do fuso. A coesina é carregada em cromossomos recém-replicados em oogônias durante o desenvolvimento fetal. Maduros oócitos têm apenas uma capacidade limitada para recarregar cohesin após a conclusão da fase S . A parada prolongada de oócitos humanos antes da conclusão da meiose I pode, portanto, resultar em perda considerável de coesina ao longo do tempo. Presume-se que a perda de coesina contribua para a ligação incorreta do microtúbulo - cinetocore e erros de segregação cromossômica durante as divisões meióticas.
Consequências
O resultado desse erro é uma célula com um desequilíbrio de cromossomos. Essa célula é considerada aneuplóide . A perda de um único cromossomo (2n-1), em que a (s) célula (s) filha (s) com o defeito terão um cromossomo ausente em um de seus pares, é chamada de monossomia . Ganhar um único cromossomo, no qual a (s) célula (s) filha (s) com o defeito terão um cromossomo além de seus pares, é denominado trissomia . No caso de um gameta aneuploidico ser fertilizado, podem ocorrer várias síndromes.
Monossomia
A única monossomia sobrevivente conhecida em humanos é a síndrome de Turner , em que o indivíduo afetado é monossômico para o cromossomo X (veja abaixo). Outras monossomias são geralmente letais durante o desenvolvimento fetal inicial, e a sobrevivência só é possível se nem todas as células do corpo forem afetadas em caso de mosaicismo (veja abaixo), ou se o número normal de cromossomos for restaurado por meio da duplicação do único monossômico cromossomo ("resgate cromossômico").
Síndrome de Turner (monossomia X) (45, X0)
A perda completa de um cromossomo X inteiro é responsável por cerca de metade dos casos de síndrome de Turner . A importância de ambos os cromossomos X durante o desenvolvimento embrionário é enfatizada pela observação de que a esmagadora maioria (> 99%) dos fetos com apenas um cromossomo X ( cariótipo 45, X0) são abortados espontaneamente.
Trissomia autossômica
O termo trissomia autossômica significa que um cromossomo diferente dos cromossomos sexuais X e Y está presente em 3 cópias, em vez do número normal de 2 nas células diplóides.
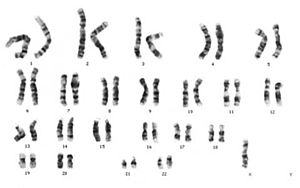
Síndrome de Down (trissomia 21)

Observe que o cromossomo 21 está presente em 3 cópias, enquanto todos os outros cromossomos mostram o estado diplóide normal com 2 cópias. A maioria dos casos de trissomia do cromossomo 21 é causada por um evento de não disjunção durante a meiose I (ver texto).
A síndrome de Down , uma trissomia do cromossomo 21, é a anomalia mais comum do número de cromossomos em humanos. A maioria dos casos resulta de não disjunção durante a meiose I materna. A trissomia ocorre em pelo menos 0,3% dos recém-nascidos e em quase 25% dos abortos espontâneos . É a principal causa de perda de gravidez e é a causa mais comum conhecida de retardo mental . Está bem documentado que a idade materna avançada está associada a um maior risco de não disjunção meiótica levando à síndrome de Down. Isso pode estar associado à parada meiótica prolongada de oócitos humanos com duração potencial de mais de quatro décadas.
Síndrome de Edwards (trissomia 18) e síndrome de Patau (trissomia 13)
As trissomias humanas compatíveis com nascidos vivos, com exceção da síndrome de Down (trissomia 21), são a síndrome de Edwards (trissomia 18) e a síndrome de Patau (trissomia 13). As trissomias completas de outros cromossomos geralmente não são viáveis e representam uma causa relativamente frequente de aborto espontâneo. Apenas em raros casos de mosaicismo , a presença de uma linha celular normal, além da linhagem trissômica, pode apoiar o desenvolvimento de uma trissomia viável dos outros cromossomos.
Aneuploidia de cromossomo sexual
O termo aneuploidia do cromossomo sexual resume as condições com um número anormal de cromossomos sexuais, ou seja, diferente de XX (feminino) ou XY (masculino). Formalmente, a monossomia do cromossomo X ( síndrome de Turner , veja acima) também pode ser classificada como uma forma de aneuploidia do cromossomo sexual.
Síndrome de Klinefelter (47, XXY)
A síndrome de Klinefelter é a aneuploidia cromossômica sexual mais comum em humanos. Representa a causa mais frequente de hipogonadismo e infertilidade em homens. A maioria dos casos é causada por erros de não disjunção na meiose paterna I. Cerca de oitenta por cento dos indivíduos com essa síndrome têm um cromossomo X extra, resultando no cariótipo XXY. Os casos restantes têm múltiplos cromossomos sexuais adicionais (48, XXXY; 48, XXYY; 49, XXXXY), mosaicismo (46, XY / 47, XXY) ou anormalidades cromossômicas estruturais.
XYY Masculino (47, XYY)
A incidência da síndrome XYY é de aproximadamente 1 em 800-1000 nascimentos do sexo masculino. Muitos casos permanecem sem diagnóstico devido à sua aparência e fertilidade normais e à ausência de sintomas graves. O cromossomo Y extra é geralmente resultado da não disjunção durante a meiose II paterna.
Trissomia X (47, XXX)
A trissomia X é uma forma de aneuploidia dos cromossomos sexuais em que as mulheres têm três cromossomos X em vez de dois. A maioria dos pacientes é levemente afetada por sintomas neuropsicológicos e físicos. Estudos que examinaram a origem do cromossomo X extra observaram que cerca de 58-63% dos casos foram causados por não disjunção na meiose materna I, 16-18% por não disjunção na meiose materna II e os demais casos por pós-zigótico, ou seja, mitótico, não disjunção.
Dissomia uniparental
Dissomia uniparental denota a situação em que ambos os cromossomos de um par de cromossomos são herdados do mesmo pai e, portanto, são idênticos. Esse fenômeno provavelmente é o resultado de uma gravidez que começou como uma trissomia por não disjunção. Como a maioria das trissomias é letal, o feto só sobrevive porque perde um dos três cromossomos e se torna disômico. A dissomia uniparental do cromossomo 15 é, por exemplo, observada em alguns casos de síndrome de Prader-Willi e síndrome de Angelman .
Síndromes de Mosaicismo
As síndromes de mosaico podem ser causadas por não disjunção mitótica no início do desenvolvimento fetal. Como consequência, o organismo evolui como uma mistura de linhagens celulares com diferentes ploidias (número de cromossomos). O mosaicismo pode estar presente em alguns tecidos, mas não em outros. Os indivíduos afetados podem ter uma aparência irregular ou assimétrica. Exemplos de síndromes de mosaicismo incluem a síndrome de Pallister-Killian e Hipomelanose de Ito .
Mosaicismo em transformação maligna

No primeiro acerto, o gene supressor de tumor em um dos dois cromossomos é afetado por uma mutação que torna o produto do gene não funcional. Esta mutação pode surgir espontaneamente como um erro de replicação do DNA ou pode ser induzida por um agente de dano ao DNA. O segundo hit remove o cromossomo de tipo selvagem restante, por exemplo, por meio de um evento de não disjunção mitótica . Existem vários outros mecanismos potenciais para cada uma das duas etapas, por exemplo, uma mutação adicional, uma translocação desequilibrada ou uma deleção de gene por recombinação. Como resultado da dupla lesão, a célula pode se tornar maligna porque não é mais capaz de expressar a proteína supressora de tumor.
O desenvolvimento do câncer frequentemente envolve várias alterações do genoma celular ( hipótese de Knudson ). O retinoblastoma humano é um exemplo bem estudado de um tipo de câncer em que a não disjunção mitótica pode contribuir para a transformação maligna: Mutações do gene RB1, que está localizado no cromossomo 13 e codifica a proteína supressora de tumor retinoblastoma , podem ser detectadas por análise citogenética em muitos casos de retinoblastoma. As mutações do locus RB1 em uma cópia do cromossomo 13 às vezes são acompanhadas pela perda do outro cromossomo 13 de tipo selvagem por meio da não disjunção mitótica. Por esta combinação de lesões, as células afetadas perdem completamente a expressão da proteína supressora de tumor em funcionamento.
Diagnóstico
Diagnóstico genético pré-implantação
O diagnóstico genético pré-implantação (PGD ou PIGD) é uma técnica usada para identificar embriões geneticamente normais e é útil para casais com histórico familiar de doenças genéticas. Esta é uma opção para pessoas que optam por procriar através da FIV . PGD é considerado difícil por ser demorado e ter taxas de sucesso apenas comparáveis à fertilização in vitro de rotina.
Cariótipo
A cariotipagem envolve a realização de uma amniocentese para estudar as células de um feto durante a metáfase 1. A microscopia de luz pode ser usada para determinar visualmente se a aneuploidia é um problema.
Diagnóstico de corpo polar
O diagnóstico de corpo polar (PBD) pode ser usado para detectar aneuploidias cromossômicas derivadas da mãe, bem como translocações em oócitos. A vantagem do PBD sobre o PGD é que ele pode ser realizado em um curto espaço de tempo. Isso é realizado por meio de perfuração de zona ou perfuração a laser.
Biópsia de blastômero
A biópsia de blastômero é uma técnica em que os blastômeros são removidos da zona pelúcida . É comumente usado para detectar aneuploidia. A análise genética é conduzida assim que o procedimento for concluído. Estudos adicionais são necessários para avaliar o risco associado ao procedimento.
Riscos ambientais / estilo de vida
A exposição de espermatozóides a riscos ambientais e / ou ocupacionais pode aumentar o risco de aneuploidia. A fumaça do cigarro é um conhecido aneugen ( agente indutor de aneuploidia ). Está associada a aumentos na aneuploidia variando de 1,5 a 3,0 vezes. Outros estudos indicam que fatores como consumo de álcool, exposição ocupacional ao benzeno e exposição aos inseticidas fenvalerato e carbaril também aumentam a aneuploidia.