Dessorção / ionização de laser assistida por matriz - Matrix-assisted laser desorption/ionization
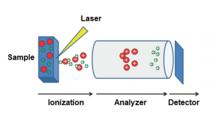
Na espectrometria de massa , a dessorção / ionização a laser assistida por matriz ( MALDI ) é uma técnica de ionização que usa uma matriz de absorção de energia do laser para criar íons a partir de moléculas grandes com fragmentação mínima. Tem sido aplicado à análise de biomoléculas ( biopolímeros como DNA , proteínas , peptídeos e carboidratos ) e várias moléculas orgânicas (como polímeros , dendrímeros e outras macromoléculas ), que tendem a ser frágeis e fragmentar quando ionizados por métodos de ionização mais convencionais . É semelhante em caráter à ionização por electrospray (ESI) em que ambas as técnicas são maneiras relativamente suaves (baixa fragmentação) de obter íons de moléculas grandes na fase gasosa, embora MALDI normalmente produza muito menos íons multi-carregados.
A metodologia MALDI é um processo de três etapas. Primeiro, a amostra é misturada com um material de matriz adequado e aplicada a uma placa de metal. Em segundo lugar, um laser pulsado irradia a amostra, desencadeando a ablação e a dessorção da amostra e do material da matriz. Finalmente, as moléculas de analito são ionizadas por serem protonadas ou desprotonadas na pluma quente dos gases ablacionados, e então podem ser aceleradas em qualquer espectrômetro de massa que seja usado para analisá-las.
História
O termo ionização de dessorção a laser assistida por matriz (MALDI) foi cunhado em 1985 por Franz Hillenkamp , Michael Karas e seus colegas. Esses pesquisadores descobriram que o aminoácido alanina poderia ser ionizado mais facilmente se fosse misturado ao aminoácido triptofano e irradiado com um laser pulsado de 266 nm. O triptofano estava absorvendo a energia do laser e ajudando a ionizar a alanina não absorvente. Péptidos até ao péptido 2843 Da da melitina podem ser ionizados quando misturados com este tipo de "matriz". O avanço para a ionização de dessorção a laser de moléculas grandes veio em 1987, quando Koichi Tanaka da Shimadzu Corporation e seus colegas de trabalho usaram o que chamaram de "método de matriz de metal ultrafino mais líquido" que combinava partículas de cobalto de 30 nm em glicerol com um laser de nitrogênio de 337 nm para ionização. Usando essa combinação de laser e matriz, Tanaka foi capaz de ionizar biomoléculas tão grandes quanto a proteína carboxipeptidase-A de 34.472 Da. Tanaka recebeu um quarto do Prêmio Nobel de Química de 2002 por demonstrar que, com a combinação adequada de comprimento de onda e matriz do laser, uma proteína pode ser ionizada. Karas e Hillenkamp foram subsequentemente capazes de ionizar a proteína albumina de 67 kDa usando uma matriz de ácido nicotínico e um laser de 266 nm. Outras melhorias foram realizados através da utilização de um laser de 355 nm e o ácido cinâmico derivados de ácido ferúlico , ácido cafeico e ácido sinapinico como a matriz. A disponibilidade de lasers de nitrogênio pequenos e relativamente baratos operando no comprimento de onda de 337 nm e os primeiros instrumentos comerciais introduzidos no início da década de 1990 trouxeram o MALDI a um número crescente de pesquisadores. Hoje, principalmente matrizes orgânicas são usadas para espectrometria de massa MALDI.
Matriz
| Composto | Outros nomes | Solvente | Comprimento de onda (nm) | Formulários |
|---|---|---|---|---|
| Ácido 2,5-dihidroxibenzóico (ácido gentísico) | DHB, ácido gentísico | acetonitrila , água , metanol , acetona , clorofórmio | 337, 355, 266 | peptídeos , nucleotídeos , oligonucleotídeos , oligossacarídeos |
| Ácido 3,5-dimetoxi-4-hidroxicinâmico | ácido sinápico; ácido sinapínico; SA | acetonitrila, água, acetona, clorofórmio | 337, 355, 266 | peptídeos, proteínas, lipídeos |
| Ácido 4-hidroxi-3-metoxicinâmico | ácido ferúlico | acetonitrila, água, propanol | 337, 355, 266 | proteínas |
| ácido α-ciano-4-hidroxicinâmico | CHCA | acetonitrila, água, etanol , acetona | 337, 355 | peptídeos, lipídeos, nucleotídeos |
| Ácido picolínico | PA | Etanol | 266 | oligonucleotídeos |
| Ácido 3-hidroxipicolínico | HPA | Etanol | 337, 355 | oligonucleotídeos |
A matriz é constituída por moléculas cristalizadas , das quais as três mais comumente utilizadas são o ácido sinapínico , ácido α-ciano-4-hidroxicinâmico (α-CHCA, alfa-ciano ou alfa-matriz) e ácido 2,5-dihidroxibenzóico (DHB). A solução de uma dessas moléculas é feita, geralmente em uma mistura de água altamente purificada e um solvente orgânico , como acetonitrila (ACN) ou etanol. Uma fonte de contra-íons, como ácido trifluoroacético (TFA), é geralmente adicionada para gerar os íons [M + H]. Um bom exemplo de solução-matriz seria 20 mg / mL de ácido sinapínico em ACN: água: TFA (50: 50: 0,1).
A identificação de compostos de matriz adequados é determinada até certo ponto por tentativa e erro, mas eles são baseados em algumas considerações específicas de projeto molecular. Eles têm um peso molecular bastante baixo (para permitir fácil vaporização), mas são grandes o suficiente (com uma pressão de vapor baixa o suficiente) para não evaporar durante a preparação da amostra ou enquanto permanecem no espectrômetro de massa. Eles são frequentemente ácidos, portanto agem como uma fonte de prótons para encorajar a ionização do analito. Matrizes básicas também foram relatadas. Eles têm uma forte absorção ótica na faixa de UV ou IR, de forma que absorvem a irradiação do laser de forma rápida e eficiente. Esta eficiência está comumente associada a estruturas químicas que incorporam várias ligações duplas conjugadas , como visto na estrutura do ácido cinâmico . São funcionalizados com grupos polares, permitindo seu uso em soluções aquosas. Eles normalmente contêm um cromóforo .
A solução da matriz é misturada com o analito (por exemplo, proteína - amostra). Uma mistura de água e solvente orgânico permite que as moléculas hidrofóbicas e solúveis em água ( hidrofílicas ) se dissolvam na solução. Esta solução é colocada em uma placa MALDI (geralmente uma placa de metal projetada para essa finalidade). Os solventes vaporizam, deixando apenas a matriz recristalizada, mas agora com moléculas de analito embutidas nos cristais MALDI. A matriz e o analito são considerados co-cristalizados. A cocristalização é uma questão chave na seleção de uma matriz adequada para obter um espectro de massa de boa qualidade do analito de interesse.
Na análise de sistemas biológicos, os sais inorgânicos, que também fazem parte dos extratos protéicos, interferem no processo de ionização. Os sais podem ser removidos por extração em fase sólida ou por lavagem dos pontos de gota seca de MALDI com água fria. Ambos os métodos também podem remover outras substâncias da amostra. A mistura matriz-proteína não é homogênea porque a diferença de polaridade leva a uma separação das duas substâncias durante a cocristalização. O diâmetro do ponto do alvo é muito maior do que o do laser, o que torna necessário fazer muitos disparos de laser em diferentes pontos do alvo, para obter a média estatística da concentração da substância dentro do ponto do alvo.
A matriz pode ser usada para ajustar o instrumento para ionizar a amostra de diferentes maneiras. Como mencionado acima, as reações do tipo ácido-base são frequentemente utilizadas para ionizar a amostra, no entanto, moléculas com sistemas pi conjugados , como compostos do tipo naftaleno, também podem servir como um aceitador de elétrons e, portanto, uma matriz para MALDI / TOF. Isso é particularmente útil no estudo de moléculas que também possuem sistemas pi conjugados. A aplicação mais amplamente usada para essas matrizes é o estudo de compostos semelhantes à porfirina , como a clorofila . Essas matrizes mostraram ter melhores padrões de ionização que não resultam em padrões de fragmentação estranhos ou perda completa das cadeias laterais. Também foi sugerido que as moléculas do tipo porfirina conjugadas podem servir como uma matriz e se clivar, eliminando a necessidade de um composto de matriz separado.
Instrumentação
Existem várias variações da tecnologia MALDI e instrumentos comparáveis são produzidos hoje para finalidades muito diferentes. De mais acadêmico e analítico a mais industrial e de alto rendimento. O campo de espectrometria de massa expandiu-se para exigir espectrometria de massa de resolução ultra-alta, como os instrumentos FT-ICR, bem como mais instrumentos de alto rendimento. Como muitos instrumentos MALDI MS podem ser comprados com uma fonte de ionização intercambiável ( ionização por eletrospray , MALDI, ionização por pressão atmosférica , etc.), as tecnologias muitas vezes se sobrepõem e muitas vezes qualquer método de ionização suave pode ser usado. Para obter mais variações de métodos de ionização suave, consulte: Dessorção de laser suave ou fonte de íons .
Laser
As técnicas de MALDI normalmente empregam o uso de lasers UV , como lasers de nitrogênio (337 nm) e lasers Nd: YAG triplicados e quadruplicados de frequência (355 nm e 266 nm, respectivamente).
Os comprimentos de onda do laser infravermelho usados para MALDI infravermelho incluem o laser Er: YAG de 2,94 μm , oscilador paramétrico óptico de infravermelho médio e laser de dióxido de carbono de 10,6 μm . Embora não sejam tão comuns, os lasers infravermelhos são usados devido ao seu modo de ionização mais suave. IR-MALDI também tem a vantagem de maior remoção de material (útil para amostras biológicas), menos interferência de baixa massa e compatibilidade com outros métodos de espectrometria de massa de dessorção a laser sem matriz.
Tempo de vôo
O tipo de espectrômetro de massa mais amplamente usado com o MALDI é o espectrômetro de massa de tempo de voo (TOF), principalmente devido à sua grande faixa de massa. O procedimento de medição TOF também é ideal para o processo de ionização MALDI, uma vez que o laser pulsado faz 'tiros' individuais em vez de trabalhar em operação contínua. Os instrumentos MALDI-TOF geralmente são equipados com um refletor (um "espelho de íons") que reflete os íons usando um campo elétrico. Isso aumenta a trajetória de voo do íon, aumentando assim o tempo de voo entre os íons de m / z diferente e aumentando a resolução. Os instrumentos comerciais modernos de refletor TOF alcançam uma potência de resolução m / Δm de 50.000 FWHM (largura total meio-máximo, Δm definido como a largura do pico em 50% da altura do pico) ou mais.
MALDI foi acoplado com IMS -TOF MS para identificar peptídeos fosforilados e não fosforilados.
MALDI -FT-ICR MS demonstrou ser uma técnica útil onde medições de MALDI-MS de alta resolução são desejadas.
Pressão atmosférica
A dessorção / ionização de laser assistida por matriz de pressão atmosférica (AP) (MALDI) é uma técnica de ionização (fonte de íons) que, em contraste com o vácuo, MALDI opera em ambiente atmosférico normal. A principal diferença entre vácuo MALDI e AP-MALDI é a pressão na qual os íons são criados. No vácuo MALDI, os íons são normalmente produzidos a 10 mTorr ou menos, enquanto no AP-MALDI os íons são formados na pressão atmosférica . No passado, a principal desvantagem da técnica AP-MALDI em comparação com o vácuo convencional MALDI era sua sensibilidade limitada; no entanto, os íons podem ser transferidos para o espectrômetro de massa com alta eficiência e limites de detecção de attomole foram relatados. AP-MALDI é usado em espectrometria de massa (MS) em uma variedade de aplicações que vão desde proteômica à descoberta de drogas. Os tópicos populares que são abordados pela espectrometria de massa AP-MALDI incluem: proteômica; análise de massa de DNA, RNA, PNA, lipídios, oligossacarídeos, fosfopeptídeos, bactérias, pequenas moléculas e polímeros sintéticos, aplicações semelhantes disponíveis também para instrumentos de vácuo MALDI. A fonte de íons AP-MALDI é facilmente acoplada a um espectrômetro de massa de armadilha de íons ou qualquer outro sistema MS equipado com ionização por electrospray (ESI) ou fonte nanoESI.
Aerossol
Na espectrometria de massa de aerossol , uma das técnicas de ionização consiste em disparar um laser em gotas individuais. Esses sistemas são chamados de espectrômetros de massa de partícula única (SPMS) . A amostra pode ser opcionalmente misturada com uma matriz MALDI antes da aerossolização.
Mecanismo de ionização
O laser é disparado nos cristais da matriz no local da gota seca. A matriz absorve a energia do laser e acredita-se que principalmente a matriz é dessorvida e ionizada (pela adição de um próton ) por este evento. A pluma quente produzida durante a ablação contém muitas espécies: moléculas de matriz neutra e ionizada, moléculas de matriz protonada e desprotonada, aglomerados de matriz e nanogotículas . Espécies abladas podem participar da ionização do analito, embora o mecanismo de MALDI ainda seja debatido. A matriz, então, transfere prótons para as moléculas de analito (por exemplo, moléculas de proteína), carregando assim o analito. Um íon observado após este processo consistirá na molécula neutra inicial [M] com íons adicionados ou removidos. Isso é chamado de íon quasimolecular, por exemplo [M + H] + no caso de um próton adicionado, [M + Na] + no caso de um íon de sódio adicionado , ou [MH] - no caso de um próton removido . MALDI é capaz de criar íons com carga única ou íons com carga múltipla ([M + nH] n + ), dependendo da natureza da matriz, da intensidade do laser e / ou da voltagem usada. Observe que todas essas são espécies de elétrons pares. Sinais de íons de cátions radicais (moléculas fotoionizadas) podem ser observados, por exemplo, no caso de moléculas de matriz e outras moléculas orgânicas.
O modelo de transferência de prótons em fase gasosa, implementado como o modelo de dinâmica física e química acoplada (CPCD), do laser UV MALDI postula processos primários e secundários que levam à ionização. Os processos primários envolvem a separação de carga inicial por meio da absorção de fótons pela matriz e o agrupamento da energia para formar pares de íons da matriz. A formação de íons primários ocorre através da absorção de um fóton UV para criar moléculas de estado excitado por
- S 0 + hν → S 1
- S 1 + S 1 → S 0 + S n
- S 1 + S n → M + + M -
onde S 0 é o estado eletrônico fundamental, S 1 o primeiro estado excitado eletrônico e S n é um estado excitado eletrônico superior. Os íons de produto podem ser pares de íons de transferência de prótons ou elétrons, indicados por M + e M - acima. Os processos secundários envolvem reações íon-molécula para formar íons analitos.
O modelo lucky survivor (mecanismo de ionização de cluster) postula que as moléculas de analito são incorporadas na matriz mantendo o estado de carga da solução. A formação de íons ocorre através da separação de carga após a fragmentação de aglomerados ablacionados a laser. Os íons que não são neutralizados por recombinação com fotoelétrons ou contra-íons são os chamados sobreviventes da sorte.
O modelo térmico postula que a alta temperatura facilita a transferência de prótons entre a matriz e o analito no líquido da matriz derretida. A razão íon-neutro é um parâmetro importante para justificar o modelo teórico, e a citação equivocada da razão íon-neutro pode resultar em uma determinação errônea do mecanismo de ionização. O modelo prevê quantitativamente o aumento na intensidade total do íon como uma função da concentração e afinidade do próton dos analitos, e a razão íon para neutro como uma função das fluências do laser. Este modelo também sugere que os adutos de íons metálicos (por exemplo, [M + Na] + ou [M + K] + ) são gerados principalmente a partir da dissolução induzida termicamente de sal.
O método de ionização assistida por matriz (MAI) usa preparação de matriz semelhante ao MALDI, mas não requer ablação a laser para produzir íons analitos de compostos voláteis ou não voláteis. A simples exposição da matriz com analito ao vácuo do espectrômetro de massa cria íons com estados de carga quase idênticos à ionização por eletrospray. Sugere-se que haja semelhança mecanicista provável entre este processo e MALDI.
O rendimento de íons é normalmente estimado em uma faixa de 10 −4 a 10 −7 , com alguns experimentos sugerindo rendimentos ainda mais baixos de 10 −9 . A questão dos baixos rendimentos de íons foi abordada, logo após a introdução do MALDI por várias tentativas, incluindo pós-ionização utilizando um segundo laser. A maioria dessas tentativas mostrou apenas um sucesso limitado, com aumentos baixos de sinal. Isso pode ser atribuído ao fato de que foram usados instrumentos axiais de tempo de voo, que operam a pressões na região da fonte de 10 −5 a 10 −6 , o que resulta em rápida expansão da pluma com velocidades de partícula de até 1000 m / s. Em 2015, a pós-ionização a laser bem-sucedida foi relatada, usando uma fonte MALDI modificada operada a uma pressão elevada de ~ 3 mbar acoplada a um analisador de massa ortogonal de tempo de voo e empregando um laser de pós-ionização ajustável no comprimento de onda, operado no comprimento de onda de 260 nm a 280 nm, abaixo do limiar de ionização de dois fótons das matrizes utilizadas, o que elevou os rendimentos iônicos de vários lipídios e pequenas moléculas em até três ordens de magnitude. Essa abordagem, denominada MALDI-2, devido ao segundo laser, e ao segundo processo de ionização do tipo MALDI, foi posteriormente adotada para outros espectrômetros de massa, todos equipados com fontes operando na faixa de mbar baixa.
Formulários
Bioquímica
Em proteômica , MALDI é usado para a identificação rápida de proteínas isoladas usando eletroforese em gel : SDS-PAGE , cromatografia de exclusão de tamanho , cromatografia de afinidade , troca iônica forte / fraca, marcação de proteína codificada por isótopo (ICPL) e eletroforese em gel bidimensional . A impressão digital de massa de peptídeos é a aplicação analítica mais popular dos espectrômetros de massa MALDI-TOF. Os espectrômetros de massa MALDI TOF / TOF são usados para revelar a sequência de aminoácidos de peptídeos usando decadência pós-fonte ou dissociação induzida por colisão de alta energia (para uso posterior, consulte espectrometria de massa ).
MALDI-TOF tem sido usado para caracterizar modificações pós-tradução . Por exemplo, tem sido amplamente aplicado para estudar a metilação e desmetilação de proteínas . No entanto, deve-se ter cuidado ao estudar modificações pós-tradução por MALDI-TOF. Por exemplo, foi relatado que a perda de ácido siálico foi identificada em artigos quando o ácido di-hidroxibenzóico (DHB) foi usado como uma matriz para a análise de MALDI MS de peptídeos glicosilados. Usando ácido sinapínico, 4-HCCA e DHB como matrizes, S. Martin estudou a perda de ácido siálico em peptídeos glicosilados por decaimento metaestável em MALDI / TOF em modo linear e modo refletor. Um grupo da Shimadzu Corporation derivatizou o ácido siálico por uma reação de amidação como forma de melhorar a sensibilidade de detecção e também demonstrou que a matriz líquida iônica reduz a perda de ácido siálico durante a análise MALDI / TOF MS de oligossacarídeos sialilados. THAP, DHAP e uma mistura de 2-aza-2-tiotimina e fenil-hidrazina foram identificados como matrizes que poderiam ser usadas para minimizar a perda de ácido siálico durante a análise MALDI MS de peptídeos glicosilados. Foi relatado que uma redução na perda de algumas modificações pós-tradução pode ser alcançada se IR MALDI for usado em vez de UV MALDI
Além das proteínas, o MALDI-TOF também foi aplicado para estudar lipídios . Por exemplo, foi aplicado para estudar as reações catalíticas de fosfolipases . Além dos lipídeos, os oligonucleotídeos também foram caracterizados por MALDI-TOF. Por exemplo, em biologia molecular, uma mistura de ácido 5-metoxissalicílico e espermina pode ser usada como uma matriz para análise de oligonucleotídeos em espectrometria de massa MALDI, por exemplo, após a síntese de oligonucleotídeos .
Química orgânica
Algumas macromoléculas sintéticas, como catenanos e rotaxanos , dendrímeros e polímeros hiper - ramificados e outros conjuntos, têm pesos moleculares que se estendem por milhares ou dezenas de milhares, onde a maioria das técnicas de ionização têm dificuldade em produzir íons moleculares. MALDI é um método analítico simples e rápido que pode permitir aos químicos analisar rapidamente os resultados de tais sínteses e verificar seus resultados.
Polímeros
Em química de polímeros, o MALDI pode ser usado para determinar a distribuição da massa molar . Polímeros com polidispersidade maior que 1,2 são difíceis de caracterizar com MALDI devido à discriminação de intensidade de sinal contra oligômeros de massa mais alta.
Uma boa matriz para polímeros é ditranol ou AgTFA . A amostra deve ser primeiro misturada com ditranol e o AgTFA adicionado em seguida; caso contrário, a amostra precipitará fora da solução.
Microbiologia
Os espectros MALDI-TOF são frequentemente usados para a identificação de microrganismos, como bactérias ou fungos. Uma porção de uma colônia do micróbio em questão é colocada no alvo da amostra e sobreposta com a matriz. Os espectros de massa das proteínas expressas geradas são analisados por software dedicado e comparados com perfis armazenados para determinação de espécies no que é conhecido como biotipagem. Oferece benefícios para outros procedimentos imunológicos ou bioquímicos e tornou-se um método comum para a identificação de espécies em laboratórios de microbiologia clínica. Os benefícios do MALDI-MS de alta resolução realizado em uma espectrometria de massa de ressonância de íon ciclotron de transformada de Fourier (também conhecido como FT-MS) foram demonstrados para a tipagem e subtipagem de vírus através da detecção de íon único conhecida como proteotipagem, com um foco particular em vírus influenza.
Uma das principais vantagens em relação a outros métodos de identificação microbiológica é a capacidade de identificar de forma rápida e confiável, a baixo custo, uma grande variedade de microrganismos diretamente do meio seletivo usado para isolá-los. A ausência da necessidade de purificar a colônia suspeita ou "presuntiva" permite tempos de resposta muito mais rápidos. Por exemplo, foi demonstrado que MALDI-TOF pode ser usado para detectar bactérias diretamente de hemoculturas.
Outra vantagem é o potencial para prever a suscetibilidade das bactérias aos antibióticos . Um único pico espectral de massa pode prever a resistência à meticilina de Staphylococcus aureus. MALDI também pode detectar carbapenemases de enterobacteriaceae resistentes a carbapenem , incluindo Acinetobacter baumannii e Klebsiella pneumoniae . No entanto, a maioria das proteínas que medeiam a resistência aos antibióticos são maiores do que a faixa de 2000-20.000 Da do MALDI-TOF para a interpretação do pico de proteína e apenas ocasionalmente, como no surto de Klebsiella pneumoniae carbapenemase (KPC) em 2011 no NIH, uma correlação entre um pico e a resistência conferindo proteína pode ser feita.
Parasitologia
Os espectros MALDI-TOF têm sido usados para a detecção e identificação de vários parasitas, como tripanossomatídeos , Leishmania e Plasmodium . Além desses parasitas unicelulares , MALDI / TOF pode ser usado para a identificação de insetos parasitas como piolhos ou cercárias , o estágio de natação livre dos trematódeos .
Medicina
Os espectros MALDI-TOF são frequentemente utilizados em conjunto com outras análises e técnicas de espectroscopia no diagnóstico de doenças. MALDI / TOF é uma ferramenta de diagnóstico com muito potencial porque permite a rápida identificação de proteínas e alterações em proteínas sem o custo ou poder de computação do sequenciamento, nem a habilidade ou tempo necessário para resolver uma estrutura cristalina em cristalografia de raios-X .
Um exemplo disso é a enterocolite necrosante (NEC), que é uma doença devastadora que afeta o intestino de bebês prematuros. Os sintomas da NEC são muito semelhantes aos da sepse , e muitos bebês morrem enquanto aguardam o diagnóstico e o tratamento. MALDI / TOF foi usado para identificar bactérias presentes na matéria fecal de bebês NEC positivos. Este estudo teve como foco a caracterização da microbiota fecal associada à NEC e não abordou o mecanismo da doença. Há esperança de que uma técnica semelhante possa ser usada como uma ferramenta de diagnóstico rápida que não exija sequenciamento.
Outro exemplo do poder diagnóstico de MALDI / TOF está na área de câncer . O câncer de pâncreas continua sendo um dos cânceres mais letais e difíceis de diagnosticar. Há muito se suspeita que a sinalização celular prejudicada devido a mutações nas proteínas da membrana contribui para o câncer de pâncreas. MALDI / TOF foi usado para identificar uma proteína de membrana associada ao câncer de pâncreas e, em um ponto, pode até servir como uma técnica de detecção precoce.
MALDI / TOF também pode ser potencialmente usado para ditar o tratamento, bem como o diagnóstico. MALDI / TOF serve como um método para determinar a resistência de bactérias a drogas , especialmente a β-lactamas (família da penicilina). O MALDI / TOF detecta a presença de carbapenemases, o que indica resistência aos antibióticos padrão. Prevê-se que isso possa servir como método para identificar uma bactéria como resistente a medicamentos em apenas três horas. Essa técnica pode ajudar os médicos a decidir se devem prescrever antibióticos mais agressivos inicialmente.
Detecção de complexos de proteínas
Após observações iniciais de que alguns complexos peptídeo-peptídeo poderiam sobreviver à deposição e ionização de MALDI, foram relatados estudos de grandes complexos de proteínas usando MALDI-MS.
Veja também
Referências
Bibliografia
- Ragoussis, J .; Elvidge, GP; Kaur, K .; Colella, S. (2006). "Matrix-Assisted Laser Desorption / Ionisation, Time-of-Flight Mass Spectrometry in Genomics Research" . PLOS Genetics . 2 (7): e100. doi : 10.1371 / journal.pgen.0020100 . PMC 1523240 . PMID 16895448 .
- Hardouin, J. (2007). "Informação da sequência de proteína por espectrometria de massa de decaimento na fonte de dessorção / ionização a laser assistida por matriz". Avaliações de espectrometria de massa . 26 (5): 672–82. Bibcode : 2007MSRv ... 26..672H . doi : 10.1002 / mas.20142 . PMID 17492750 .
- Peter-Katalinic, J .; Hillenkamp, F. (2007). MALDI MS: Um Guia Prático de Instrumentação, Métodos e Aplicações . Wiley-VCH . ISBN 978-3-527-31440-9.
- Schrepp, W .; Pasch, H. (2003). Espectrometria de massa MALDI-TOF de polímeros sintéticos . Springer-Verlag . ISBN 978-3-540-44259-2.
links externos
- Primer on Matrix-Assisted Laser Desorption Ionization (MALDI) National High Magnetic Field Laboratory