Síndrome de Leigh - Leigh syndrome
| Síndrome de Leigh | |
|---|---|
| Outros nomes | Encefalomielopatia necrosante subaguda juvenil, doença de Leigh, encefalomielopatia necrosante subaguda infantil, encefalomielopatia necrosante subaguda (SNEM) |
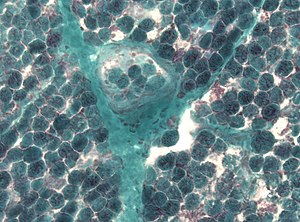 | |
| Detecção de numerosas fibras vermelhas irregulares em uma biópsia muscular | |
| Especialidade |
Neurologia |
A síndrome de Leigh (também chamada de doença de Leigh e encefalomielopatia necrosante subaguda ) é uma doença neurometabólica hereditária que afeta o sistema nervoso central . É nomeado após Archibald Denis Leigh, um neuropsiquiatra britânico que primeiro descreveu a condição em 1951. Níveis normais de tiamina , monofosfato de tiamina e difosfato de tiamina são comumente encontrados, mas há um nível reduzido ou ausente de trifosfato de tiamina . Acredita-se que isso seja causado por um bloqueio na enzima tiamina-difosfato quinase e, portanto, o tratamento em alguns pacientes seria tomar trifosfato de tiamina diariamente.
sinais e sintomas
Os sintomas da síndrome de Leigh são classicamente descritos como começando na infância e levando à morte em um período de vários anos; no entanto, à medida que mais casos são reconhecidos, fica aparente que os sintomas podem surgir em qualquer idade - incluindo a adolescência ou a idade adulta - e os pacientes podem sobreviver por muitos anos após o diagnóstico. Os sintomas costumam ser vistos pela primeira vez após um evento desencadeador que sobrecarrega a produção de energia do corpo, como uma infecção ou cirurgia. O curso geral da síndrome de Leigh é uma regressão do desenvolvimento episódica durante períodos de estresse metabólico. Alguns pacientes têm longos períodos sem progressão da doença, enquanto outros desenvolvem declínio progressivo.
Bebês com a síndrome apresentam sintomas que incluem diarreia , vômitos e disfagia (dificuldade para engolir ou sugar), levando a uma deficiência no crescimento . Crianças com doença de Leigh no início da vida também podem parecer irritáveis e chorar muito mais do que bebês saudáveis. As convulsões são freqüentemente vistas. O excesso de lactato pode ser observado na urina , líquido cefalorraquidiano e sangue de uma pessoa com síndrome de Leigh.
À medida que a doença progride, o sistema muscular fica debilitado em todo o corpo, pois o cérebro não consegue controlar a contração dos músculos. Hipotonia (baixo tônus e força muscular ), distonia (contração muscular involuntária e sustentada) e ataxia (falta de controle sobre os movimentos) são frequentemente observadas em pessoas com doença de Leigh. Os olhos são particularmente afetados; os músculos que controlam os olhos tornam-se fracos, paralisados ou incontroláveis em condições chamadas oftalmoparesia (fraqueza ou paralisia) e nistagmo (movimentos involuntários dos olhos). Sacadas lentas também são vistas às vezes. O coração e os pulmões também podem falhar como resultado da doença de Leigh. A cardiomiopatia hipertrófica (espessamento de parte do músculo cardíaco) às vezes também é encontrada e pode causar a morte; a hipertrofia septal assimétrica também foi associada à síndrome de Leigh. Em crianças com defeitos do septo ventricular associados à síndrome de Leigh , causados por deficiência de piruvato desidrogenase, testa alta e orelhas grandes são observadas; anormalidades faciais não são típicas da síndrome de Leigh.
No entanto, a insuficiência respiratória é a causa mais comum de morte em pessoas com síndrome de Leigh. Outros sintomas neurológicos incluem neuropatia periférica , perda de sensibilidade nas extremidades causada por danos ao sistema nervoso periférico .
A hipertricose é observada na síndrome de Leigh causada por mutações no gene nuclear SURF1 .
Genômica
Mutações no DNA mitocondrial (mtDNA) e mais de 30 genes no DNA nuclear (gene SURF1 e alguns fatores de montagem COX ) foram implicados na doença de Leigh.
Os distúrbios de fosforilação oxidativa , o processo pelo qual as células produzem sua principal fonte de energia de trifosfato de adenosina (ATP), podem ser causados por mutações no mtDNA ou em genes codificados pelo núcleo. Estas últimas são responsáveis pela maioria da doença de Leigh, embora nem sempre seja possível identificar a mutação específica responsável pela doença em um determinado indivíduo. Quatro dos cinco complexos de proteínas envolvidos na fosforilação oxidativa são mais comumente interrompidos na síndrome de Leigh, seja por causa da proteína malformada ou por causa de um erro na montagem desses complexos. Independentemente da base genética, resulta na incapacidade dos complexos afetados pela mutação de desempenhar seu papel na fosforilação oxidativa. No caso da doença de Leigh, células cruciais no tronco cerebral e nos gânglios da base são afetadas. Isso causa uma falta crônica de energia nas células, o que leva à morte celular e, por sua vez, afeta o sistema nervoso central e inibe as funções motoras. O coração e outros músculos também requerem muita energia e são afetados pela morte celular causada por deficiências crônicas de energia na síndrome de Leigh.
Mutações de DNA mitocondrial
As mitocôndrias são organelas essenciais nas células eucarióticas . Sua função é converter a energia potencial da glicose , aminoácidos e ácidos graxos em trifosfato de adenosina (ATP) em um processo denominado fosforilação oxidativa . As mitocôndrias carregam seu próprio DNA , denominado DNA mitocondrial (mtDNA). A informação armazenada no mtDNA é usada para produzir várias das enzimas essenciais para a produção de ATP.
Entre 20 e 25 por cento dos casos de síndrome de Leigh são causados por mutações no DNA mitocondrial. A mais comum dessas mutações é encontrada em 10 a 20 por cento da síndrome de Leigh e ocorre no MT-ATP6 , um gene que codifica uma proteína no último complexo da cadeia de fosforilação oxidativa, a ATP sintase , uma enzima que gera ATP diretamente. Sem ATP sintase, a cadeia de transporte de elétrons não produzirá nenhum ATP. A mutação MT-ATP6 mais comum encontrada na síndrome de Leigh é uma mutação pontual no nucleotídeo 8993 que transforma uma timina em guanina . Esta e outras mutações pontuais associadas à síndrome de Leigh desestabilizam ou malformam o complexo proteico e mantêm a produção de energia baixa nas células afetadas. Vários genes mitocondriais envolvidos na criação do primeiro complexo da cadeia de fosforilação oxidativa podem estar implicados em um caso de síndrome de Leigh, incluindo os genes MT-ND2 , MT-ND3 , MT-ND5 , MT-ND6 e MT-CO1 .
O DNA mitocondrial é transmitido matrilinearmente em um padrão chamado herança materna - uma mãe pode transmitir os genes da síndrome de Leigh para filhos do sexo masculino e feminino, mas os pais não podem transmitir genes mitocondriais.
Mutações de DNA nuclear
O DNA nuclear compreende a maior parte do genoma de um organismo e, em organismos que se reproduzem sexualmente , é herdado de ambos os pais, em contraste com o padrão materno de herança do DNA mitocondrial. A síndrome de Leigh, causada por mutações nucleares no DNA, é herdada em um padrão autossômico recessivo . Isso significa que duas cópias do gene mutado são necessárias para causar a doença, de modo que dois pais não afetados, cada um dos quais carrega um alelo mutante , podem ter um filho afetado se essa criança herdar o alelo mutante de ambos os pais.
75 a 80 por cento da síndrome de Leigh é causada por mutações no DNA nuclear; mutações que afetam a função ou montagem do quarto complexo envolvido na fosforilação oxidativa, citocromo c oxidase (COX), causam a maioria dos casos de doença de Leigh. Mutações em um gene chamado SURF1 (surfeit1) são a causa mais comum desse subtipo da síndrome de Leigh. A proteína para a qual SURF1 codifica é encerrada precocemente e, portanto, não pode desempenhar sua função, pastoreando as subunidades de COX juntas em um complexo de proteína funcional. Isso resulta em um déficit de proteína COX, reduzindo a quantidade de energia produzida pela mitocôndria. SURF1 está localizado no braço longo do cromossomo 9 . Outra mutação do DNA nuclear que causa a síndrome de Leigh afeta outro complexo de proteínas na mitocôndria, a piruvato desidrogenase , que é uma enzima na via da reação de Link . Alguns tipos de mutações SURF1 causam um subtipo da síndrome de Leigh que tem um início particularmente tardio, mas curso clínico similarmente variável.
Outros genes nucleares associados à síndrome de Leigh estão localizados no cromossomo 2 ( BCS1L e NDUFA10 ); cromossomo 5 ( SDHA , NDUFS4 , NDUFAF2 e NDUFA2 ); cromossomo 8 ( NDUFAF6 ), cromossomo 10 ( COX15 ); cromossomo 11 ( NDUFS3 , NDUFS8 e FOXRED1 ); cromossomo 12 ( NDUFA9 e NDUFA12 ); e cromossomo 19 ( NDUFS7 ). Muitos desses genes afetam o primeiro complexo de fosforilação oxidativo.
Síndrome de Leigh ligada ao X

A síndrome de Leigh também pode ser causada pela deficiência do complexo piruvato desidrogenase (PDHC), mais comumente envolvendo uma subunidade PDHC que é codificada por um gene ligado ao X ( OMIM 308930 ). As características neurológicas da síndrome de Leigh causada pela deficiência de PDHC são indistinguíveis de outras formas. No entanto, características não neurológicas (além da acidose láctica) não são observadas na deficiência de PDHC.
Recessiva ligada ao X síndrome de Leigh afeta crianças do sexo masculino com muito mais freqüência do que as crianças do sexo feminino, porque eles só têm uma cópia do cromossomo X . As crianças do sexo feminino precisariam de duas cópias do gene defeituoso para serem afetadas pela síndrome de Leigh ligada ao X.
Síndrome de Leigh franco-canadense
O tipo de síndrome de Leigh encontrado em uma taxa muito maior na região de Saguenay-Lac-Saint-Jean de Quebec é causado por uma mutação no gene LRPPRC , localizado no braço pequeno ('p') do cromossomo 2. Ambos compostos de heterozigosidade e mutações homozigóticas foram observadas na síndrome de Leigh franco-canadense. Esse subtipo da doença foi descrito pela primeira vez em 1993 em 34 crianças da região, todas com deficiência grave de citocromo c oxidase (COX), o quarto complexo da cadeia de transporte de elétrons mitocondrial . Embora as subunidades da proteína encontrada nas células afetadas fossem funcionais, elas não foram devidamente montadas. A deficiência foi considerada quase completa nos tecidos do cérebro e do fígado e substancial (aproximadamente 50% da atividade enzimática normal) nos fibroblastos (células do tecido conjuntivo) e no músculo esquelético . Os tecidos do rim e do coração não apresentam deficiência de COX.
A síndrome de Leigh franco-canadense tem sintomas semelhantes a outros tipos de síndrome de Leigh. A idade de início é, em média, 5 meses e a mediana da idade de óbito é 1 ano e 7 meses. Crianças com a doença apresentam retardo no desenvolvimento , características faciais levemente dismórficas , incluindo hipoplasia da parte média da face e ponte nasal larga , acidose metabólica crônica e hipotonia (diminuição da força muscular). Outros sintomas incluem taquipnéia (taxa de respiração excepcionalmente rápida), capacidade de sucção deficiente, hipoglicemia (baixo nível de açúcar no sangue) e tremores . A acidose metabólica súbita e grave é uma causa comum de mortalidade.
As estimativas da taxa de portadores genéticos na região de Saguenay-Lac-Saint-Jean variam de 1 em 23 a 1 em 28; o número de crianças nascidas com a doença foi estimado em 1 em 2.063 a 1 em 2.473 nascidos vivos. Estudos genealógicos sugerem que a mutação responsável foi introduzida na região pelos primeiros colonizadores europeus.
Fisiopatologia
Os sintomas característicos da síndrome de Leigh são, pelo menos parcialmente, causados por lesões bilaterais e focais no tronco cerebral , gânglios da base , cerebelo e outras regiões do cérebro. As lesões assumem diferentes formas, incluindo áreas de desmielinização , espongiose , gliose , necrose e proliferação capilar . A desmielinização é a perda da bainha de mielina ao redor dos axônios dos neurônios, inibindo sua capacidade de se comunicar com outros neurônios. O tronco cerebral está envolvido na manutenção de funções vitais básicas, como respiração, deglutição e circulação; os gânglios da base e o cerebelo controlam o movimento e o equilíbrio. Danos a essas áreas, portanto, resultam nos principais sintomas da síndrome de Leigh - perda de controle sobre as funções controladas por essas áreas.
A acidose láctica às vezes associada à síndrome de Leigh é causada pelo acúmulo de piruvato , que não pode ser processado em indivíduos com certos tipos de deficiências de fosforilação oxidativa. O piruvato é convertido em alanina via alanina aminotransferase ou convertido em ácido lático pela lactato desidrogenase ; ambas as substâncias podem se acumular no corpo.
Diagnóstico
A síndrome de Leigh é sugerida por achados clínicos e confirmada por testes laboratoriais e genéticos.
Descobertas clínicas
Distonia, nistagmo e problemas com o sistema nervoso autônomo sugerem danos aos gânglios da base e ao tronco encefálico potencialmente causados pela síndrome de Leigh. Outros sintomas também são indicativos de danos cerebrais, como hipertricose e surdez de origem neurológica . Os achados laboratoriais de acidose láctica ou acidemia e hiperalaninemia (níveis elevados de alanina no sangue) também podem sugerir a síndrome de Leigh. Avaliar o nível de ácidos orgânicos na urina também pode indicar uma disfunção na via metabólica .
Diagnóstico diferencial
Outras doenças podem ter apresentação clínica semelhante à síndrome de Leigh; excluir outras causas de sintomas clínicos semelhantes costuma ser o primeiro passo para diagnosticar a síndrome de Leigh. Condições que podem aparecer semelhante à doença de Leigh incluem asfixia perinatal , icterícia nuclear , envenenamento por monóxido de carbono , a toxicidade do metanol , tiamina deficiência , doença de Wilson , a doença dos gânglios basais biotina-responsivo , e algumas formas de encefalite . A asfixia perinatal pode causar lesões ganglionares bilaterais e danos ao tálamo , que são semelhantes aos sinais observados na síndrome de Leigh. Quando a hiperbilirrubinemia não é tratada com fototerapia , a bilirrubina pode se acumular nos gânglios da base e causar lesões semelhantes às observadas na síndrome de Leigh. Isso não é comum desde o advento da fototerapia.
Tratamento
O ácido succínico foi estudado e mostrou-se eficaz tanto para a síndrome de Leigh quanto para a síndrome MELAS . Uma dieta rica em gordura e pobre em carboidratos pode ser seguida se um gene no cromossomo X estiver implicado na síndrome de Leigh de um indivíduo. A tiamina (vitamina B 1 ) pode ser administrada se a deficiência de piruvato desidrogenase for conhecida ou suspeita. Os sintomas da acidose láctica são tratados com a suplementação da dieta com bicarbonato de sódio (bicarbonato de sódio) ou citrato de sódio , mas essas substâncias não tratam a causa da síndrome de Leigh. O dicloroacetato também pode ser eficaz no tratamento da acidose láctica associada à síndrome de Leigh; estão em curso pesquisas sobre esta substância. Suplementos de coenzima Q10 foram vistos para melhorar os sintomas em alguns casos.
Os ensaios clínicos do medicamento EPI-743 para a síndrome de Leigh estão em andamento.
Em 2016, John Zhang e sua equipe do New Hope Fertility Center em Nova York, EUA, realizaram uma técnica de doação mitocondrial por transferência de fuso em uma mãe no México que estava em risco de gerar um bebê com a doença de Leigh. Um menino saudável nasceu em 6 de abril de 2016. No entanto, ainda não é certo se a técnica é totalmente confiável e segura.
Prognóstico
Diferentes causas genéticas e tipos de síndrome de Leigh têm prognósticos diferentes, embora todos sejam ruins. As formas mais graves da doença, causadas pela deficiência total de uma das proteínas afetadas, causam a morte com poucos anos de idade. Se a deficiência não for completa, o prognóstico é um pouco melhor e espera-se que uma criança afetada sobreviva de 6 a 7 anos e, em casos raros, até a adolescência.
Epidemiologia
A síndrome de Leigh ocorre em pelo menos 1 em 40.000 nascidos vivos, embora certas populações tenham taxas muito mais altas. Na região de Saguenay-Lac-Saint-Jean , no centro de Quebec , a síndrome de Leigh ocorre a uma taxa de 1 em 2.000 recém-nascidos.
História
A síndrome de Leigh foi descrita pela primeira vez por Denis Leigh em 1951 e diferenciada de encefalopatia de Wernicke semelhante em 1954. Em 1968, a ligação da doença com a atividade mitocondrial foi verificada pela primeira vez, embora as mutações no citocromo c oxidase e outras proteínas da cadeia de transporte de elétrons não tenham sido descobertas até 1977 .
Veja também
Referências
Leitura adicional
- GeneReviews / NCBI / NIH / UW entrada na Síndrome de Leigh associada ao DNA mitocondrial e NARP
- Entradas OMIM na Síndrome de Leigh associada ao DNA mitocondrial e NARP
- Síndrome de Leigh; Encefalopatia necrosante subaguda; Doença de Leigh no NIH 's Office of Rare Diseases
- doença leighs em NINDS
- Síndrome de Leigh herdada pela mãe no escritório de doenças raras do NIH
links externos
| Classificação |
|---|


