História da penicilina - History of penicillin
A história da penicilina segue uma série de observações e descobertas de evidências aparentes da atividade antibiótica do fungo Penicillium que levou ao desenvolvimento das penicilinas que se tornaram os antibióticos mais amplamente usados . Após a identificação do Penicillium rubens como a fonte do composto em 1928 e com a produção do composto puro em 1942, a penicilina se tornou o primeiro antibiótico de origem natural. Existem anedotas sobre sociedades antigas que usavam bolores para tratar infecções e, nos séculos seguintes, muitas pessoas observaram a inibição do crescimento bacteriano por vários bolores. No entanto, não se sabe se as espécies envolvidas eram espécies de Penicillium ou se as substâncias antimicrobianas produzidas eram penicilina.
Enquanto trabalhava no St Mary's Hospital em Londres, o médico escocês Alexander Fleming foi o primeiro a descobrir experimentalmente que um fungo Penicillium secreta uma substância antibacteriana, e o primeiro a concentrar a substância ativa envolvida, que ele chamou de penicilina em 1928. Determinou-se que o fungo ser uma variante rara de Penicillium notatum (agora Penicillium rubens ), um contaminante de laboratório em seu laboratório. Nos 16 anos seguintes, ele buscou melhores métodos de produção de penicilina, usos medicinais e ensaios clínicos. Seu tratamento bem-sucedido de Harry Lambert, que sofria de meningite estreptocócica fatal em 1942, provou ser um momento crítico no uso médico da penicilina.
Muitos cientistas posteriores se envolveram na estabilização e produção em massa de penicilina e na busca por cepas mais produtivas de Penicillium . Contribuidores importantes incluem Ernst Chain , Howard Florey , Norman Heatley e Edward Abraham . Fleming, Florey e Chain compartilharam o Prêmio Nobel de Fisiologia ou Medicina de 1945 pela descoberta e desenvolvimento da penicilina. Dorothy Hodgkin recebeu o Prêmio Nobel de Química em 1964 , determinando as estruturas de importantes substâncias bioquímicas, incluindo a penicilina. Pouco depois da descoberta da penicilina, houve relatos de resistência à penicilina em muitas bactérias. A pesquisa que visa contornar e compreender os mecanismos de resistência aos antibióticos continua até hoje.
História antiga
Muitas culturas antigas, incluindo as do Egito , Grécia e Índia , descobriram independentemente as propriedades úteis de fungos e plantas no tratamento de infecções . Esses tratamentos geralmente funcionavam porque muitos organismos, incluindo muitas espécies de fungos, produzem naturalmente substâncias antibióticas . No entanto, os antigos praticantes não conseguiam identificar ou isolar com precisão os componentes ativos desses organismos.
Na Polônia do século 17 , o pão úmido era misturado com teias de aranha (que geralmente continham esporos de fungos ) para tratar feridas. A técnica foi mencionada por Henryk Sienkiewicz em seu livro de 1884 With Fire and Sword . Na Inglaterra, em 1640, a ideia de usar mofo como forma de tratamento médico foi registrada por boticários como John Parkinson, Herbarian do Rei, que defendia o uso de mofo em seu livro sobre farmacologia .
Evidências científicas iniciais
A história moderna da pesquisa da penicilina começa para valer na década de 1870 no Reino Unido. Sir John Scott Burdon-Sanderson , que começou no St. Mary's Hospital (1852-1858) e mais tarde trabalhou lá como conferencista (1854-1862), observou que o fluido de cultura coberto com mofo não produziria crescimento bacteriano . A descoberta de Burdon-Sanderson levou Joseph Lister , um cirurgião inglês e pai da antissepsia moderna , a descobrir em 1871 que amostras de urina contaminadas com mofo também não permitiam o crescimento de bactérias. Lister também descreveu a ação antibacteriana no tecido humano de uma espécie de fungo que ele chamou de Penicillium glaucum . Uma enfermeira do King's College Hospital, cujas feridas não respondiam a nenhum anti-séptico tradicional, recebeu outra substância que o curou, e o secretário de Lister informou-o de que se chamava Penicillium . Em 1874, o médico galês William Roberts , que mais tarde cunhou o termo " enzima ", observou que a contaminação bacteriana geralmente está ausente em culturas de laboratório de Penicillium glaucum . John Tyndall acompanhou o trabalho de Burdon-Sanderson e demonstrou à Royal Society em 1875 a ação antibacteriana do fungo Penicillium .
Em 1876, o biólogo alemão Robert Koch descobriu que o Bacillus anthracis era o patógeno causador do antraz , que se tornou a primeira demonstração de que uma bactéria específica causava uma doença específica e a primeira evidência direta da teoria microbiana das doenças . Em 1877, os biólogos franceses Louis Pasteur e Jules Francois Joubert observaram que as culturas dos bacilos do antraz, quando contaminados com fungos, podiam ser inibidos com sucesso. Reportando no Comptes Rendus de l'Académie des Sciences , eles concluíram:
Urina neutra ou ligeiramente alcalina é um excelente meio para as bactérias ... Mas se quando a urina é inoculada com essas bactérias um organismo aeróbio, por exemplo uma das "bactérias comuns", é semeado ao mesmo tempo, a bactéria do antraz faz pouco ou nenhum crescimento e, mais cedo ou mais tarde, desaparece completamente. É notável que o mesmo fenômeno seja visto no corpo mesmo dos animais mais suscetíveis ao antraz, levando ao surpreendente resultado de que a bactéria do antraz pode ser introduzida em profusão em um animal que ainda não desenvolve a doença; é apenas necessário adicionar algumas bactérias "comuns" ao mesmo tempo ao líquido que contém a suspensão da bactéria do antraz. Esses fatos talvez justifiquem as maiores esperanças para a terapêutica.
O fenômeno foi descrito por Pasteur e Koch como atividade antibacteriana e foi batizado de "antibiose" pelo biólogo francês Jean Paul Vuillemin em 1877. (O termo antibiose, que significa "contra a vida", foi adotado como " antibiótico " pelo biólogo americano e posteriormente pelo Nobel laureado Selman Waksman em 1947.) Também foi afirmado que Pasteur identificou a cepa como Penicillium notatum . No entanto, em 1926 Microbe Hunters , de Paul de Kruif , este incidente foi descrito como contaminação por outras bactérias, e não por mofo. Em 1887, o médico suíço Carl Alois Philipp Garré desenvolveu um método de teste usando placa de vidro para ver a inibição bacteriana e encontrou resultados semelhantes. Usando sua placa de cultura à base de gelatina, ele cultivou duas bactérias diferentes e descobriu que seus crescimentos eram inibidos de forma diferente, como ele relatou:
Eu inoculei na placa de gelatina intacta e resfriada alternando golpes paralelos de B. fluorescens [ Pseudomonas fluorescens ] e Staph. pyogenes [ Streptococcus pyogenes ] ... B. fluorescens cresceu mais rapidamente ... [Isso] não é uma questão de supercrescimento ou exclusão de outra espécie de crescimento mais rápido, como em um jardim onde ervas daninhas de crescimento exuberante matam as delicadas plantas . Nem é devido à utilização dos alimentos disponíveis pelos organismos de crescimento mais rápido, mas sim um antagonismo causado pela secreção de substâncias específicas, facilmente difusíveis, que são inibidoras do crescimento de algumas espécies, mas completamente ineficazes contra outras.
Em 1895, Vincenzo Tiberio , um médico italiano da Universidade de Nápoles , publicou uma pesquisa sobre bolores inicialmente encontrados em um poço de água em Arzano ; a partir de suas observações, ele concluiu que esses fungos continham substâncias solúveis com ação antibacteriana.
Dois anos depois, Ernest Duchesne, da École du Service de Santé Militaire em Lyon, descobriu independentemente as propriedades curativas de um fungo Penicillium glaucum , curando até cobaias infectadas de febre tifóide . Ele publicou uma dissertação em 1897, mas foi ignorada pelo Institut Pasteur . O próprio Duchesne estava usando uma descoberta feita anteriormente por cavalariços árabes, que usavam moldes para curar feridas em cavalos. Ele não alegou que o molde continha qualquer substância antibacteriana, apenas que o molde de alguma forma protegia os animais. A penicilina isolada por Fleming não cura a febre tifóide e por isso não se sabe qual substância pode ter sido responsável pela cura de Duchesne. Um cientista do Institut Pasteur, o costarriquenho Clodomiro Picado Twight , registrou de forma semelhante o efeito antibiótico do Penicillium em 1923. Nesses estágios iniciais da pesquisa da penicilina, a maioria das espécies de Penicillium eram não especificamente denominadas Penicillium glaucum , de modo que é impossível saber a espécie exata e que realmente foi a penicilina que impediu o crescimento bacteriano.
Andre Gratia e Sara Dath, da Universidade Livre de Bruxelas , Bélgica, estavam estudando os efeitos de amostras de fungos nas bactérias. Em 1924, eles descobriram que culturas mortas de Staphylococcus aureus estavam contaminadas por um molde, um estreptomiceto . Após mais experimentos, eles mostram que o extrato de fungo pode matar não apenas S. aureus , mas também Pseudomonas aeruginosa , Mycobacterium tuberculosis e Escherichia coli . Gratia chamou o agente antibacteriano de "mycolysate" (fungo assassino). No ano seguinte, eles encontraram outro fungo assassino que poderia inibir a bactéria do antraz ( B. anthracis ). Reportando em Comptes Rendus Des Séances de La Société de Biologie et de Ses Filiales, eles identificaram o molde como Penicillium glaucum . Mas essas descobertas receberam pouca atenção, pois o agente antibacteriano e seu valor médico não foram totalmente compreendidos; além disso, as amostras de Gratia foram perdidas.
A descoberta revolucionária
Fundo
A penicilina foi descoberta por um médico escocês Alexander Fleming em 1928. Enquanto trabalhava no St Mary's Hospital, em Londres , Fleming investigava o padrão de variação do S. aureus . Ele foi inspirado pela descoberta do médico irlandês Joseph Warwick Bigger e seus dois alunos CR Boland e RAQ O'Meara no Trinity College, Dublin , Irlanda, em 1927 . Bigger e seus alunos descobriram que, quando cultivaram uma determinada cepa de S. aureus, que designaram "Y", que isolaram um ano antes de um pus de abscesso axilar de um indivíduo, a bactéria cresceu em uma variedade de cepas. Eles publicaram sua descoberta como "Colônias variantes de Staphylococcus aureus " no The Journal of Pathology and Bacteriology , concluindo:
Ficamos surpresos e bastante perturbados ao descobrir, em várias placas, vários tipos de colônias que diferiam completamente da colônia de aureus típica . Alguns deles eram bastante brancos; alguns, brancos ou da cor usual, eram ásperos na superfície e com margens crenadas.
Fleming e seu estudioso de pesquisa Daniel Merlin Pryce seguiram este experimento, mas Pryce foi transferido para outro laboratório no início de 1928. Após alguns meses trabalhando sozinho, um novo estudioso Stuart Craddock juntou-se a Fleming. Seu experimento foi bem-sucedido e Fleming estava planejando e concordou em escrever um relatório em A System of Bacteriology, a ser publicado pelo Medical Research Council no final de 1928.
Descoberta inicial
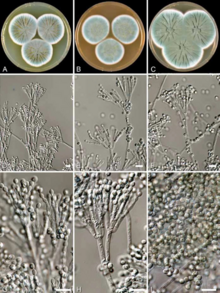
Em agosto, Fleming passou férias com sua família em sua casa de campo, The Dhoon, em Barton Mills , Suffolk. Antes de deixar seu laboratório, ele inoculou várias placas de cultura com S. aureus. Ele manteve os pratos de lado em um canto da mesa, longe da luz direta do sol, para dar espaço para Craddock trabalhar em sua ausência. Durante as férias, ele foi nomeado professor de Bacteriologia na St Mary's Hospital Medical School em 1 de setembro de 1928. Ele chegou ao seu laboratório em 3 de setembro, onde Pryce o esperava para recebê-lo. Enquanto ele e Pryce examinavam as placas de cultura, eles encontraram uma com a tampa aberta e a cultura contaminada com um molde azul-esverdeado. Na placa contaminada, as bactérias ao redor do molde não cresceram, enquanto as mais distantes cresceram normalmente, o que significa que o molde matou as bactérias. Fleming comentou enquanto observava o prato: "Engraçado". Pryce comentou com Fleming: "Foi assim que você descobriu a lisozima ."
Experimentar
Fleming saiu para retomar suas férias e voltou para os experimentos no final de setembro. Ele coletou o molde original e os cultivou em placas de cultura. Depois de quatro dias, ele descobriu que as placas desenvolveram grandes colônias do molde. Ele repetiu o experimento com os mesmos resultados de eliminação de bactérias. Mais tarde, ele contou sua experiência:
Quando acordei logo após o amanhecer de 28 de setembro de 1928, certamente não planejava revolucionar todos os medicamentos descobrindo o primeiro antibiótico ou matador de bactérias do mundo. Mas suponho que foi exatamente o que fiz.
Ele concluiu que o fungo estava liberando uma substância que inibia o crescimento bacteriano e produziu caldo de cultura do fungo e, posteriormente, concentrou o componente antibacteriano. Depois de testar diferentes bactérias, ele descobriu que o mofo só matava bactérias específicas. Por exemplo, Staphylococcus , Streptococcus e o bacilo da difteria ( Corynebacterium diphtheriae ) foram facilmente mortos; mas não houve efeito sobre a bactéria tifóide ( Salmonella typhimurium ) e o bacilo da influenza ( Haemophilus influenzae ). Ele preparou um método de cultura grande a partir do qual poderia obter grandes quantidades de suco de mofo. Ele chamou esse suco de "penicilina", explicando o motivo como "para evitar a repetição da frase um tanto pesada 'Filtrado de caldo de mofo', o nome 'penicilina' será usado". Ele inventou o nome em 7 de março de 1929. Ele mais tarde (em sua palestra no Nobel) deu uma explicação adicional, dizendo:
Frequentemente me perguntam por que inventei o nome "Penicilina". Simplesmente segui linhas perfeitamente ortodoxas e cunhei uma palavra que explicava que a substância penicilina era derivada de uma planta do gênero Penicillium, assim como muitos anos atrás a palavra " Digitalin " foi inventada para uma substância derivada da planta Digitalis .
Fleming não tinha treinamento em química, de modo que deixou todos os trabalhos químicos para Craddock - ele certa vez observou: "Sou bacteriologista, não químico". Em janeiro de 1929, ele recrutou Frederick Ridley, seu ex-pesquisador que havia estudado bioquímica, especificamente para estudar as propriedades químicas do molde. Mas eles não conseguiram isolar a penicilina e, antes que os experimentos terminassem, Craddock e Ridley trocaram Fleming por outros empregos. Foi devido ao fracasso deles em isolar o composto que Fleming praticamente abandonou as pesquisas adicionais sobre os aspectos químicos da penicilina, embora tenha feito testes biológicos até 1939.
Identificação do molde
Após comparação estrutural com diferentes espécies de Penicillium , Fleming inicialmente acreditou que seu espécime era Penicillium chrysogenum , uma espécie descrita pelo microbiologista americano Charles Thom em 1910. Ele teve a sorte de Charles John Patrick La Touche, um botânico irlandês, ter ingressado recentemente como um micologista do St. Mary's para investigar os fungos como a causa da asma. La Touche identificou o espécime como Penicillium rubrum, a identificação usada por Fleming em sua publicação.
Em 1931, Thom reexaminou diferentes Penicillium, incluindo o do espécime de Fleming. Ele chegou a uma conclusão confusa, afirmando: "Ad. 35 [espécime de Fleming] é P. notatum WESTLING. Este é um membro da série P. chrysogenum com conídios menores do que o próprio P. chrysogenum ." O P. notatum foi descrito pelo químico sueco Richard Westling em 1811. A partir de então, o molde de Fleming passou a ser sinônimo de P. notatum e P. chrysogenum. Mas Thom adotou e popularizou o uso de P. chrysogenum. Além de P. notatum , espécies recém-descobertas como P. meleagrinum e P. cyaneofulvum foram reconhecidas como membros de P. chrysogenum em 1977 . Para resolver a confusão, o Décimo Sétimo Congresso Internacional de Botânica, realizado em Viena, Áustria, em 2005, adotou formalmente o nome P. chrysogenum como o nome conservado ( nomen conservandum ). A sequência completa do genoma e a análise filogenética em 2011 revelaram que o fungo de Fleming pertence a P. rubens , uma espécie descrita pelo microbiologista belga Philibert Biourge em 1923, e também que P. chrysogenum é uma espécie diferente.
A fonte da contaminação fúngica no experimento de Fleming permaneceu uma especulação por várias décadas. O próprio Fleming sugeriu em 1945 que os esporos de fungos atravessavam a janela que dava para a Praed Street . Essa história foi considerada um fato e foi popularizada na literatura, começando com o livro de George Lacken, de 1945, The Story of Penicillin . Mas foi mais tarde contestado por seus colegas de trabalho, incluindo Pryce, que testemunhou muito mais tarde que a janela do laboratório de Fleming era mantida fechada o tempo todo. Ronald Hare também concordou em 1970 que a janela ficava trancada na maioria das vezes porque era difícil de alcançar devido a uma grande mesa com aparelhos colocados na frente dela. Em 1966, La Touche disse a Hare que havia dado a Fleming 13 espécimes de fungos (10 de seu laboratório) e apenas um de seu laboratório mostrava atividade antibacteriana semelhante à penicilina. Foi a partir desse ponto que se chegou a um consenso de que o molde de Fleming vinha do laboratório de La Touche, que ficava um andar abaixo do prédio, os esporos sendo lançados no ar pelas portas abertas.
Recepção e publicação
A descoberta de Fleming não foi considerada inicialmente como uma descoberta importante. Mesmo ao mostrar suas placas de cultura aos colegas, tudo o que recebeu foi uma resposta indiferente. Ele descreveu a descoberta em 13 de fevereiro de 1929 perante o Clube de Pesquisa Médica . Sua apresentação intitulada "Um meio para o isolamento do bacilo de Pfeiffer " não recebeu nenhuma atenção especial.
Em 1929, Fleming relatou suas descobertas ao British Journal of Experimental Pathology em 10 de maio de 1929 e foi publicado na edição do mês seguinte. Não conseguiu atrair nenhuma atenção séria. O próprio Fleming não tinha certeza da aplicação médica e estava mais preocupado com o pedido de isolamento bacteriano, como concluiu:
Além de seu possível uso no tratamento de infecções bacterianas, a penicilina é certamente útil para o bacteriologista por seu poder de inibir micróbios indesejáveis em culturas bacterianas, de modo que bactérias insensíveis à penicilina podem ser facilmente isoladas. Um exemplo notável disso é o isolamento muito fácil do bacilo Pfeiffers da gripe quando a penicilina é usada ... Sugere-se que pode ser um anti-séptico eficiente para aplicação ou injeção em áreas infectadas com micróbios sensíveis à penicilina.
GE Breen, um colega do Chelsea Arts Club , certa vez perguntou a Fleming: "Eu só queria que você me dissesse se acha que algum dia será possível fazer uso prático dessas coisas [penicilina]. Por exemplo, eu poderia usá-la ? " Fleming olhou vagamente por um momento e depois respondeu: "Não sei. É muito instável. Terá de ser purificado e não posso fazer isso sozinho." Mesmo em 1941, o British Medical Journal relatou que "os principais fatos emergentes de um estudo muito abrangente [da penicilina] em que uma grande equipe de trabalhadores está envolvida ... não parecem ter sido considerados possivelmente úteis de qualquer outro ponto de vista. "
Isolamento
Em 1939, Ernst Boris Chain , um químico alemão (posteriormente naturalizado britânico), ingressou na Escola de Patologia Sir William Dunn da Universidade de Oxford para fazer pesquisas sobre antibióticos. Ele ficou imediatamente impressionado com o artigo de Fleming de 1929 e informou seu supervisor, o cientista australiano Howard Florey (mais tarde Barão Florey), sobre a droga potencial. Àquela altura, Florey havia adquirido uma bolsa de pesquisa de US $ 25.000 da Fundação Rockefeller para estudar antibióticos. Ele montou uma equipe de pesquisa incluindo Edward Abraham , Arthur Duncan Gardner , Norman Heatley , Margaret Jennings , J. Orr-Ewing e G. Sanders, além de Chain.
A equipe de Oxford preparou um extrato concentrado de P. rubens como "um pó marrom" que "foi obtido e é livremente solúvel em água". Eles descobriram que o pó não era apenas eficaz in vitro contra culturas bacterianas, mas também e in vivo contra infecções bacterianas em camundongos. Em 5 de maio de 1939, eles injetaram um grupo de oito camundongos com uma cepa virulenta de S. aureus e, em seguida, injetaram a solução de penicilina em quatro deles. Depois de um dia, todos os camundongos não tratados morreram enquanto os camundongos tratados com penicilina sobreviveram. Chain observou isso como "um milagre". Eles publicaram suas descobertas no The Lancet em 1940.
A equipe relatou detalhes do método de isolamento em 1941 com um esquema para extração em grande escala. Eles também descobriram que a penicilina era mais abundante como concentrado amarelo do extrato de mofo. Mas eles foram capazes de produzir apenas pequenas quantidades. No início de 1942, eles podiam preparar um composto altamente purificado e trabalharam na fórmula química como C 24 H 32 O 10 N 2 Ba. Em meados de 1942, Chain, Abraham e ER Holiday relataram a produção do composto puro.
Primeiro uso médico
Fleming realizou o primeiro ensaio clínico com penicilina em Craddock. Craddock desenvolveu infecção grave do antro nasal ( sinusite ) e foi submetido a uma cirurgia. Fleming aproveitou a abertura cirúrgica da passagem nasal e começou a injetar penicilina em 9 de janeiro de 1929, mas sem efeito. Provavelmente se deveu ao fato de a infecção ser pelo bacilo da gripe ( Haemophilus influenzae ), a bactéria que ele considerou inaceitável à penicilina. Fleming deu algumas de suas amostras originais de penicilina a seu colega cirurgião Arthur Dickson Wright para teste clínico em 1928. Embora Wright tenha dito que "parecia funcionar satisfatoriamente", não há registros de seu uso específico.
Cecil George Paine, um patologista da Royal Infirmary em Sheffield , foi o primeiro a usar penicilina com sucesso para tratamento médico. Ele era um ex-aluno de Fleming e quando soube da descoberta, pediu a amostra de penicilina de Fleming. Ele inicialmente tentou tratar a sicose (erupções nos folículos da barba) com penicilina, mas não teve sucesso, provavelmente porque a droga não penetrou fundo o suficiente. Passando para a oftalmia neonatorum , uma infecção gonocócica em bebês, ele alcançou a primeira cura em 25 de novembro de 1930, quatro pacientes (um adulto, os outros bebês) com infecções oculares.
A equipe de Florey em Oxford mostrou que o extrato de Penicillium matou diferentes bactérias ( Streptococcus pyogenes, Staphylococcus aureus e Clostridium septique ) em cultura e curou eficazmente a infecção por Streptococcus em camundongos. Eles relataram na edição de 24 de agosto de 1940 do The Lancet como "Penicilina como um agente quimioterápico" com uma conclusão:
Os resultados são claros e mostram que a penicilina é ativa in vivo contra pelo menos três dos organismos inibidos in vitro. Parece uma esperança razoável que todos os organismos em alta diluição in vitro possam ser tratados in vivo. A penicilina não parece estar relacionada a nenhuma substância quimioterápica atualmente em uso e é particularmente notável por sua atividade contra os organismos anaeróbios associados à gangrena gasosa .
Em 1941, a equipe de Oxford tratou um policial, Albert Alexander , com uma infecção facial grave; sua condição melhorou, mas o suprimento de penicilina acabou e ele morreu. Posteriormente, vários outros pacientes foram tratados com sucesso. Em dezembro de 1942, os sobreviventes do incêndio em Cocoanut Grove em Boston foram os primeiros pacientes queimados a serem tratados com sucesso com penicilina.
O teste clínico mais importante foi em agosto de 1942, quando Fleming curou Harry Lambert de uma infecção fatal do sistema nervoso ( meningite estreptocócica ). Lambert era um colega de trabalho de Robert, irmão de Fleming, que havia solicitado Fleming para tratamento médico. Fleming pediu a Florey a amostra de penicilina purificada, que Fleming imediatamente usou para injetar no canal espinhal de Lambert. Lambert mostrou sinais de melhora no dia seguinte e se recuperou completamente em uma semana. Fleming relatou seu ensaio clínico no The Lancet em 1943. Foi com base nessas evidências médicas que o Gabinete de Guerra britânico criou o Comitê de Penicilina em 5 de abril de 1943. O comitê consistia em Cecil Weir , Diretor Geral de Equipamentos, como Presidente, Fleming, Florey , Sir Percival Hartley , Allison e representantes de empresas farmacêuticas como membros. Isso levou à produção em massa de penicilina no ano seguinte.
Produção em massa
Sabendo que a produção em grande escala para uso médico era fútil em um laboratório confinado, a equipe de Oxford tentou convencer o governo britânico devastado pela guerra e as empresas privadas a produzir em massa, mas em vão. Florey e Heatley viajaram para os Estados Unidos em junho de 1941 para persuadir o governo dos Estados Unidos e as empresas farmacêuticas de lá. Sabendo que manter a amostra do molde em frascos poderia ser facilmente perdido, eles mancharam os bolsos do revestimento com o molde. Eles chegaram a Washington DC no início de julho para discutir com Ross Granville Harrison , presidente do Conselho Nacional de Pesquisa (NRC), e Charles Thom e Percy Wells do Departamento de Agricultura dos Estados Unidos . Eles foram orientados a abordar o Laboratório de Pesquisa Regional do Norte do USDA (NRRL, agora o Centro Nacional de Pesquisa de Utilização Agrícola ), onde fermentações em grande escala eram feitas. Eles chegaram a Peoria, Illinois , em 14 de julho para encontrar Andrew Jackson Moyer e Robert D. Coghill no NRRL. Os americanos rapidamente trabalharam no molde e foram capazes de fazer cultura no final de julho. Mas eles perceberam que o molde de Fleming não era eficiente o suficiente para produzir grandes quantidades de penicilina.
Kenneth Bryan Raper, micologista do NRRL, teve a ajuda do Comando de Transporte do Exército dos EUA para pesquisar moldes semelhantes em diferentes partes do mundo e os melhores moldes foram encontrados em Chungkin (China), Bombaim (Mumbai, Índia) e Cidade do Cabo (Sul África). Mas a melhor amostra foi de melão (um tipo de melão) vendido no mercado de frutas de Peoria em 1943. O fungo foi identificado como P. chrysogenum e designado como NRRL 1951 ou cepa de melão. Há uma história popular de que Mary K. Hunt (ou Mary Hunt Stevens), uma funcionária da Raper, coletou o molde; pelo qual ela foi popularizada como "Maria Mofada". Mas Raper considerou essa história um "folclore" e que a fruta foi entregue ao laboratório por uma mulher da feira de frutas de Peoria.
Entre 1941 e 1943, Moyer, Coghill e Kenneth Raper desenvolveram métodos para a produção industrializada de penicilina e isolaram cepas de alto rendimento do fungo Penicillium . A pesquisa simultânea de Jasper H. Kane e outros cientistas da Pfizer no Brooklyn desenvolveu o método prático de fermentação em tanque profundo para a produção de grandes quantidades de penicilina de grau farmacêutico.
Quando a produção começou, os recipientes de um litro tinham um rendimento de menos de 1%, mas melhoraram para um rendimento de 80 a 90% em recipientes de 10.000 galões. Esse aumento de eficiência aconteceu entre 1939 e 1945 como resultado da inovação contínua do processo. Orvill May, o diretor do Serviço de Pesquisa Agrícola , fez com que Robert Coghill, que era o chefe da divisão de fermentação, usasse sua experiência com fermentação para aumentar a eficiência da extração de penicilina do molde. Pouco depois do início, Moyer substituiu a sacarose por lactose no meio de crescimento, o que resultou em um aumento no rendimento. Um aumento ainda maior ocorreu quando Moyer adicionou licor de maceração de milho .
Um grande problema com o processo que os cientistas enfrentaram foi a ineficiência de fazer crescer o mofo na superfície de seus banhos de nutrientes, em vez de deixá-lo submerso. Embora um processo submerso de crescimento do molde fosse mais eficiente, a cepa usada não era adequada para as condições que exigiria. Isto levou NRRL a uma busca por uma estirpe que já havia sido adaptado para o trabalho, e um foi encontrado em um mofado melão adquirido de um Peoria mercado dos fazendeiros . Para melhorar essa cepa, os pesquisadores a submeteram a raios-X para facilitar as mutações em seu genoma e conseguiram aumentar ainda mais a capacidade de produção.
Agora que os cientistas tinham um molde que crescia bem submerso e produzia uma quantidade aceitável de penicilina, o próximo desafio era fornecer o ar necessário para o molde crescer. Isso foi resolvido com um arejador, mas o arejamento causou forte formação de espuma como resultado da infusão do milho. O problema da formação de espuma foi resolvido com a introdução de um agente antiespuma conhecido como monoricinoleato de glicerila.
Análises químicas
A estrutura química da penicilina foi proposta pela primeira vez por Edward Abraham em 1942. Dorothy Hodgkin determinou a estrutura química correta da penicilina usando cristalografia de raios X em Oxford em 1945. Em 1945, o Comitê de Pesquisa Médica dos Estados Unidos e o Conselho de Pesquisa Médica Britânica publicaram em conjunto em Ciências, análises químicas feitas em diferentes universidades, empresas farmacêuticas e departamentos de pesquisa do governo. O relatório anunciou a existência de diferentes formas de compostos de penicilina que compartilhavam o mesmo componente estrutural denominado β-lactama . As penicilinas receberam vários nomes, como usando algarismos romanos no Reino Unido (como penicilina I, II, III) em ordem de suas descobertas e letras (como F, G, K e X) referindo-se às suas origens ou fontes, conforme abaixo :
| Nomenclatura do Reino Unido | Nomenclatura dos EUA | Nome químico |
|---|---|---|
| Penicilina I | Penicilina F | 2-pentenilpenicilina |
| Penicilina II | Penicilina G | Benzilpenicilina |
| Penicilina III | Penicilina X | p- hidroxibenzilpenicilina |
| Penicilina IV | Penicilina K | n- heptilpenicilina |
Os nomes químicos foram baseados nas cadeias laterais dos compostos. Para evitar os nomes polêmicos, a Chain introduziu em 1948 os nomes químicos como nomenclatura padrão, observando como: "Para tornar a nomenclatura o mais inequívoca possível, decidiu-se substituir o sistema de números ou letras por prefixos indicando a natureza química do lado cadeia R. "
Em Kundl , Tyrol , Austria , em 1952, Hans e Ernst Margreiter Brandl de Biochemie (agora Sandoz ) desenvolveu o primeiro ácido penicilina-estável para administração oral, penicilina V . O químico americano John C. Sheehan do Massachusetts Institute of Technology (MIT) concluiu a primeira síntese química de penicilina em 1957. Sheehan havia iniciado seus estudos sobre a síntese de penicilina em 1948 e, durante essas investigações, desenvolveu novos métodos para a síntese de peptídeos , como bem como novos grupos de proteção - grupos que mascaram a reatividade de certos grupos funcionais. Embora a síntese inicial desenvolvida por Sheehan não fosse apropriada para a produção em massa de penicilinas, um dos compostos intermediários na síntese de Sheehan foi o ácido 6-aminopenicilânico (6-APA), o núcleo da penicilina.
Um desenvolvimento importante foi a descoberta do próprio 6-APA. Em 1957, pesquisadores do Beecham Research Laboratories (agora Beechem Group) em Surrey isolaram o 6-APA do meio de cultura de P. chrysogenum . Descobriu-se que o 6-APA constituía o 'núcleo' central da penicilina (na verdade, todos os antibióticos β-lactâmicos) e foi facilmente modificado quimicamente ao anexar cadeias laterais por meio de reações químicas. A descoberta foi publicada na Nature em 1959). Isso abriu o caminho para novos e melhores medicamentos, já que todas as penicilinas semissintéticas são produzidas a partir da manipulação química do 6-APA.
O antibiótico β-lactâmico semissintético de segunda geração meticilina , projetado para combater as penicilinases resistentes de primeira geração, foi introduzido no Reino Unido em 1959. As formas de Staphylococcus aureus resistentes à meticilina provavelmente já existiam na época.
Resultados
Fleming, Florey e Chain dividiram igualmente o Prêmio Nobel de Fisiologia ou Medicina de 1945 "pela descoberta da penicilina e seu efeito curativo em várias doenças infecciosas".
Os métodos de produção e isolamento de penicilina foram patenteados por Andrew Jackson Moyer nos Estados Unidos em 1945. Chain queria registrar uma patente, Florey e seus companheiros se opuseram, argumentando que deveria ser um benefício para todos. Sir Henry Dale aconselhou especificamente que fazer isso seria antiético. Quando Fleming soube das patentes americanas sobre a produção de penicilina, ficou furioso e comentou:
Encontrei a penicilina e a dei de graça para o benefício da humanidade. Por que deveria se tornar um monopólio lucrativo de fabricantes em outro país?
Dorothy Hodgkin recebeu o Prêmio Nobel de Química em 1964 "por suas determinações por técnicas de raios X das estruturas de importantes substâncias bioquímicas".
Desenvolvimento de derivados da penicilina
A estreita gama de doenças tratáveis ou "espectro de atividade" das penicilinas, juntamente com a fraca atividade da fenoximetilpenicilina oralmente ativa, levou à busca de derivados da penicilina que pudessem tratar uma gama mais ampla de infecções. O isolamento do 6-APA, o núcleo da penicilina, permitiu a preparação de penicilinas semissintéticas, com vários aprimoramentos em relação à benzilpenicilina (biodisponibilidade, espectro, estabilidade, tolerância). O primeiro grande desenvolvimento foi a ampicilina em 1961. Ela foi produzida pelo Beecham Research Laboratories em Londres. Era mais vantajoso do que a penicilina original, pois oferecia um espectro mais amplo de atividade contra bactérias Gram-positivas e Gram-negativas. O desenvolvimento posterior rendeu penicilinas resistentes à β-lactamase , incluindo flucloxacilina , dicloxacilina e meticilina . Estes foram significativos por sua atividade contra espécies bacterianas produtoras de β-lactamase, mas foram ineficazes contra as cepas de Staphylococcus aureus resistentes à meticilina (MRSA) que surgiram posteriormente.
Outro desenvolvimento da linha das verdadeiras penicilinas foram as penicilinas antipseudomonais, como a carbenicilina , a ticarcilina e a piperacilina , úteis por sua atividade contra bactérias Gram-negativas . No entanto, a utilidade do anel β-lactama era tal que antibióticos relacionados, incluindo os mecilinames , os carbapenemos e, mais importante, as cefalosporinas , ainda o retêm no centro de suas estruturas.
Os β-lactâmicos relacionados com as penicilinas tornaram-se os antibióticos mais usados no mundo. A amoxicilina, uma penicilina semissintética desenvolvida pelo Beecham Research Laboratories em 1970, é a mais comumente usada de todas.
Resistência a droga
Fleming alertou a possibilidade de resistência à penicilina em condições clínicas em sua palestra no Nobel, e disse:
Pode chegar o momento em que a penicilina possa ser comprada por qualquer pessoa nas lojas. Então, existe o perigo de que o homem ignorante possa facilmente se subdosar e, ao expor seus micróbios a quantidades não letais da droga, torne-os resistentes.
Em 1940, Ernst Chain e Edward Abraham relataram a primeira indicação de resistência aos antibióticos à penicilina, uma cepa de E. coli que produzia a enzima penicilinase , que era capaz de quebrar a penicilina e anular completamente seu efeito antibacteriano. Chain e Abraham descobriram a natureza química da penicilinase, que relataram na Nature como:
A conclusão de que a substância ativa é uma enzima é extraída do fato de que ela é destruída por aquecimento a 90 ° por 5 minutos e por incubação com papaína ativada com cianeto de potássio a pH 6, e que não é dialisável por meio de ' Celofane ' membranas.
Em 1942, foi documentado que cepas de Staphylococcus aureus desenvolveram uma forte resistência à penicilina. A maioria das cepas era resistente à penicilina na década de 1960. Em 1967, o Streptococcus pneumoniae também foi relatado como resistente à penicilina. Muitas cepas de bactérias desenvolveram resistência à penicilina.
Notas
Referências
Leitura adicional
- Bud R (2007). Penicilina: triunfo e tragédia . Oxford: Oxford University Press. ISBN 9780199254064.
- Brown KW (2004). Homem penicilina: Alexander Fleming e a revolução dos antibióticos . Scarborough, Ontário: Sutton Pub. ISBN 978-0-7509-3152-6. (St Mary's Trust Archivist e Alexander Fleming Laboratory Museum Curator)
links externos
- History of Antibiotics , arquivado do original em 14 de maio de 2002 , recuperado em 6 de agosto de 2013, de um curso oferecido na Universidade de Princeton
- Debate na Câmara dos Comuns sobre a história e o futuro da descoberta.