Glucagon - Glucagon
O glucagon é um hormônio peptídico , produzido pelas células alfa do pâncreas . Ele aumenta a concentração de glicose e ácidos graxos na corrente sanguínea e é considerado o principal hormônio catabólico do corpo. Também é usado como medicamento para tratar vários problemas de saúde. Seu efeito é oposto ao da insulina , que reduz a glicose extracelular. É produzido a partir do proglucagon , codificado pelo gene GCG .
O pâncreas libera glucagon quando a quantidade de glicose na corrente sanguínea está muito baixa. O glucagon faz com que o fígado participe da glicogenólise : convertendo o glicogênio armazenado em glicose , que é liberada na corrente sanguínea. Os níveis elevados de glicose no sangue, por outro lado, estimulam a liberação de insulina. A insulina permite que a glicose seja captada e usada pelos tecidos dependentes de insulina. Assim, o glucagon e a insulina fazem parte de um sistema de feedback que mantém os níveis de glicose no sangue estáveis. O glucagon aumenta o gasto de energia e é elevado em condições de estresse. O glucagon pertence à família de hormônios secretina .
Função
O glucagon geralmente eleva a concentração de glicose no sangue , promovendo a gliconeogênese e a glicogenólise . O glucagon também diminui a síntese de ácidos graxos no tecido adiposo e no fígado, além de promover a lipólise nesses tecidos, o que faz com que eles liberem ácidos graxos na circulação, onde podem ser catabolisados para gerar energia em tecidos como o músculo esquelético, quando necessário.
A glicose é armazenada no fígado na forma de glicogênio polissacarídeo , que é um glucano (um polímero feito de moléculas de glicose). As células do fígado ( hepatócitos ) possuem receptores de glucagon . Quando o glucagon se liga aos receptores do glucagon, as células do fígado convertem o glicogênio em moléculas individuais de glicose e as liberam na corrente sanguínea, em um processo conhecido como glicogenólise . À medida que esses estoques se esgotam, o glucagon estimula o fígado e os rins a sintetizarem glicose adicional por gliconeogênese . O glucagon desliga a glicólise no fígado, fazendo com que os intermediários glicolíticos sejam transportados para a gliconeogênese.
O glucagon também regula a taxa de produção de glicose por meio da lipólise . O glucagon induz a lipólise em humanos em condições de supressão da insulina (como diabetes mellitus tipo 1 ).
A produção de glucagon parece ser dependente do sistema nervoso central por meio de vias ainda a serem definidas. Em animais invertebrados , foi relatado que a remoção do pedículo ocular afeta a produção de glucagon. A excisão do pedículo ocular em lagostins jovens produz hiperglicemia induzida por glucagon .
Mecanismo de ação
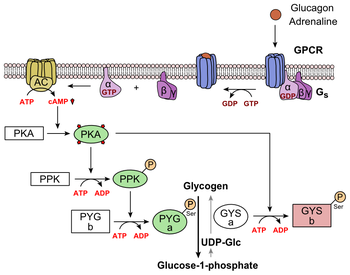
O glucagon se liga ao receptor do glucagon , um receptor acoplado à proteína G , localizado na membrana plasmática da célula. A mudança de conformação no receptor ativa as proteínas G , uma proteína heterotrimérica com subunidades α, β e γ. Quando a proteína G interage com o receptor, ela sofre uma mudança conformacional que resulta na substituição da molécula de GDP que estava ligada à subunidade α por uma molécula de GTP . Essa substituição resulta na liberação da subunidade α das subunidades β e γ. A subunidade alfa ativa especificamente a próxima enzima na cascata, a adenilato ciclase .
A adenilato ciclase fabrica monofosfato de adenosina cíclico (AMP cíclico ou cAMP), que ativa a proteína quinase A (proteína quinase dependente de cAMP). Essa enzima, por sua vez, ativa a fosforilase quinase , que então fosforila o glicogênio fosforilase b (PYG b), convertendo-o na forma ativa denominada fosforilase a (PYG a). A fosforilase a é a enzima responsável pela liberação de glicose 1-fosfato dos polímeros de glicogênio. Um exemplo da via seria quando o glucagon se liga a uma proteína transmembrana. As proteínas transmembrana interagem com Gɑβ𝛾. Gɑ separa-se de Gβ𝛾 e interage com a proteína transmembranar adenilil ciclase. A adenilil ciclase catalisa a conversão de ATP em cAMP. O cAMP liga-se à proteína quinase A e o complexo fosforila a fosforilase quinase. Fosforilada fosforilase quinase fosforila fosforilase. A fosforilase fosforilada corta unidades de glicose do glicogênio como glicose 1-fosfato. Além disso, o controle coordenado da glicólise e da gliconeogênese no fígado é ajustado pelo estado de fosforilação das enzimas que catalisam a formação de um potente ativador da glicólise denominado frutose 2,6-bifosfato. A enzima proteína quinase A (PKA) que foi estimulada pela cascata iniciada pelo glucagon também fosforilará um único resíduo de serina da cadeia polipeptídica bifuncional contendo as enzimas frutose 2,6-bisfosfatase e fosfofrutoquinase-2. Esta fosforilação covalente iniciada pelo glucagon ativa o primeiro e inibe o último. Isso regula a reação que catalisa a frutose 2,6-bifosfato (um potente ativador da fosfofrutocinase-1, a enzima que é a principal etapa regulatória da glicólise), diminuindo a taxa de sua formação, inibindo assim o fluxo da via da glicólise e permitindo a gliconeogênese para predominar. Esse processo é reversível na ausência de glucagon (e, portanto, na presença de insulina).
A estimulação da PKA pelo glucagon também inativa a enzima glicolítica piruvato quinase nos hepatócitos.
Fisiologia
Produção
O hormônio é sintetizado e secretado pelas células alfa ( células α) das ilhotas de Langerhans , localizadas na porção endócrina do pâncreas. A produção, que de outra forma é livre, é suprimida / regulada pela amilina, um hormônio peptídico co-secretado com insulina pelas células β pancreáticas. À medida que os níveis de glicose plasmática diminuem, a redução subsequente na secreção de amilina alivia a supressão das células α, permitindo a secreção de glucagon.
Em roedores, as células alfa estão localizadas na borda externa da ilhota. A estrutura das ilhotas humanas é muito menos segregada e as células alfa são distribuídas por toda a ilhota nas proximidades das células beta. O glucagon também é produzido por células alfa no estômago.
Pesquisas recentes demonstraram que a produção de glucagon também pode ocorrer fora do pâncreas, sendo o intestino o local mais provável de síntese extrapancreática de glucagon.
Regulamento
A secreção de glucagon é estimulada por:
- Hipoglicemia
- Epinefrina (via receptores β2, α2 e α1 adrenérgicos)
- Arginina
- Alanina (geralmente de transaminação de piruvato / glutamato derivada do músculo (ver reação de alanina transaminase ).
- Acetilcolina
- Colecistoquinina
- Polipeptídeo inibitório gástrico
A secreção de glucagon é inibida por:
- Somatostatina
- Amilina
- Insulina (via GABA )
- PPAR? / Receptor de retinóide X heterodímero .
- Aumento de ácidos graxos livres e cetoácidos no sangue.
- Aumento da produção de ureia
- Peptídeo-1 semelhante ao glucagon
Estrutura
O glucagon é um polipeptídeo de 29 aminoácidos . Sua estrutura primária em humanos é: NH 2 - His - Ser - Gln - Gly - Thr - Phe - Thr - Ser - Asp - Tyr - Ser - Lys - Tyr - Leu - Asp - Ser - Arg - Arg - Ala - Gln - Asp - Phe - Val - Gln - Trp - Leu - Met - Asn - Thr - COOH (HSQGTFTSDYSKYLDSRRAQDFVQWLMNT).
O polipeptídeo tem uma massa molecular de 3485 daltons . O glucagon é um hormônio peptídico (não esteróide ).
O glucagon é gerado a partir da clivagem do proglucagon pela pró-proteína convertase 2 em células da ilhota pancreática α. Nas células L intestinais , o proglucagon é clivado nos produtos alternativos glicentina, GLP-1 (uma incretina ), IP-2 e GLP-2 (promove o crescimento intestinal).
Patologia
Níveis anormalmente elevados de glucagon podem ser causados por tumores pancreáticos , como glucagonoma , cujos sintomas incluem eritema necrolítico migratório , redução de aminoácidos e hiperglicemia. Pode ocorrer isoladamente ou no contexto de neoplasia endócrina múltipla tipo 1 .
O glucagon elevado é o principal contribuinte para a cetoacidose hiperglicêmica no diabetes tipo 1 não diagnosticado ou mal tratado. À medida que as células beta param de funcionar, a insulina e o GABA pancreático não estão mais presentes para suprimir a produção livre de glucagon. Como resultado, o glucagon é liberado no máximo das células alfa, causando uma rápida degradação do glicogênio em glicose e rápida cetogênese. Foi descoberto que um subconjunto de adultos com diabetes tipo 1 demorou 4 vezes mais tempo, em média, para se aproximar da cetoacidose quando recebeu somatostatina (inibe a produção de glucagon) sem insulina. A inibição do glucagon tem sido uma ideia popular para o tratamento do diabetes; no entanto, alguns alertaram que isso causaria diabetes frágil em pacientes com glicose no sangue adequadamente estável.
A ausência de células alfa (e, portanto, de glucagon) é considerada uma das principais influências na extrema volatilidade da glicose no sangue no contexto de uma pancreatectomia total .
História
Na década de 1920, Kimball e Murlin estudaram extratos pancreáticos e descobriram uma substância adicional com propriedades hiperglicêmicas . Eles descreveram o glucagon em 1923. A sequência de aminoácidos do glucagon foi descrita no final dos anos 1950. Uma compreensão mais completa de seu papel na fisiologia e na doença não foi estabelecida até a década de 1970, quando um radioimunoensaio específico foi desenvolvido.
Etimologia
Kimball e Murlin cunharam o termo glucagon em 1923, quando inicialmente chamaram a substância de gluc ose agon ist.
Veja também
Referências
links externos
- PDBe-KB fornece uma visão geral de todas as informações de estrutura disponíveis no PDB para Glucagon Humano