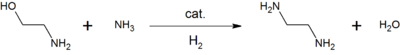Etanolamina - Ethanolamine

|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
2-aminoetan-1-ol |
|
| Outros nomes | |
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100,004,986 |
| Número EC | |
| KEGG | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 2 H 7 N ó | |
| Massa molar | 61,084 g · mol −1 |
| Aparência | Líquido incolor viscoso |
| Odor | Desagradável amônia -como odor |
| Densidade | 1,0117 g / cm 3 |
| Ponto de fusão | 10,3 ° C (50,5 ° F; 283,4 K) |
| Ponto de ebulição | 170 ° C (338 ° F; 443 K) |
| Miscível | |
| Pressão de vapor | 64 Pa (20 ° C) |
| Acidez (p K a ) | 9,50 |
|
Índice de refração ( n D )
|
1,4539 (20 ° C) |
| Perigos | |
| Ficha de dados de segurança | Sigma |
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | Perigo |
| H302 , H312 , H332 , H314 , H335 , H412 | |
| P261 , P273 , P305 + 351 + 338 , P303 + 361 + 353 | |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | 85 ° C (185 ° F; 358 K) (vaso fechado) |
| 410 ° C (770 ° F; 683 K) | |
| Limites explosivos | 5,5-17% |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
|
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
TWA: 3 ppm (6 mg / m 3 ) |
|
REL (recomendado)
|
|
|
IDLH (perigo imediato)
|
30 ppm |
| Compostos relacionados | |
|
Compostos relacionados
|
|
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
A etanolamina ( 2-aminoetanol , monoetanolamina , ETA ou MEA ) é um composto químico orgânico com a fórmula HOCH 2 CH 2 NH 2 ou C 2 H 7 NO. A molécula é bifuncional , contendo uma amina primária e um álcool primário . A etanolamina é um incolor , viscoso líquido com um odor reminiscente de amoníaco . As moléculas de ETA são um componente da formação das membranas celulares e, portanto, um bloco de construção molecular para a vida. Acreditava-se que existisse apenas na Terra e em certos asteróides, mas em 2021 foram encontradas evidências de que as moléculas ETA existem no espaço interestelar.
Os derivados da etanolamina são amplamente difundidos na natureza; por exemplo, lipídios , como precursores de uma variedade de N- acetanolaminas (NAEs), que modulam vários processos fisiológicos animais e vegetais , como germinação de sementes , interações planta-patógeno , desenvolvimento de cloroplasto e floração , bem como precursor, combinado com ácido araquidônico ( C 20 H 32 o 2 ; 20: 4 , ω-6 ), para formar o endocannabinoid anandamida (AEA: C 22 H 37 nO 2 ; 20: 4, ω-6).
As etanolaminas compreendem um grupo de aminoálcoois . Uma classe de anti - histamínicos é identificada como etanolaminas, que inclui carbinoxamina , clemastina , dimenidrinato , Clorfenoxamina , difenidramina e doxilamina .
Produção industrial
A monoetanolamina é produzida tratando o óxido de etileno com amônia aquosa ; a reação também produz dietanolamina e trietanolamina . A proporção dos produtos pode ser controlada pela estequiometria dos reagentes.
Bioquímica
A etanolamina é biossintetizada por descarboxilação da serina :
- HOCH 2 CH (CO 2 H) NH 2 → HOCH 2 CH 2 NH 2 + CO 2
A etanolamina é o segundo grupo principal mais abundante de fosfolipídios , substâncias encontradas em membranas biológicas (particularmente aquelas de procariotos); por exemplo, fosfatidiletanolamina . Também é usado em moléculas mensageiras, como palmitoiletanolamida , que tem efeito nos receptores CB1.
Formulários
A etanolamina é comumente chamada de monoetanolamina ou MEA para ser distinguida da dietanolamina (DEA) e da trietanolamina (TEA). É usado como matéria-prima na produção de detergentes , emulsificantes , polidores, produtos farmacêuticos, inibidores de corrosão e intermediários químicos.
Por exemplo, a reação de etanolamina com amônia dá etilenodiamina , um precursor do agente quelante comumente usado , EDTA .
Lavagem do fluxo de gás
As monoetanolaminas podem eliminar as emissões de dióxido de carbono (CO 2 ) de carvão queimado, metano queimado e biogás queimado de dióxido de carbono (CO 2 ) de maneira muito eficiente. A lavagem com monoetanolamina reduz as mudanças climáticas e pode tornar a indústria histórica de carvão e biogás mais moderna, mais saudável e mais comercial. Legalmente, é especialmente relevante para o Acordo de Paris . A depuração de dióxido de carbono da MEA também é usada para regenerar o ar em submarinos.
Soluções de MEA em água são usadas como um líquido de lavagem de fluxo de gás em tratadores de amina . Por exemplo, MEA aquoso é usado para remover o dióxido de carbono (CO 2 ) e sulfureto de hidrogénio (H 2 S) a partir de várias correntes de gás; por exemplo, gás de combustão e gás natural ácido . O MEA ioniza compostos ácidos dissolvidos , tornando-os polares e consideravelmente mais solúveis .
As soluções de lavagem MEA podem ser recicladas por meio de uma unidade de regeneração. Quando aquecido, o MEA, sendo uma base bastante fraca, irá liberar H 2 S ou gás CO 2 dissolvido, resultando em uma solução MEA pura.
Outros usos
Em formulações farmacêuticas, o MEA é usado principalmente para tamponamento ou preparação de emulsões. O MEA pode ser usado como regulador de pH em cosméticos.
É um esclerosante injetável como opção de tratamento de hemorróidas sintomáticas. 2–5 ml de oleato de etanolamina podem ser injetados na mucosa logo acima das hemorróidas para causar ulceração e fixação da mucosa, evitando assim que as hemorróidas descam para fora do canal anal.
É também um ingrediente no fluido de limpeza para pára-brisas de automóveis .
amina de controle de pH
A etanolamina é frequentemente usado para a alcalinização da água nos ciclos de vapor de centrais eléctricas, incluindo nucleares centrais eléctricas com reactores pressurizados de água . Esta alcalinização é realizada para controlar a corrosão de componentes metálicos. O ETA (ou às vezes uma amina orgânica semelhante; por exemplo, morfolina ) é selecionado porque não se acumula em geradores de vapor (caldeiras) e fendas devido à sua volatilidade, mas sim se distribui de maneira relativamente uniforme ao longo de todo o ciclo do vapor. Nessa aplicação, o ETA é um ingrediente chave do chamado "tratamento totalmente volátil" da água (AVT).
Reações
Após a reação com dióxido de carbono , 2 equivalentes de etanolamina reagem através da intermediação do ácido carbônico para formar um sal carbamato , que quando aquecido reforma a etanolamina e o dióxido de carbono.