Ecologia do Estuário de São Francisco - Ecology of the San Francisco Estuary
O Estuário de São Francisco junto com o Delta do Rio Sacramento – San Joaquin representa um ecossistema altamente alterado . A região foi fortemente reprojetada para acomodar as necessidades de distribuição de água, transporte marítimo, agricultura e, mais recentemente, desenvolvimento suburbano. Essas necessidades produziram mudanças diretas no movimento da água e na natureza da paisagem, e mudanças indiretas a partir da introdução de espécies não nativas . Novas espécies alteraram a arquitetura da teia alimentar com a mesma certeza que os diques alteraram a paisagem das ilhas e canais que formam o complexo sistema conhecido como Delta.
Este artigo trata particularmente da ecologia da zona de baixa salinidade (LSZ) do estuário. Reconstruir uma teia alimentar histórica para o LSZ é difícil por uma série de razões. Em primeiro lugar, não há um registro claro das espécies que historicamente ocuparam o estuário. Em segundo lugar, o estuário e o delta de São Francisco estiveram em transição geológica e hidrológica durante a maior parte de seus 10.000 anos de história e, portanto, descrever a condição "natural" do estuário é como "atingir um alvo em movimento". Mudanças climáticas , engenharia hidrológica, mudanças nas necessidades de água e espécies recém- introduzidas continuarão a alterar a configuração da teia alimentar do estuário. Este modelo fornece um instantâneo do estado atual, com notas sobre mudanças recentes ou introduções de espécies que alteraram a configuração da teia alimentar. Compreender a dinâmica da cadeia alimentar atual pode ser útil para os esforços de restauração para melhorar o funcionamento e a diversidade de espécies do estuário.
Geografia física
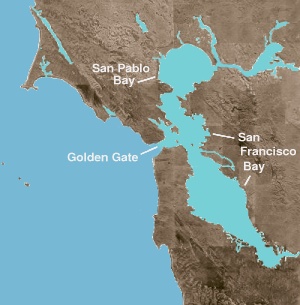
A Baía de São Francisco é tanto uma baía quanto um estuário . O primeiro termo se refere a qualquer enseada ou enseada que forneça um refúgio físico do oceano aberto. Um estuário é qualquer feição fisiográfica onde a água doce encontra um oceano ou mar. A porção norte da baía é um estuário salobro, consistindo de uma série de embainhamentos físicos que são dominados por fluxos de água doce e marinha. Essas entidades geográficas são, passando de salino para fresco (ou de oeste para leste): Baía de San Pablo , imediatamente ao norte da Baía Central; o Estreito de Carquinez , um canal estreito e profundo que leva à Baía de Suisun ; e o Delta dos rios Sacramento e San Joaquin .
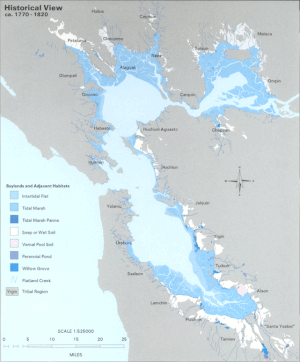
Até o século 20, o LSZ do estuário foi cercada por tule -dominated água doce zonas húmidas . Entre 80 e 95% dessas zonas úmidas históricas foram preenchidas para facilitar o uso da terra e o desenvolvimento ao redor da área da baía. Acredita-se que a perda de habitat nas bordas da zona pelágica crie uma perda de espécies de peixes pelágicos nativos , aumentando a vulnerabilidade à predação.
O estuário intertidal e bentônico é atualmente dominado por lodaçais que são em grande parte o resultado da sedimentação derivada da mineração de ouro na Sierra Nevada no final do século XIX. A tendência de altas cargas de sedimentos foi revertida na década de 1950 com o advento do Projeto Vale Central , prendendo a maior parte dos sedimentos atrás das represas e resultando em uma perda líquida anual de sedimentos do estuário. Assim, os lamaçais parecem estar recuando lentamente, embora a turbidez permaneça extremamente alta. A alta turbidez da água é responsável pela condição única que existe no Estuário de São Francisco, em que a alta disponibilidade de nutrientes não leva a uma alta produção de fitoplâncton. Em vez disso, a maioria dos organismos fotossintéticos de algas tem limitação de luz.
O Delta também sofreu grandes alterações. A partir do século 19, diques que ocorrem naturalmente foram reforçados para permanência, para proteger as fazendas de inundações regulares. Muitas dessas fazendas foram estabelecidas em ilhas de turfa que ocorrem no meio dos canais do Delta. A agricultura intensiva oxidou o alto teor de carbono do solo, causando considerável perda de massa do solo. Como consequência, essas ilhas diminuíram, ou afundaram, quase 6 metros abaixo do nível do mar. O Delta hoje consiste em cursos d'água altamente recortados, pontuados por ilhas que parecem "bacias flutuantes" com suas bacias muito abaixo da superfície da água. Essas ilhas correm alto risco de inundações devido ao colapso do dique. A mudança subsequente na salinidade para o leste deve alterar dramaticamente a ecologia de todo o LSZ do Estuário de São Francisco.
Hidrodinâmica
O LSZ gira em torno de 2 psu ( unidades práticas de salinidade , uma medida de salinidade) e varia de cerca de 6 psu a 0,5 psu. As principais entradas de água doce para o estuário derivam do escoamento da precipitação regional, o rio Sacramento e o rio San Joaquin.
A vazão do rio é amplamente controlada pela liberação do reservatório a montante. Uma fração significativa desse fluxo é exportada para fora do Delta pelo projeto federal Central Valley e o State Water Project para o sul da Califórnia para uso agrícola e urbano. Essas alterações removeram grande parte da variação na vazão através do estuário (ou seja, água doce que sai do Golden Gate ), criando vazão menor no inverno e vazão maior no verão do que historicamente encontrada no estuário. Em média, os fluxos de água doce para o estuário representam 50% dos fluxos históricos. Fitoplâncton , zooplâncton e peixes larvais e adultos podem ser arrastados para as bombas de exportação, causando um impacto potencialmente significativo, mas desconhecido, na abundância desses organismos. Isso pode ser particularmente verdadeiro para o ameaçado delta smelt , um pequeno peixe endêmico; nada excepcional, exceto que foi descrito como sendo tremendamente abundante em relatos históricos. Acredita-se que o cheiro do delta migre e desova rio acima no Delta durante o início do verão, colocando seus ovos e larvas em alto risco de arrastamento. O manejo do fundido é atualmente fonte de controvérsia, já que sua ecologia coloca em curso de colisão as necessidades díspares de água para conservação, desenvolvimento e agricultura na Califórnia.
O movimento da água para fora do estuário é complexo e depende de vários fatores. Os ciclos das marés fazem com que a água se mova em direção e para longe do Golden Gate quatro vezes em um período de 24 horas.
Usando 2 psu como um marcador para a Zona de Baixa Salinidade, a direção e magnitude das flutuações podem ser rastreadas como sua distância em quilômetros do Golden Gate, ou X2. Como a posição de X2 depende de vários parâmetros físicos, incluindo influxo, exportação e marés, sua posição muda ao longo de muitos quilômetros em um ciclo diário e sazonal; ao longo de um ano, pode variar da Baía de San Pablo, durante os períodos de alto fluxo, até o Delta durante a seca de verão. A posição do X2 é cuidadosamente monitorada e mantida com a liberação de água dos reservatórios a montante em antecipação à demanda de exportação. Isso é exigido pela Decisão do Conselho Estadual de Água 1641 e exige que o bombeamento estadual e federal seja reduzido se X2 for deslocado para leste da Ilha Chipps (75 quilômetros rio acima da ponte Golden Gate) durante os meses de fevereiro a maio, ou a leste de Collinsville ( 81 quilômetros a montante da ponte Golden Gate) durante os meses de janeiro, junho, julho e agosto. (D-1641 pp 150)
A circulação gravitacional faz com que a água estratificada de alta salinidade em profundidade flua para a terra, enquanto a água de baixa salinidade no topo flui para o mar. O efeito da circulação gravitacional pode ser mais pronunciado durante os períodos de alto fluxo de água doce, fornecendo um feedback negativo para a manutenção do campo de sal e a distribuição dos organismos pelágicos no estuário.
A mistura é importante na borda terrestre da circulação gravitacional, geralmente em torno de X2, onde a coluna de água se torna menos estratificada. Uma zona de mistura fixa ocorre no "Benicia Bump" na extremidade leste do Estreito de Carquinez, onde o canal profundo se torna dramaticamente mais raso ao entrar na Baía de Suisun. A mistura é crítica para manter a salinidade, de modo que entradas extremamente grandes de água doce são necessárias para mover X2 a uma curta distância para o oeste. A mistura também ajuda os organismos pelágicos a manter a posição no estuário, retardando a advecção da produção primária e secundária para fora do sistema.
Zona pelágica
Os organismos pelágicos passam toda ou parte de suas vidas em águas abertas, onde o habitat é definido não por bordas, mas pela tolerância fisiológica à salinidade e à temperatura. A Zona de Baixa Salinidade (LSZ) do Estuário de São Francisco constitui um habitat para um conjunto de organismos especializados em sobreviver nesta confluência única de influências terrestres , de água doce e marinhas . Embora existam muitos habitats com ecologias distintas que fazem parte do estuário (incluindo sistemas marinhos, de água doce, pântano intertidal e lama bentônica ), cada um está ligado ao LSZ pela exportação e importação de água doce, nutrientes, carbono e organismos.
A distribuição e abundância de organismos no LSZ dependem de fatores abióticos e bióticos. Os fatores abióticos incluem a geografia física e hidrologia do estuário, incluindo entradas de nutrientes , carga de sedimentos , turbidez , estocasticidade ambiental, clima e influências antropogênicas. Fatores abióticos tendem a impulsionar a produção no ambiente estuarino e são mediados por fatores bióticos.
Fatores bióticos incluem absorção de nutrientes e produção primária , produção secundária de zooplâncton , teia alimentar e dinâmica trófica , transferência energética, advecção e dispersão dentro e fora do sistema, sobrevivência e mortalidade , predação e competição de espécies introduzidas .
Teia alimentar
É difícil caracterizar a teia alimentar histórica do Estuário de São Francisco por causa das mudanças dramáticas na geografia, hidrologia e composição de espécies que ocorreram no século passado. No entanto, o monitoramento iniciado na década de 1970 fornece algumas informações sobre a dinâmica histórica da teia alimentar. Antes da década de 1980, o LSZ era dominado por uma teia alimentar movida pelo fitoplâncton, uma população mesoplanctônica estável dominada pelo copépode Eurytemora affinis e um grande macrozooplâncton tipificado pelo camarão San Francisco Bay e camarões misídeos . Eles forneceram nutrição e energia para os filtradores nativos, como a anchova do norte ( Engraulis mordax ), e planctívoros, como o delta smelt e o salmão juvenil .
A mudança da teia alimentar tem sido impulsionada historicamente pelo aumento da turbidez e, mais recentemente, por espécies introduzidas, conforme descrito nas seções sobre produção primária e secundária.
Notavelmente, a alta taxa de eliminação da população de Potamocorbula amurensis de moluscos do rio Amur introduzida produziu um declínio de dez vezes na densidade do plâncton, resultando em uma armadilha de carbono no bentos e um aumento presumido na produção de detritos de resíduos. A hipótese é que esses resíduos alimentem a alça microbiana, resultando em um aumento no microzooplâncton, como o copépode Limnoithona tetraspina , que utiliza rotíferos e ciliados .
Essas mudanças são uma das causas do declínio dos estoques de peixes. Por exemplo, a anchova do norte, Engraulis mordax , era até a década de 1980 bastante abundante na Zona de Baixa Salinidade, até que sua distribuição no estuário ficou restrita às Baías Centro e Sul. Isso se deve provavelmente a uma resposta comportamental após a introdução do molusco do rio Amur ( Potamocorbula amurensis ) e ao subsequente declínio na disponibilidade de plâncton.
Mais recentemente, um declínio geral do organismo pelágico (POD) foi descrito, e isso tem sido fonte de muita preocupação nas comunidades científica, administrativa e política.
Diversas espécies-chave, incluindo delta smelt , longfin smelt , listrado bass e threadfin shad foram declaradas "espécies de interesse" por causa de um declínio gradual na abundância a partir de 2001. Isso foi acompanhado por um declínio semelhante na produtividade secundária e atualmente é o fonte de muita pesquisa. Uma série de hipóteses foram propostas para explicar o POD, incluindo o declínio da rede alimentar, as exportações de água do Delta e tóxicos de fontes urbanas, industriais ou agrícolas.
Produtores
Produção primária e absorção de nutrientes
A produção primária pelo fitoplâncton fixa energia e nutrientes essenciais em uma forma biologicamente disponível (ou seja, alimento), por meio da fotossíntese . A produção de fitoplâncton é amplamente estruturada por parâmetros físicos: disponibilidade de nutrientes, luz solar, turbidez e temperatura.
O Estuário de São Francisco tem várias fontes de nutrientes que podem ser usados para a produção primária, principalmente provenientes de instalações de tratamento de águas residuais, drenagem agrícola e urbana e do oceano. Apesar disso, o estuário é único na medida em que tende a ter uma taxa relativamente baixa de produção primária. Isso provavelmente se deve a dois fatores: grandes aportes de nitrogênio na forma de amônio , que suprime a absorção de nitrato pelo fitoplâncton, que prefere o NH 4 + metabolicamente mais barato , e alta turbidez, que limita a luz necessária para a fotossíntese aos primeiros centímetros de a coluna de água. Essa turbidez é um legado da mineração hidráulica de ouro na Sierra Nevada na década de 1850.
O alto tempo de residência da água no estuário tende a permitir que a biomassa fitoplanctônica se acumule, aumentando a densidade, enquanto o baixo tempo de residência remove o fitoplâncton do estuário. Este último é típico dos canais principais do estuário durante os períodos de alto fluxo, quando as águas superficiais tendem a liberar partículas e plâncton a jusante.
A herbivoria também remove o fitoplâncton da coluna d'água. Embora a teia alimentar pelágica seja baseada na produção de fitoplâncton, a maior parte dessa produção é desviada para o bentos por meio da predação pelo marisco introduzido no Rio Amur ( Corbula amurensis ). Os níveis de biomassa fitoplanctônica diminuíram em uma ordem de magnitude após a introdução generalizada de C. amurensis em meados da década de 1980, e não se recuperaram.
Produção fotossintética
A principal fonte de energia derivada da fotossíntese é o fitoplâncton . De um modo geral, as diatomáceas e microflagelados produzem a maior parte do carbono biodisponível no estuário. Outros tipos, notadamente os dinoflagelados , podem produzir florescências de algas prejudiciais , ou marés vermelhas , que estão menos prontamente disponíveis para assimilação na teia alimentar.
A produção primária do fitoplâncton é função de dois fatores diferentes: taxas de crescimento e acumulação (Fig. 1). Embora o LSZ seja um sumidouro de altas concentrações de nutrientes de fontes urbanas e agrícolas, as taxas de produção de fitoplâncton são bastante baixas. O nitrato é usado de maneira ideal pelo fitoplâncton para o crescimento, mas o amônio (em grande parte derivado de emissários de esgoto) tem um efeito supressor na taxa de crescimento. Assim, embora não seja limitado por nutrientes, o fitoplâncton tende a crescer mais lentamente devido aos tipos de nitrogênio presentes. Outro fator supressor na taxa de crescimento é a alta turbidez do estuário, que limita a capacidade da radiação fotossinteticamente ativa (PAR) de penetrar além dos poucos centímetros superiores da coluna d'água. Isso limita a fotossíntese do fitoplâncton a uma zona fótica relativamente rasa . Assim, quando a coluna de água é estratificada , a turbidez é alta e o amônio está presente, a taxa de crescimento do fitoplâncton é normalmente suprimida.
O acúmulo de fitoplâncton é principalmente o resultado do tempo de residência . O delta norte e a baía de Suisun têm tempos de residência relativamente baixos devido ao alto volume de água que se move pela região para fluxo a jusante e para exportação para o sul da Califórnia. Como a água se move mais rapidamente por essa parte do sistema, a taxa de acúmulo diminui à medida que a produtividade é retirada do sistema. Em contraste, partes do Delta do sul têm um maior tempo de residência devido ao baixo volume de água que se move através do sistema; na verdade, a água ocasionalmente corre para trás, devido à falta de afluência do rio San Joaquin e bombeamento de exportação. Durante o verão, a densidade do fitoplâncton pode ser uma ordem de magnitude maior aqui do que em outras partes do estuário.
A proliferação de algas nocivas (HAB's) de dinoflagelados ou cianobactérias produzem subprodutos metabólicos tóxicos que os tornam nocivos para muitos organismos. Promovidos por uma combinação de altas concentrações de nutrientes e temperaturas, os HABs têm um efeito duplamente negativo na cadeia alimentar ao excluir competitivamente as diatomáceas e microflagelados, reduzindo ainda mais a produção primária biodisponível. Embora certos invertebrados , como os bivalves, possam não ser afetados diretamente, eles podem propagar toxinas na cadeia alimentar, adoecendo ou matando predadores . Não é bem compreendido como os copépodes são afetados. A algas invasivas Microcystis aeruginosa agora é comum no Delta durante os meses de verão e pode reduzir a produtividade dos copépodes (além de ser potencialmente carcinogênica para humanos).
Produção Detrital
Quantidades enormes de fluxo de sedimentos e detritos através do LSZ. Muitos deles são resíduos orgânicos na forma de matéria orgânica dissolvida e particulada (DOM e POM, respectivamente). Além das fontes a montante, a matéria orgânica pode se acumular devido à mortalidade de organismos locais e à produção de resíduos.
Os detritívoros capitalizam esta fonte de energia, criando uma teia alimentar alternativa e paralela de grande importância potencialmente. Isso ocorre porque a fixação de carbono na teia alimentar detrítica não é limitada pela estratificação, turbidez ou duração do dia, todos os quais limitam a fotossíntese. A produção detrital ocorre continuamente, limitada apenas por entradas e advecção do sistema Delta.
As bactérias são os principais agentes de transformação de DOM e POM em carbono biodisponível através da alça microbiana . Este mecanismo é particularmente importante em sistemas marinhos com limitação de nutrientes , onde as bactérias liberam nutrientes dos detritos que afundam, permitindo que sejam reciclados de volta à zona fótica. Pouco trabalho foi aplicado à função da alça microbiana no Estuário de São Francisco, mas pode ser que o papel das bactérias não seja crítico para a reciclagem de nutrientes em um sistema eutrófico . Em vez disso, eles podem fornecer uma cadeia alimentar alternativa por meio do pastoreio direto por flagelados , rotíferos e ciliados .
A alta abundância do ciclopóide copepod Limnoithona tetraspina pode ser devido à sua dependência de ciliados em vez de fitoplâncton como fonte primária de alimento. As principais espécies de copépodes calanóides também podem usar ciliados como fonte suplementar ou mesmo primária de alimento, mas em que grau é desconhecido.
Produção secundária
A produção secundária refere-se a organismos que se alimentam da produção primária e transferem energia para níveis tróficos superiores da teia alimentar estuarina. Historicamente, a produção secundária no Estuário de São Francisco foi dominada pela produção de camarão mysid . No entanto, o mysid nativo Neomysis mercedis foi amplamente substituído pelo Acanthomysis bowmani introduzido , que persiste em densidades mais baixas. O anfípode Gammurus daiberi introduzido pode ter assumido parte desse nicho, mas ele está amplamente restrito à água doce.
Hoje, a principal fonte de produção secundária provém dos copépodes . Acredita-se que o copépode calanóide nativo naturalizado Eurytemora affinis tenha sido introduzido perto do final do século XIX. Ele dominou o zooplâncton da zona de baixa salinidade até os anos 1980, quando foi amplamente substituído por outro copépode calanóide introduzido, Pseudodiaptomus forbesi . P. forbesi persiste mantendo uma população fonte em água doce, regiões de alta residência do estuário, particularmente no Delta, fora da faixa de tolerância de salinidade do molusco do rio Amur. Como o outrora dominante E. affinis não tem alcance a montante, é mais vulnerável à predação pelo molusco e sofre de competição aparente com P. forbesi.
Outros copépodes calanóides que podem ser importantes são os recentemente introduzidos Sinocalanus doerri e Acartiella sinensis . Pouco se sabe sobre as histórias de vida desses organismos, embora com base em sua morfologia, eles possam se alimentar de outros copépodes. Eles aparecem em ciclos irregulares de abundância, durante os quais podem dominar o zooplâncton.
Ainda outro copépode invasivo, o muito pequeno ciclopóide Limnoithona tetraspina , apareceu na Zona de Baixa Salinidade na década de 1990. Desde então, L. tetraspina se tornou o copépode numericamente dominante, atingindo densidades da ordem de 10.000 / m3. Ele depende da alça microbiana como fonte de alimento, alimentando-se de bactérias, ciliados e rotíferos. Além disso, parece invulnerável à predação pelo molusco do rio Amur, por razões desconhecidas. Devido ao seu pequeno tamanho, L. tetraspina geralmente não está disponível para consumo por predadores maiores, principalmente peixes, tornando-se um beco sem saída energético.
Consumidores
Consumidores primários
Os consumidores primários dependem da produção primária como principal fonte de alimento. Os consumidores mais importantes da teia pelágica do LSZ são os copépodes, junto com os rotíferos, flagelados e ciliados mencionados acima. Todas as espécies de copépodes calanóides declinaram sob alta pressão de predação do molusco recentemente introduzido no rio Amur ( Corbula amurensis ). Por causa disso, e porque os copépodes dependem de fontes alimentares fotossintéticas e detríticas, os copépodes no LSZ têm feedback limitado sobre a produção primária, ao contrário dos sistemas marinhos e lênticos, onde os copépodes podem destruir as flores em questão de dias.
Pseudodiaptomus forbesi é o copépodo calanóide dominante do LSZ em termos de biomassa. Tem uma tolerância de salinidade suficientemente ampla que pode persistir tanto em baixa salinidade como em água doce. Esta ampla distribuição ajuda a população a manter um refúgio a montante da predação, ao contrário de outras espécies com tolerâncias de salinidade mais estreitas.
Limnoithona tetraspina tornou-se o copépode ciclopóide numericamente dominante desde sua introdução em 1993. Alimenta-se principalmente de ciliados e microflagelados, mas ao contrário de P. forbesi , é relativamente imune à predação por mariscos ou peixes, daí sua abundância. Energeticamente, L. tetraspina pode ser um beco sem saída para a teia alimentar; esses copépodes são advectados para fora do sistema por marés e correntes ou morrem e caem no bentos, onde podem estar disponíveis para a alça microbiana ou para os detritívoros.
Copépodes predadores
Existem vários copépodes predadores em todo o Delta, sobre os quais se sabe relativamente pouco. Sinocalanus doerri , Acartiella sinensis e Tortanus dextrilobatus parecem ser morfologicamente capazes de predar outros copépodes. Cada um deles foi introduzido no estuário, provavelmente por meio da troca de água de lastro desde os anos 1980. Geralmente, eles não são em abundância suficiente para impactar negativamente os consumidores de copépodes; no entanto, ocorrem florações periódicas de S. doerri e A. sinensis que não foram bem estudadas.
Macroinvertebrados

Embora sejam capazes de se alimentar por filtração , os misídeos (minúsculas criaturas parecidas com camarões) são amplamente carnívoros, alimentando-se de copépodes adultos. Eles forneceram um canal energético entre o plâncton e os peixes planctívoros, incluindo peixes juvenis, esturjão , salmão Chinook e sável americano . Os misídeos já foram abundantes até que o Neomysis mercedis nativo foi substituído em meados da década de 1980 pelo invasor Acanthomysis bowmani , que é menor e menos abundante. O declínio de Mysid foi associado ao declínio subsequente em uma série de espécies de peixes no estuário nas décadas de 1980 e 1990.
Camarões são carnívoros generalistas que se alimentam principalmente de misídeos e anfípodes . O Crangon franciscorum representa uma das duas pescarias comerciais restantes no estuário. Embora não sejam mais usados para "coquetéis de camarão da Baía de São Francisco", eles são colhidos como isca. Outros predadores incluem o robalo-listrado e os salmões adultos e filhotes .
Peixe

Como os peixes são um grupo taxonômica e morfologicamente diverso, as espécies variam em suas ecologias tróficas . Em geral, os peixes podem ser divididos em quatro grandes categorias de alimentação: alimentadores de filtro , planctívoros, piscívoros e alimentadores bentônicos .
Os alimentadores do filtro tensionam a coluna de água indiscriminadamente em busca de pequenas presas, geralmente fito e zooplâncton. Esta categoria de peixes inclui o shad threadfin ( Dorosoma petenense ), o shad americano ( Alosa sapidissima ), o peixe-rei do interior ( Menidia beryllina ) e a anchova ( Engraulis mordax ). Algumas evidências sugerem que algumas dessas espécies são limitadas em alimentos devido aos níveis reduzidos de plâncton após a introdução do molusco do rio Amur. As anchovas deixaram o LSZ em favor de regiões mais produtivas do estuário nas baías de San Pablo e Central.
Jacksmelt ( Atherinopsis californiensis )
O arenque do Pacífico ( Clupea pallasii ), normalmente ao largo da costa, mas entra na baía para desovar de novembro a março.
anchova do norte ( Engraulis mordax ) encontrada na baía de San Pablo e Suisun
Peixe-cana-da- baía ( Syngnathus leptorhynchus ) encontrado em áreas entremarés, comumente entre a erva-doce
Planktivores selectivamente presas sobre zooplâncton indivíduo, tal como copepods, mysids e gammarids . Este grupo inclui a maioria das larvas de peixes, delta smelt ( Hypomesus transpacificus ) e longfin smelt ( Spirinchus thaleichthys ), perca de tule ( Hysterocarpus traski ) e salmão smolts . O delta smelt é de particular interesse devido ao seu status de perigo . Pode ser limitado em comida, mas as evidências são um tanto contraditórias. Outros fatores, como o arrastamento de ovos e larvas no bombeamento de exportação de água doce do Delta também podem explicar a queda.
rockfish marrom ( Sebastes auriculatus )
Peixe-sapo zumbindo ( Porichthys notatus ) encontrado em zonas subtidais
O principal piscívoro do LSZ é o robalo-listrado ( Morone saxatilis ), que foi introduzido na década de 1890 e ataca pesadamente peixes nativos. O robalo é uma pesca esportiva importante no Estuário de São Francisco e, como tal, representa uma pequena retirada de biomassa do estuário.
Os peixes bênticos ou de fundo incluem o esturjão branco ( Acipenser transmontanus ), o bagre branco ( Ameiurus catus ) e a solha estrelado ( Platichthys stellatus ). Por causa de sua orientação de habitat , eles se alimentam principalmente de organismos epibentônicos, como anfípodes, camarões baios e bivalves. Sabe-se que esses peixes se alimentam pelo menos ocasionalmente dos moluscos do rio Amur, o que representaria um dos poucos canais para o fluxo de energia dessa espécie, exceto para a produção de detritos.
A única pescaria comercial no LSZ é a isca de camarão. Há uma variedade de pesca esportiva que representa um fluxo menor de carbono, mas fluxos significativos de capital para as economias locais ao redor do estuário. A maior parte da pesca recreativa envolve o robalo, o esturjão e os baixos de água doce introduzidos no Delta de água doce. Essa escassez de pescarias torna o Estuário de São Francisco único. Quase todos os estuários em todo o mundo sustentam pelo menos remanescentes de pescarias significativas. O Estuário de São Francisco já apoiou pescarias importantes de salmão, anchova e caranguejos Dungeness até a década de 1950. O fim dessas pescarias provavelmente se deveu mais à perda de habitat do que à superexploração .
Tubarão leopardo ( Triakis semifasciata )
tubarão-broadnose sevengill ( Notorynchus cepedianus )
cação espinhosa ( Squalus acanthias ) encontrada na zona subtidal
Esturjão branco ( Acipenser transmontanus )
Pássaros
O Estuário de São Francisco é uma importante parada na rota aérea do Pacífico para aves aquáticas migratórias. Ainda assim, pouco se sabe sobre o fluxo de carbono para dentro ou para fora do estuário via pássaros . Milhões de aves aquáticas usam anualmente as águas rasas da baía como refúgio. A maioria dos pássaros são patos que se alimentam de vegetação aquática submersa. Os patos mergulhadores (como nódulos ) se alimentam de organismos epibentônicos como C. amurensis, representando um possível fluxo de carbono daquele beco sem saída. Duas espécies de aves ameaçadas de extinção são encontradas aqui: a andorinha -do- mar da Califórnia e a baderna da Califórnia . Lamas expostas da baía fornecem importantes áreas de alimentação para aves limícolas , mas as camadas subjacentes de lama da baía representam riscos geológicos para estruturas próximas a muitas partes do perímetro da baía. Aves piscívoras , como o corvo marinho de crista dupla e os pelicanos marrons, também habitam o estuário, mas seu impacto trófico permanece pouco estudado.
Em janeiro de 2015, os cientistas estavam trabalhando para identificar uma camada de substância cinza, espessa, pegajosa e inodora em pássaros ao longo da costa da Baía de São Francisco. Centenas de pássaros morreram e centenas mais foram revestidos com a substância. Os cientistas estão preocupados com outros animais selvagens que podem estar em risco com a substância.
Gaivota-de-bico-redondo ( Larus delawarensis ) em Oakland
Mamíferos
Antes de 1825, espanhóis, franceses, ingleses, russos e americanos eram atraídos para a Bay Area para colher quantidades prodigiosas de castor ( Castor canadensis ), lontra, marta, pescador, vison, raposa, doninha, focas e leões marinhos ( Zalophus californianus ) e lontra do mar ( Enhydra lutris ). Esse primeiro comércio de peles, conhecido como California Fur Rush , foi mais do que qualquer outro fator isolado, responsável pela abertura do oeste e da área da baía de São Francisco , em particular, ao comércio mundial. Em 1817, as lontras marinhas da área foram praticamente eliminadas. Os russos mantiveram uma estação de caça às focas nas vizinhas Ilhas Farallon de 1812 a 1840, pegando de 1.200 a 1.500 focas anualmente, embora navios americanos já tivessem explorado as ilhas. Em 1818, as focas diminuíram rapidamente até que apenas 500 podiam ser capturadas anualmente e, nos anos seguintes, a foca foi extirpada das ilhas até que começaram a recolonizar as ilhas em 1996. Embora os naturalistas do século 20 fossem céticos de que os castores fossem historicamente existente em riachos costeiros ou na própria baía, registros anteriores mostram que o castor dourado da Califórnia ( Castor canadensis ssp. subauratus ) foi um dos animais mais valorizados e aparentemente foi encontrado em grande abundância. Thomas McKay relatou que em um ano a Hudson's Bay Company pegou 4.000 peles de castor nas margens da Baía de São Francisco. Recentemente, os castores recolonizaram o pântano salobro de Napa Sonoma no norte da baía de San Pablo e seus afluentes do riacho Sonoma e do rio Napa . Também recolonizando recentemente a baía e seus afluentes, a lontra de rio norte-americana ( Lontra canadensis ) foi relatada pela primeira vez em Redwood Creek em Muir Beach em 1996, e recentemente em Corte Madera Creek , e na baía sul em Coyote Creek , também como em 2010 na própria Baía de São Francisco, na Marina de Richmond .
Castor de um ano em Alhambra Creek , no centro de Martinez
Leões- marinhos ( Zalophus californianus ) no Pier 39
Foca do Pacífico ( Phoca vitulina richardii )
Lontra tomando sol nas rochas na Marina de Richmond
Humphrey, a baleia, uma baleia jubarte ( Megaptera novaeangliae ) que entrou na baía
Toninha ( Phocoena phocoena )
O rato da colheita de pântano ( Reithrodontomys raviventris ) é uma espécie ameaçada de extinção, endêmica dos pântanos da Baía de São Francisco, com alta tolerância ao sal.
Medusa
As medusas não eram prevalentes no estuário até recentemente. Nos estuários da Costa Leste, como a Baía de Chesapeake , eles costumam ser predadores de alto nível , alimentando-se indiscriminadamente de peixes e zooplâncton. Vários pequenos táxons invasores foram identificados nas regiões de LSZ e de água doce. Essas espécies se estrobilizam no verão, mas mantêm os pólipos no bentos durante todo o ano.
Seu impacto sobre o plâncton é desconhecido, mas pesquisas estão em andamento para quantificá-lo. Em densidade suficiente, as geleias podem ter um papel complementar a C. amurensis na supressão do zooplâncton, por habitar áreas de baixa salinidade fora da faixa de amêijoas, onde espécies planctônicas tiveram um refúgio livre de predação.
Corynactis californica encontrada em docas e estacas nas zonas intertidais
Consumidores Bentônicos
A comunidade bentônica assumiu um papel desproporcionalmente grande na ecologia da teia alimentar do estuário devido a invasões importantes por bivalves . O uso desses moluscos, o molusco do rio Amur ( Corbula amurensis ) tem uma ampla tolerância à salinidade que se estende até a zona de baixa salinidade, mas não em água doce. Ele filtra se alimenta de fitoplâncton e pequenos zooplânctons, como os náuplios de copépodes calanóides . O molusco tem poucos predadores no Estuário de São Francisco e isso permite que ele cresça até altas densidades (da ordem de dezenas de milhares / m2). Devido às suas altas taxas de eliminação, é capaz de limpar toda a coluna de água de porções do estuário em poucos dias, levando a populações de plâncton drasticamente esgotadas. Acredita-se que essa seja a principal causa do declínio na produtividade do ecossistema após a invasão das amêijoas em meados da década de 1980.
Solha estrelada ( Platichthys stellatus )
Bat Ray ( Myliobatis californica ) e um Big skate ( Beringraja binoculata ) no Aquário da Baía, ambos encontrados em áreas subtidais da baía
Este declínio na produtividade é essencialmente devido ao redirecionamento da rede pelágica para uma cadeia bentônica por esta espécie. Como o molusco do rio Amur se alimenta de produtores primários, consumidores e predadores, ele impacta vários níveis tróficos . Consequentemente, quase todo o plâncton exibe sinais de competição aparente , pois a produção em um nível trófico impacta todos os outros, aumentando a abundância de moluscos. Isso resulta em um ciclo de feedback negativo : C. amurensis limita a biomassa do plâncton, que por sua vez limita C. amurensis . No entanto, entradas de fora do sistema devido à advecção das marés ou fontes a montante podem aumentar a biomassa de C. amurensis , aumentando ainda mais a limitação do plâncton. Este ciclo de feedback é ainda mais amplificado porque o molusco pode persistir por mais de um ou dois anos, o que aumenta a pressão sobre as populações de plâncton durante os ciclos de baixa produtividade.
O redirecionamento do carbono por C. amurensis para o bentos criou uma cadeia limitada, deixando a teia pelágica depauperada. A produção detrital a partir da excreção e morte de moluscos pode alimentar a produção bacteriana, que pode circular na cadeia alimentar detrítica ou alça microbiana.
Embora os nutrientes reciclados possam dar suporte a algum crescimento do fitoplâncton, em última análise, eles retornam ao aumento das populações de C. amurensis. O sucesso recente da invasão de Limnoithona tetraspina pode ser entendido em função desse fenômeno. Alimenta-se de ciliados e microflagelados muito pequenos para serem pastados pela amêijoa, evitando assim a competição. Além disso, L. tetraspina parece imune à predação por mariscos ou (quase) qualquer outra coisa. O surgimento da teia alimentar microbiana e a invasão de L. tetraspina capitalize são o resultado de um caminho alternativo inexplorado para o fluxo de energia na teia alimentar, facilitado por C. amurensis. Os padrões subsequentes de invasão podem refletir um padrão semelhante.
Caranguejo Dungeness ( Metacarcinus magister )
Caranguejo da rocha vermelha ( Cancer productus )
Espécies introduzidas

A introdução de espécies tem aumentado desde pelo menos o século 19 em função do aumento do comércio e do tráfego. As introduções incluem numerosos táxons, incluindo copépodes, camarões , anfípodes , bivalves , peixes e plantas com raízes e flutuantes. Muitas espécies pelágicas foram introduzidas mais recentemente através da liberação de água de lastro de grandes navios diretamente no estuário. Como resultado, muitas dessas espécies introduzidas se originam de estuários ao redor da Orla do Pacífico, particularmente copépodes como P. forbesi e L. tetraspina. O molusco do rio Amur é originário da Ásia e criou mudanças significativas e drásticas na ecologia do LSZ, principalmente ao desviar o alimento pelágico para o bentos e para um ciclo microbiano acelerado.
As espécies também foram introduzidas por meio de embarcações esportivas que são rebocadas entre regiões. Esta é a provável fonte de uma série de plantas de baixa salinidade, como Egeria densa e aguapé ( Eichhornia crassipes ). Essas plantas criaram mudanças profundas no Delta ao interromper o fluxo de água, sombreando o fitoplâncton e fornecendo habitat para peixes piscívoros como o tucunaré , Morone saxatilis , ele próprio intencionalmente introduzido no final de 1800 a partir da Baía de Chesapeake . O mexilhão quagga de água doce , originário da Europa, deverá ser introduzido por velejadores nos próximos dois a dez anos, apesar das medidas de precaução. Além disso, a pouca idade e o ambiente isolado do estuário do São Francisco resultaram no sucesso de invertebrados invasores devido à falta de biodiversidade.
Invasões futuras
A moderna teia alimentar é derivada de uma série de invasões e substituições tróficas.
Espera-se que esse processo continue, à medida que novos organismos chegam por meio de introduções acidentais ou intencionais. O que é menos claro é até que ponto introduções anteriores pavimentam o caminho para futuras invasões. Isso pode ocorrer de três maneiras.
- Um invasor precoce pode fornecer um recurso que não é utilizado no novo sistema até que um novo predador seja introduzido ( L. tetraspina e a alça microbiana, conforme descrito acima).
- Os primeiros invasores podem facilitar novos, alterando o habitat e tornando-o adequado para invasões subsequentes (pólipos gelatinosos usando conchas de molusco do Rio Amur como substrato).
- A competição aparente entre antigos e novos residentes pode aumentar as possibilidades de invasão e estabelecimento de novos organismos que podem capitalizar recursos inexplorados (o subsídio do molusco do rio Amur por populações a montante do copépode introduzido P. forbesi, criando pressão sobre os copépodes nativos).
Resumo
A rede alimentar LSZ do Estuário de São Francisco opera em duas direções paralelas e assimétricas. A maior parte do carbono é assimilada nas alças bentônica e microbiana, que representam becos sem saída energéticos. Uma fração menor é distribuída para níveis tróficos pelágicos mais elevados, que podem abrigar copépodes, peixes, pássaros e pescarias. Esse redirecionamento da teia alimentar para essas duas alças estreitas pode ser responsável pelo declínio de macroinvertebrados e peixes no estuário, que operam fora dessas cadeias. A restauração do estuário para um grau mais alto de função depende da probabilidade de trazer maiores benefícios para a teia pelágica sem subsidiar a bentônica.
Ecologia futura
A ecologia da Zona de Baixa Salinidade do Estuário do São Francisco é difícil de caracterizar porque é o resultado de uma sinergia complexa de fatores abióticos e bióticos. Além disso, continua a sofrer mudanças rápidas resultantes de espécies recém-introduzidas, influências antrópicas diretas e mudanças climáticas . Mudanças ecológicas futuras serão conduzidas em uma escala ampla do ecossistema, particularmente conforme o aumento do nível do mar , a instabilidade tectônica e o declínio da infraestrutura causam falha no dique no Delta. Espera-se que o retrocesso resultante no fluxo de água force X2 no Delta, colocando em risco o habitat espacialmente orientado (como pântanos de água doce), canalizando a zona de baixa salinidade e ameaçando o abastecimento de água do sul da Califórnia, com consequências desconhecidas e imprevisíveis para o natural e humano ecologia do maior estuário da costa oeste.
Veja também
- Lista de cursos de água na área da Baía de São Francisco
- Hidrografia da área da baía de São Francisco
- O Projeto da Bacia Hidrográfica
- Ciência do Estuário e da Bacia Hidrográfica de São Francisco
Notas
Referências
- Anderson, DM, PM Glibert e JM Burkholder. 2002. Harmful Algal Blooms and Eutrophication: Nutrient Sources, Composition, and Consequences. Estuários 25: 704-726.
- Ball, MD e JF Arthur. 1979. Dinâmica da clorofila planctônica no norte da Baía de São Francisco e Delta. Páginas 265–286 em TJ Conomos, editor. Baía de São Francisco: O estuário urbanizado. Associação Americana para o Avanço da Ciência, Divisão do Pacífico, San Francisco, CA.
- Bennett, WA (2006). Crescimento e sobrevivência do Delta Smelt durante o recente declínio do organismo pelágico: o que os causa tristeza no horário de verão? Conferência de Ciência CALFED. Sacramento, CA.
- Bouley P., WJK (2006). "Ecologia de um copépodo ciclopóide altamente abundante introduzido em um estuário temperado." Marine Ecology Progress Series 324: 219-228.
- Burau, JR (1998). "Resultados do elemento hidrodinâmico do estudo da zona de aprisionamento de 1994 em Suisun Bay, Sacramento, CA."
- Carlton, JT, JK Thompson, LE Schemel e FH Nichols. 1990. Invasão notável da Baía de São Francisco (Califórnia, EUA) pelo molusco asiático Potamocorbula amurensis. 1. Introdução e dispersão. Série de progresso da ecologia marinha. 66: 81-94.
- Carlton, J. (1996). “Biological Invasions and Cryptogenic Species.” Ecology 77 (6).
- Cole, BE e JE Cloern. 1987. Um modelo empírico para estimar a produtividade do fitoplâncton em estuários. Série de progresso da ecologia marinha. 36: 299-305.
- Cole, BE, JK Thompson e JE Cloern (1992). "Medição das taxas de filtração por bivalves infaunais em um canal de recirculação." Marine Biology 113: 219–225.
- Cloern, JE 1987. Turbidity as a control on fitoplâncton biomassa e produtividade em estuários. Continental Shelf Research 7: 1367-1381.
- Conomos, TJ, Ed. (1979). Baía de São Francisco: O estuário urbanizado. San Francisco, CA, Divisão do Pacífico, Associação Americana para o Avanço da Ciência.
- Deverel, S. (1998). Mitigação de subsidência no Delta de Sacramento-San Joaquin., Programa CALFED Bay-Delta.
- Dey, R. (2007, 16 de janeiro de 2007). "Atualização de mexilhões invasivos da Área de Recreação Nacional do Lago Mead." 100th Meridian Initiative, de http: // 100thmeridian . org / hidromel. asp.
- Dugdale, RC, V. Hogue, A. Marchi, A. Lassiter e F. Wilkerson. 2003. Efeitos da entrada e fluxo de amônio antropogênico na produção primária na Baía de São Francisco. CALFED Science Program, Sacramento, CA.
- Durand, J. (2006). Determinantes da falha de recrutamento de copépodes calanóides no Programa de Ciência de Calefação do Estuário de São Francisco. Sacramento, CA.
- Epstein, E. (2006). Barragens barulhentas prontas para o desastre. San Francisco Chronicle. São Francisco.
- Hollibaugh, JT e PS Wong. 1996. Distribution and activity of bacterioplankton in San Francisco Bay. Páginas 263–288 em JT Hollibaugh, editor. Baía de São Francisco: o ecossistema. Associação Americana para o Avanço da Ciência, San Francisco, CA.
- Jassby, AD, JE Cloern e BE Cole. 2002. Produção primária anual: Padrões e mecanismos de mudança em um ecossistema de marés rico em nutrientes. Limnology and Oceanography 47: 698-712.
- Jassby, AD, JE Cloern e TM Powell. 1993. Fontes e sumidouros de carbono orgânico na Baía de São Francisco - variabilidade induzida pelo fluxo do rio. Série de progresso da ecologia marinha. 95
- Jassby, AD e JE Cloern. 2000. Fontes de matéria orgânica e reabilitação do Delta de Sacramento-San Joaquin (Califórnia, EUA). Conservação Aquática: Ecossistemas Marinhos e de Água Doce 10: 323-352.
- Jassby, AD, JE Cloern e BE Cole. (2002). "Produção primária anual: Padrões e mecanismos de mudança em um ecossistema de marés rico em nutrientes." Limnologia e Oceanografia 47 (3): 698–712.
- Kimmerer, WJ, E. Gartside e JJ Orsi. (1994). “Predação por um molusco introduzido como a causa provável de declínios substanciais no zooplâncton da Baía de São Francisco.” Mar. Ecol. Prog. Ser. 113: 81–93.
- Kimmerer, WJ, JJ Orsi. 1996. Mudanças no zooplâncton do estuário da Baía de São Francisco desde a introdução do molusco Potamocorbula amurensis. Páginas 403–425 em JT Hollibaugh, editor. Baía de São Francisco: o ecossistema. Associação Americana para o Avanço da Ciência, San Francisco, CA.
- Kimmerer, WJ, JR Burau e WA Bennett. (1998). "Migração vertical orientada pelas marés e manutenção da posição do zooplâncton em um estuário temperado." Limnol. Oceanogr. 43 (7): 1697-1709.
- Kimmerer, WJ (2002). "Respostas físicas, biológicas e de gestão ao fluxo variável de água doce no Estuário de São Francisco." Estuários 25: 1275–1290.
- Kimmerer, W. (2004). "Processo de águas abertas do Estuário de São Francisco: do forçamento físico às respostas biológicas." San Francisco Estuary and Watershed Science 2 (1).
- Kimmerer, W. (2006). "A resposta das anchovas amortece os efeitos invasivos do bivalve Corbula amurensis na teia alimentar do Estuário de São Francisco." Marine Ecology Progress Series 324: 207–218.
- Lee, CE (1999). “Invasões rápidas e repetidas de água doce pelo copépode Eurytermora affinis.” Evolution 53 (5): 1423–1434.
- Lehman, PW e S. Waller. 2003. Microcystis floresce no delta. Boletim do IEP 16: 18-19.
- Lund, J., E. Hanak, W. Fleenor, R. Howitt, J. Mount, P. Moyle (2007). Prevendo Futuros para o Delta de Sacramento-San Joaquin. São Francisco, Public Policy Institute.
- Modlin, RF e JJ Orsi (1997). "Acanthomysis bowmani, uma nova espécie, e A. asperali, Mysidacea relatado recentemente do Estuário Sacramento-San Joaquin, Califórnia (Crustacea: Mysidae)." Proceedings of the Biological Society of Washington 110 (3): 439-446.
- Monismith, SG, JR Burau e M. Stacey (1996). Dinâmica de estratificação e circulação gravitacional no norte da Baía de São Francisco. Baía de São Francisco: o ecossistema. JT Hollibaugh. San Francisco, CA, American Association for the Advancement of Science: 123–153.
- Moyle, PB, B. Herbold, DE Stevens e LW Miller. (1992). "História de vida e status do fundido delta no estuário de Sacramento-San Joaquin, Califórnia." Sou. Peixe. Soc. 121: 67–77.
- Murrell, MC, JT Hollibaugh, MW Silver e PS Wong. 1999. Dinâmica do bacterioplâncton no norte da Baía de São Francisco: Papel da associação de partículas e fluxo sazonal de água doce. Limnologia e Oceanografia. 44: 295-308.
- Murrell, MC e JT Hollibaugh. 2000. Distribuição e composição do carbono orgânico dissolvido e particulado no norte da Baía de São Francisco durante condições de baixo fluxo. Estuarine, Coastal and Shelf Science 51: 75-90.
- Nichols, FH, JE Cloern, S. Luoma e DH Peterson. 1986. A modificação de um estuário. Science 231: 567-573.
- Nichols, FH, JK Thompson e LE Schemel. 1990. Invasão notável da Baía de São Francisco (Califórnia, EUA) pelo molusco asiático Potamocorbula amurensis. 2. Deslocamento de uma antiga comunidade. Série de progresso da ecologia marinha. 66: 95-101.
- Orsi, JJ e AC Knutson. 1979. O papel do camarão mysid no estuário de Sacramento-San Joaquin e fatores que afetam sua abundância e distribuição. Páginas 401–408 em TJ Conomos, editor. Baía de São Francisco: o estuário urbanizado. Associação Americana para o Avanço da Ciência, Divisão do Pacífico, San Francisco.
- Orsi, JJ e WL Mecum. (1986). "Distribuição e abundância do zooplâncton no Delta do Sacramento-San Joaquin em relação a certos fatores ambientais." Estuários 9 (4 B): 326-339.
- Orsi, JJ e TC Walter. (1991). "Pseudodiaptomus forbesi e P. marinus (Copepoda: Calanoida), os últimos imigrantes copépodes do estuário de Sacramento-San Joaquin na Califórnia." Bull. Plankton Soc. Japão Spec. Vol. (Proceedings of the Fourth International Conference on Copepoda): 553–562.
- Orsi, JJ e S. Ohtsuka. (1999). "Introdução dos copépodes asiáticos Acartiella sinensis, Tortanus dextrilobatus (Copepoda: Calanoida) e Limnoithona tetraspina (Copepoda: Cyclopoida) no Estuário de São Francisco, Califórnia, EUA." Plank. Bio. Ecol. 46: 128–131.
- Peterson, H. 1997. Esturjão recheado com moluscos. Boletim do IEP 9: 19-19.
- Philip, T. (2007). É hora de entregar soluções de água. Sacramento Bee. Sacramento, CA.
- Poulton, VK, JR Lovvorn e JY Takekawa. 2002. Densidade de moluscos e comportamento de alimentação de scaup em San Pablo Bay, Califórnia. O Condor. 104: 518-527.
- Radovich, J. (1963). "Efeitos da temperatura do oceano no movimento em direção ao mar do robalo-listrado, Roccus saxatilis, na costa do Pacífico." California Department of Fish and Game 49: 191–205.
- Richman, SE e JR Lovvorn. 2004. Valor relativo de forrageamento para patos de menor quantidade de mariscos nativos e exóticos da Baía de São Francisco. Ecological Applications 14: 1217-1231.
- Rollwagen-Bollens, GC e DL Penry. 2003. Dinâmica de alimentação de Acartia sp. em um grande estuário temperado (Baía de São Francisco, CA). Marine Ecology Progress Series 257: 139-158.
- Rollwagen-Bollens, G., S. Gifford, A. Slaughter e SM Bollens. 2006. Protistas em um Estuário Temperado: Diversidade, Pastoreio e Consumo por Metazoários. Eos, Transactions of the American Geophysical Union, Ocean Sciences Meeting Supplement. 87:36 OS11D-05.
- Schoellhamer, DH (2001). Influência da salinidade, topografia de fundo e marés nas localizações dos máximos de turbidez estuarina no norte da Baía de São Francisco. Processos de Sedimento Fino Costeiro e Estuarino. WH McAnally e AJ Mehta. Amsterdam, Netherlands, Elsevier: 343–356.
- Sitts RM, AW Knight. 1979. Predação pelos camarões estuarinos Crangon franciscorum Stimpson e Palaemon macrodactylus Rathbun. Biological Bulletin 156: 356-368.
- Smith, SV e JT Hollibaugh (2002). "Trocas de água, sal e nutrientes na Baía de São Francisco." Programa Ecológico Interagências para o Relatório Técnico do Estuário da Baía de São Francisco-Delta 66.
- Taugher, Mike (2005). Sirenes ambientais em Delta estão gritando. Contra Costa Times.
- Trott, JSS, Warren J. Ferguson e Andrew J. Kleinfeld, (2006). Central Delta Water Agency v. Bureau of Reclamation. Tribunal de Apelações dos Estados Unidos para o Nono Circuito. San Francisco, CA.
- Vayssieres, MP (2006). Tendências no bentos do alto São Francisco Esutary. Conferência de Ciência CALFED. Sacramento, CA.
- Werner, I. e JT Hollibaugh. 1993. Potamocorbula amurensis (Mollusca, Pelecyopoda): Comparação das taxas de depuração e eficiências de assimilação para fitoplâncton e bacterioplâncton. Limnology and Oceanography 38: 949-964.